Resumen
El objetivo de este estudio fue evaluar el efecto de la aplicación tópica de melatonina mezclada con hueso porcino colagenizado para acelerar la osteointegración en implantes con superficie (DCD) y reabsorción de la cresta ósea alveolar en perros beagle después de 3 meses de evaluación. Se colocaron 72 implantes dentales en premolares (P3 y P4) y molares inferiores (M1) de 12 perros beagle. (…)
Autores:
José Luis Calvo-Guirado. Profesor Titular Int. Clínica Odontológica Integrada de Adultos. Facultad de Medicina y Odontología. Universidad de Murcia. / Laura López-Marí. Profesor Colaborador de Clínica Odontológica Integrada de Adultos. Facultad de Medicina y Odontología. Universidad de Murcia. / Antonio José Ortiz Ruiz. Profesor Titular Int. Clínica Odontológica Integrada Infantil. Facultad de Medicina y Odontología. Universidad de Murcia. Bruno Negri. Profesor Colaborador de Clínica Odontológica Integrada de Adultos. Facultad de Medicina y Odontología. Universidad de Murcia. / Guillermo Pardo Zamora
Profesor Asociado de Clínica Odontológica Integrada de Adultos. Facultad de Medicina y Odontología. Universidad de Murcia. / Maria Piedad Ramirez Fernandez. Práctica Privada Murcia / Rafael Delgado Ruiz. Profesor Asociado de Patología y Terapéutica Dental. Facultad de Medicina y Odontología. Universidad de Murcia. / Jose Eduardo Maté Sanchez
Profesor Asociado de Patología y Terapéutica Dental. Facultad de Medicina y Odontología. Universidad de Murcia. / Jose María Martínez González. Profesor Titular de Cirugía Bucal. Facultad de Odontología. Universidad Complutense de Madrid UCM. / Cristina Barona Dorado. Profesor Asociado de Cirugiía Bucal. Facultad de Odontología. UCM.
(…) Cada hemi-mandíbula recibió tres implantes de paredes paralelas con superficie (DCD) de 4 mm de diámetro y 10 mm de longitud. Los implantes fueron asignados mediante la técnica de “Split Mouth” en alveolos distales a cada lado de la mandíbula en tres grupos: el grupo I con implantes solo DCD, el grupo II con implantes de melatonina y el grupo III con implantes de melatonina y el hueso porcino MP3 (Osteobiol, Osteogenos, Madrid). Antes de la implantación, se aplicaron 5 mg de melatonina en polvo liofilizado en cada alveolo de los premolares (P4) a cada lado de la mandíbula y en el alveolo del primer molar inferior, mezclado con hueso porcino colagenizado MP3. No se aplicó melatonina en los sitios de control. Se obtuvieron diez cortes histológicos por implante para el estudio histomorfométrico. Después de un periodo de tratamiento de 4 semanas, la melatonina aumentó significativamente el perímetro del hueso que estaba en contacto directo con los implantes tratados (P <0,0001), la densidad ósea (p <0,0001), la formación de hueso nuevo (P <0,0001) en comparación con el control implantes. La aplicación tópica de melatonina en la superficie de DCD puede actuar como un agente biomimético en la colocación de los implantes dentales y aumentar la osteointegración. La melatonina combinada con el hueso porcino colagenizado revela mayor aposición ósea en contacto con los implantes a las 12 semanas (86,4 ± 0,9%) en comparación con los implantes tratados con melatonina tratados (76,4 ± 1,6%) y los implantes sin tratar (67,8 ± 0,7 %).
Introducción
El uso de la melatonina influye en numerosos aspectos de la fisiología, incluyendo el sueño, acciones que pueden estar mediadas por la unión de la indolamina a receptores de membrana (1). Estudios posteriores han establecido acciones de la melatonina con funciones intracelulares, algunos de los cuales dependen de mecanismos que son independientes de la acción de la molécula en los receptores de membrana.
Para estas acciones, han sido identificados los receptores nucleares de melatonina en órganos periféricos (2, 3) y en las células del sistema nervioso central (4). La melatonina es también capaz de unirse a las proteínas citosólicas incluyendo quinasa C (5), calmodulina (6) y calreticulina (7), y probablemente quinona reductasa-2 (8).
También funciona como un protector celular y como un antioxidante (9, 10). Un número de estudios han documentado que la melatonina es un mediador importante en la formación y estimulación ósea (11-13).
Por otra parte, en los cultivos de preosteoblastos la melatonina, de forma dosis-dependiente, promueve el desarrollo de sialoproteína ósea y de otros marcadores de proteínas óseas, incluyendo la fosfatasa alcalina, la osteopontina y osteocalcina, reduciendo la duración de su diferenciación en osteoblastos de 21 días (lo cual es normal) a 12 días (14).
Con respecto al metabolismo óseo, la melatonina actúa directamente sobre los osteoclastos, células multinucleadas que reabsorben la matriz extracelular por diversos mecanismos, incluida la producción de radicales libres. La melatonina, debido a sus propiedades antioxidantes y su capacidad para desintoxicar los radicales libres (15), puede interferir en esta función de los osteoclastos y por lo tanto inhibe la resorción ósea (16).
Se ha observado que la melatonina, en dosis farmacológicas, aumenta la masa ósea mediante la supresión de la resorción a través de la baja regulación del activador del receptor del ligando nuclear B factor-kappa (RANKL) la formación de osteoclastos mediada por la activación (17, 18). Estos datos apuntan hacia un efecto osteogénico de la melatonina que puede ser de importancia clínica, ya que podría ser utilizado como agente terapéutico en situaciones en las que la formación de hueso sería conveniente, como en el tratamiento de las fracturas y en la osteoporosis (16). Relacionando la melatonina con los materiales de estimulación ósea pueden ayudar a los injertos óseos a mejorar la regeneración ósea. La mayoría de los materiales de injerto óseo se consideran osteoconductivos actuando como andamio para la formación de hueso nuevo (18). Recientemente se han utilizado sustitutos óseos de origen porcino para el aumento del suelo del seno maxilar antes de la colocación del implante con alto porcentaje de éxito y estabilidad a largo plazo (19). Diversos autores describen características del uso del hueso porcino donde a las 12 semanas la formación de hueso nuevo uniforme y estable puede observarse mediante microscopía electrónica barrido (MEB), revelando un estrecho contacto entre el hueso nuevo y las partículas de hueso porcino (20, 21).
Los signos de reabsorción de las partículas de hueso porcino han sido descritos por numerosos autores (19, 22), sin embargo, algunos estudios clínicos también indican que el material es reabsorbible hasta pasado un año de su colocación (21, 23). Estos biomateriales derivados del cerdo han demostrado tener una buena biocompatibilidad en alveolos post-extraccion en humanos y en los realizados en animales de experimentación (21, 22).
Los objetivos de nuestra investigación experimental, llevada a cabo con perros beagle, fueron: (i) evaluar el efecto de la aplicación tópica de melatonina mezclada con hueso porcino colagenizado en la osteointegración (contacto implante hueso) de implantes dentales después de 3 meses a partir de su inserción y (ii) para evaluar la pérdida ósea del hueso crestal a 3 meses en implantes sin tratar, implantes recubiertos con melatonina e implantes con melatonina mezclada con con hueso porcino .
Material y métodos
Animales
En este estudio (Universidad de Córdoba, España) se utilizaron doce perros machos de raza beagle (edad: 14-16 meses, peso: 16-18 kg), mantenidos en jaulas estándar y alimentados con una dieta blanda para perros. Todos los experimentos se realizaron según las directrices del Gobierno español y las orientaciones comunitarias para el cuidado de animales de experimentación. El Comité de Ética para la Experimentación Animal de la Universidad de Murcia, España, aprobó el protocolo de estudio a las directrices establecidas por la Unión Europea, Directiva del Consejo de 24 de noviembre 1986 (86/609/CEE).
A los animales no se les suministró alimento durante 12 horas antes de la anestesia para evitar el vómito. Fueron sedados por medio de una inyección intramuscular de 0,5-1 mg/kg de peso corporal maleato de acepromacina, y la anestesia fue inducida mediante inyección intravenosa de 5-8 mg/kg de peso corporal, más ketamina chlorbutol (5-8 mg/kg iv) y 0,05 mg/kg de atropina.
En el trabajo se utilizaron las raíces distales de los terceros premolares mandibulares (3P3), los cuartos premolares mandibulares (4P4) y los primeros molares mandibulares (1M1) en ambos cuadrantes de mandíbula. Estos dientes se han hemi-diseccionado con una fresa de carburo de tungsteno y de las raíces distales extrajeron con fórceps (Figura 1).
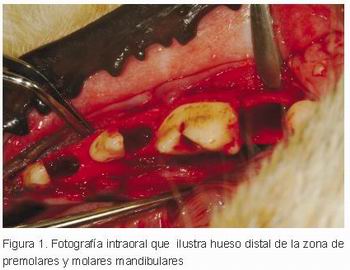 |
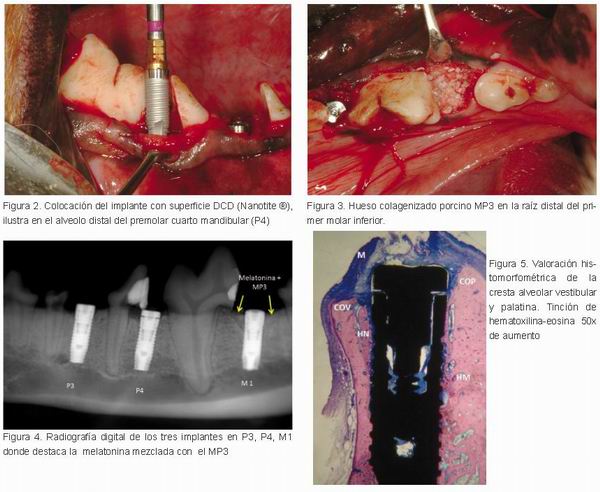
Los conductos radiculares mesiales se rellenaron con hidroxiapatita en la cámara pulpar y sellaron con composite. Se midieron los alveolos en sentido mesial-distal-vestibular y palatino de todos los alveolos post-extracción. La media del reborde alveolar fue 3,8 ± 0,5 mm (3P3), 3,9 ± 1,0 mm (4P4) y 5,8 ± 0,3 mm (1M1). Antes de la implantación, una capa de 5mg de melatonina liofilizada en polvo (Helsinn Advanced Synthesis SA, Biasca, Suiza) se aplicó en el aveolo del P4 (cuarto premolar inferior) y se mezcló con MP3 colagenizado óseo porcino (Osteobiol, Tecnoss Dental SRL, Pianezza, Italia) en la raíz distal del M1 (primer molar inferior) en ambos lados de la mandíbula. En el sitio control (premolar 3) no se aplicó melatonina. Se colocaron 72 implantes de 4 mm de diámetro x 10 mm de longitud NanoTite® (Biomet 3i, Palm Beach Gardens, Florida, EE.UU.) (Figura 2). El cierre de la herida se llevó a cabo mediante suturas reabsorbibles única (Dexon 3-0, Davis y Genk, Nueva Jersey, EE.UU.).
Los implantes se dividieron en tres grupos: grupo I, 24 implantes con una superficie DCD sin melatonina en P3 (grupo control); grupo II, 24 implantes cubiertos con melatonina en el área de P4 (prueba 1), y el grupo III, 24 implantes cubiertos con melatonina mezclada con MP3 ósea porcina (prueba 2) (Figura 3). Todos los implantes fueron colocados con el cuello ligeramente apical de la cresta ósea bucal y lingual con el fin de mejorar el anclaje durante la fase inicial tras la colocación del implante. Al final del periodo experimental (2, 4 y 12 semanas después de la colocación del implante), los perros se sacrificaron mediante la inducción de un paro cardiaco por medio de una inyección intravenosa de una solución al 20% de pentobarbital (Dolethal ®, Vétoquinol, Buckingham, Reino Unido).
 |
Evaluación de los implantes
Los implantes fueron retirados junto con el hueso circundante y fijados en formol al 10% neutro tamponado. Las muestras se deshidrataron en una serie gradual de alcohol, se infiltró e incrustada con Technovit 7200 VLC (Heraeus Kultzer, Dormagen, Alemania). Las muestras fueron cortadas en paralelo al eje longitudinal del implante en una dirección buco-lingual y procesados por el método de Donath (24). Ocho secciones se hicieron por implante. Cada sección se molió hasta el espesor aproximado de 20 um y se tiñeron con hematoxilina-eosina la técnica de tinción. Para el análisis histomorfométrico, se emplearon imágenes magnificadas 40x· Se evaluaron en formato digital (DP12, Olympus, Nagano, Japón). Para el análisis de la imagen se utilizó Microfilm 4,0 (Media Cybernetics, Silver Spring, Maryland, EE.UU.). Los análisis fueron realizados todos por el mismo investigador. El contacto implante hueso (BIC) fue medido el vestibular y lingual de todos los implantes y mediante microscopía electrónica de barrido (MEB) se evaluó la composición ósea a las 2, 4 y 12 semanas. Las radiografías de cada grupo se tomaron después de que los perros fueran sacrificados (Figura 4).
Análisis estadístico
Todos los datos se expresan como media ± SEM. La prueba de ANOVA se utilizó para analizar las diferencias entre las variables. Los análisis estadísticos fueron realizados utilizando el programa de ordenador SPSS 11,0 (SPSS, Chicago, IL, EE.UU.). El nivel de significación estadística se estableció en P <0,05.
Resultados
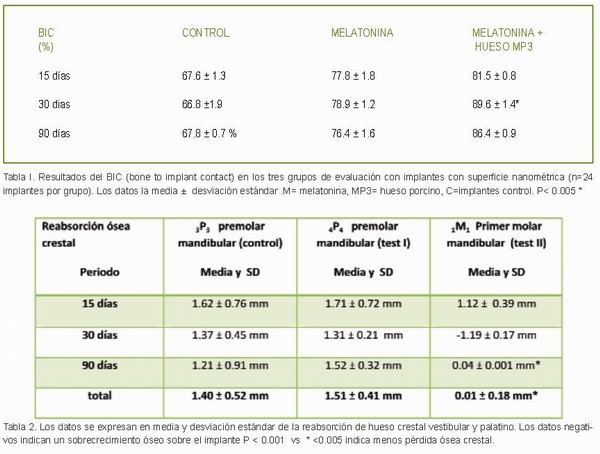
Los resultados para los diferentes parámetros histomorfométricos de osteointegración se presentan en la Tabla 1. En cuanto al parámetro del contacto implante hueso (BIC), se observó un aumento del mismo en los tres periodos de tiempo (2, 4 y 12 semanas) en los implantes recubiertos por melatonina y hueso porcino MP3.
A las 4 semanas la melatonina con el hueso MP3 aumentado el BIC de forma estadísticamente significativa (P <0,05). En la imagen histológica del implante analizado podemos observar la delgadez de la pared vestibular y la anchura más importante en la pared palatina, donde se encuentran las crestas alveolares y la relación intima con el hueso circundante (Figura 5). La media de reabsorción ósea en la cresta fue menor en los implantes con melatonina y hueso porcino MP3 a las 2 semanas, en comparación con los implantes con melatonina- y control. A las 4 semanas, en el grupo III se observó un crecimiento excesivo (-1,19 ± 0,17 mm) en la parte superior de los implantes, más marcado que en grupo I y II. Posteriormente, a los 3 meses, los datos revelan menor reabsorción ósea en el tratamiento relacionado con el grupo III. (Tabla 2).
 |
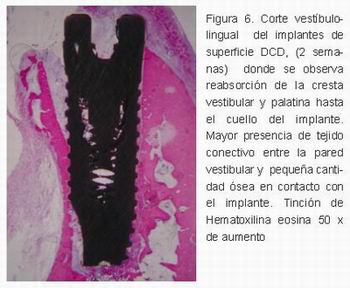
A las dos semanas, pequeñas cantidades de hueso recién formado se habían producido en las partes apical y lateral de los implantes, estableciéndose un contacto directo más destacado con respecto al grupo control. La formación de hueso nuevo trabecular se pudo observar en múltiples estructuras vasculares, a menudo se extiende desde el hueso nativo hasta llegar a la superficie del implante DCD. Los osteoblastos se alineaban en las trabéculas óseas, tejidos, y en algunas zonas osteocitos estuvieron presentes en el hueso recién formado (Figura 6).
 |
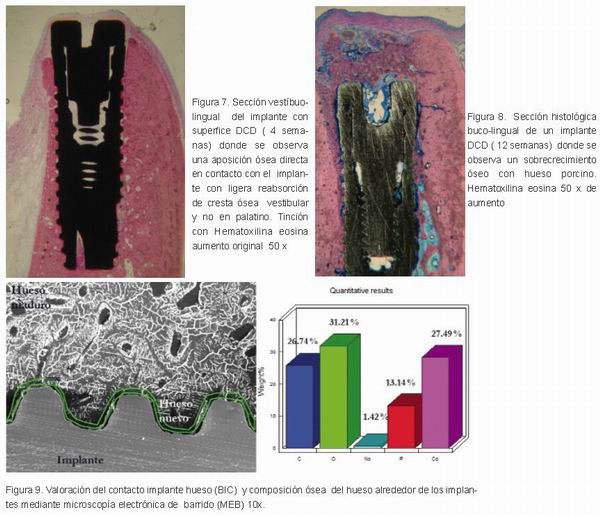
En la cuarta semana, el hueso recién formado tejido se extendía desde el cuello del implante hasta el hueso nativo de la superficie del implante, y también se proyectaba paralelo a la implantación a lo largo de ambas superficies de control y prueba. En el grupo II de melatonina se observó gran cantidad de hueso nuevo en la cresta vestibular y lingual (Figura 7 ).
A las doce semanas, los osteoclastos dispersos se encontraron en los lugares correspondientes de la pared ósea lingual. La parte interna de la región fue ocupada por médula ósea, pero incluyendo trabéculas de tejido mineralizado que se compone de huesos y tejido óseo del hueso laminar en contacto directo con los implantes. En el grupo III se observó un crecimiento excesivo de hueso nuevo en la parte superior del implante en el grupo de la melatonina (Figura 8).
Los datos de la composición ósea del hueso en contacto directo con los implantes (BIC) fueron evaluados en los tres periodos de tiempo (2, 4 y 12 semanas) mediante microscopía electrónica de barrido (MEB), donde la media de Carbono (C) fue de 26,74 %, Oxígeno (O) fue de 31,21 %, Sodio (Na) 1,42, Fósforo (P) 13,14 % y el Calcio (Ca) fue de 27,49 % (Figuras 9 a 12).
 |
 |
Discusión
Varios estudios in vitro han demostrado que la melatonina es un mediador importante en la formación ósea y el estímulo, la promoción de diferenciación osteoblástica (14, 25). Los vínculos entre la melatonina y el metabolismo óseo se han documentado en muchos estudios (14, 16, 17, 27). Se sabe que la melatonina está presente en altas concentraciones en la médula ósea, cuando sobrepasen los niveles séricos de 100 veces (10). Además, se ha demostrado que la melatonina influye en los precursores de las células óseas en la médula ósea de ratas (28). Además, la indolamina ha demostrado ser un modulador importante del metabolismo del calcio, y previene la osteoporosis e hipocalcemia en algunos casos, probablemente debido a su interacción con factores de óseos, como la hormona paratiroidea, la calcitonina o las prostaglandinas (29,39 ).
Cuatro semanas después de la inserción del implante, la melatonina con hueso colagenizado porcino aumenta significativamente la osteointegración y reduce la reabsorción de la cresta ósea alveolar. En general, los sustitutos óseos sean alo o xenogénica orígenes, o están realizados a partir una base de calcio. El hueso bovino desproteinizado (DBB) es uno de los sustitutos óseos mejor documentados con propiedades osteoconductivas (31,32).
Recientemente, se han utilizado sustitutos óseos de origen porcino para el aumento del suelo del seno maxilar antes de la colocación del implante (22). A las 12 semanas, la formación de hueso reveló un estrecho contacto con el implante (20,21). La mayor cantidad de tejido óseo en contacto directo con los implantes que recibieron melatonina y hueso porcino. La melatonina estimula la diferenciación de las líneas preosteoblásticas, por lo que las células tratadas con melatonina maduran hasta convertirse en osteoblastos después de un período de 12 días, en comparación con 21 días para los preosteoblastos del grupo control (13). En nuestro estudio, el aumento en la proliferación de osteoblastos provocada por la melatonina se ve en la producción de un mayor número de estas células en la zona peri-implante, también, la diferenciación temprana de la célula que aceleró considerablemente la síntesis y la mineralización de la matriz osteoide alrededor de los implantes con hueso porcino. Esto puede explicar la mayor cantidad de hueso mineralizado matriz alrededor de los implantes tratados con melatonina sola o mezclada con MP3, así como el aumento significativo de BIC después de 4 semanas. Este rápido aumento de la formación ósea sugiere que la melatonina actúa en dos niveles diferentes de forma simultánea en el proceso de remodelación ósea. Es bien sabido que los osteoclastos, células multinucleadas responsables de la resorción ósea, contienen superóxido dismutasa lo que puede contribuir a la degradación de los componentes de la matriz ósea, ya que las moléculas estructurales de la matriz, como el colágeno o el ácido hialurónico, son susceptibles al daño oxidativo por radicales libres (33). Parece que la melatonina actúa a nivel de la laguna de osteoclastos, debido a sus propiedades antioxidantes (10, 16, 33) y su capacidad para neutralizar las especies reactivas, lo que inhibe la resorción ósea. Los macrófagos y los leucocitos de los vasos sanguíneos alrededor del implante fomentan un aumento de radicales libres (34), que estimulan la resorción ósea por parte de los osteoclastos (36-39). Según algunos autores, la aplicación de indolamina en concentraciones que iban desde 5 hasta 500 ml reduce, de forma dosis-dependiente, la expresión del ARNm de la RANK y aumenta los niveles de ambos OPG y del ARNm de la OPG en líneas celulares preosteoblast MC3T3-E1 (23). Esto indica que la melatonina puede dar lugar a una reducción de la resorción ósea y un aumento de la masa ósea debido a la represión de la activación de los osteoclastos a través de RANK (16).
Estas acciones de la melatonina sobre el tejido óseo son de interés, ya que puede ser posible aplicar la melatonina durante la cirugía de implante dental como agente biomimético en la estimulación ósea (37,38). Como resultado, el proceso de curación puede ser más preciso, más rápido y las condiciones iniciales de los tejidos del receptor puede ser mejorado. Estos datos son alentadores si utilizamos biomateriales biocompatibles en el cual el proceso de reabsorción sea lento y permita actuar a agentes biomiméticos para su formación de hueso nuevo (19-22). Nuestro estudio valoró la posibilidad de que la aplicación tópica de un injerto de hueso de cerdo y melatonina sinérgicamente para promover en la formación ósea in vivo mediante la mejora de la diferenciación y la proliferación de células osteogénico (39,40). El objetivo del presente estudio fue evaluar el efecto del injerto de hueso de cerdo y la melatonina sobre la oseointegración de los implantes dentales y evitar la pérdida ósea crestal.
La melatonina combinada con hueso porcino colagenizado MP3 sobre implantes de superficie DCD revela mayor formación ósea en contacto con el implante (BIC) y menor reabsorción del hueso crestal del alveolo a las 12 semanas, en comparación con la melatonina sola (test 1) y con el grupo control . Nuestro estudio sugiere la combinación de melatonina y MP3 para mejorar el contacto implante hueso BIC y reducir la pérdida de hueso de la crestal.
Agradecimientos
Los autores de este trabajo agradecen la colaboracion de Antonio Maurandi López (Estadístico CAID), Nuria García Carrillo(Veterinaria de la Universidad de Murcia), Prof. Manuel Canteras Jordana (Catedrático de Estística de la Universidad de Murcia), Prof. Gerardo Gómez Moreno, Dr. Javier Guardia Muñoz y Prof. Antonio Cutando Soriano (Facultad de Odontología de Granada) por su enrome colaboracion en este trabajo de investigación.
BIBLIOGRAFÍA
1. Cuzzocrea S, Mazzon E, Serraino I, et al. Melatonin reduces dinitrobenzene sulfonic acid-induced colitis. J Pineal Res 2001; 30: 1-12.
2. Acuña-Castroviejo D, Pablos MI, Menendez-Pelaez A, et al. Melatonin receptors in purified cell nuclei of liver. Res Commun Chem Pathol Pharmacol 1993; 82: 253-256.
3. Hirose T, Smith RJ, Jetten Am. ROR gamma: the third member of ROR/RZR orphan receptor subfamily that is highly expressed in skeletal muscle. Biochem Biophys Res Commun 1994; 205: 1976-1983.
4. Carlberg C, Hooft Van Huijsduijnen R, Staple JK, et al. RZRs, a new family of retinoid-related orphan receptors that function as both monomers and homodimers. Mol Endocrinol 1994; 8: 757-770.
5. Anton-Tay F, Ramirez G, Martinez I, et al. In vitro stimulation of protein kinase C by melatonin. Neurochem Res 1998; 23: 601-606.
6. Huerto-Delgadillo L, Antón-Tay F, Benítez-King G. Effects of melatonin on microtubule assembly depend on hormone concentration: role of melatonin as a calmodulin antagonist. J Pineal Res 1994; 17: 55-62.
7. Macias M, Escames G, Leon J, et al. Calreticulin–melatonin. An unexpected relationship. Eur J Biochem 2003; 270: 832-840.
8. Tan DX, Manchester LC, Terron MP, et al. Melatonin as a naturally occurring co-substrate of quinone reductase-2, the putative MT(3) melatonin membrane receptor: hypothesis and significance. J Pineal Res 2007; 43: 317-320.
9. Tomas-Zapico C, Coto-Montes A. A proposed mechanism to explain the stimulatory effect of melatonin on antioxidative enzymes. J Pineal Res 2005; 39: 99-104.
10. Tan Dx, Manchester Lc, Terron Mp, et al. One molecule, many derives: a never ending interaction of melatonin with reactive oxygen and reactive nitrogen species? J Pineal Res 2007; 42: 28-42.
11. Reiter RJ. Pineal melatonin: cell biology of its synthesis and of its physiological interactions. Endocr Rev 1991; 12: 151-180.
12. Witt-Enderby PA, Radio NM, Doctor JS, et al. Therapeutic treatments potentially mediated by melatonin receptors: potential clinical uses in the prevention of osteoporosis, cancer and as an adjuvant therapy. J Pineal Res 2006; 41: 297-305.
13. Nakade O, Koyama H, Ariji H, et al. Melatonin stimulates proliferation and type I collagen synthesis in human bone cells in vitro. J Pineal Res 1999; 27: 106-110.
14. Maldonado MD, Murillo-Cabezas F, Terron MP, et al. The potential of melatonin in reducing morbidity–mortality after craniocerebral trauma. J Pineal Res 2007; 42: 1-11.
15. Cardinali DP, Ladizesky MG, Boggio V, et al. Melatonin effects on bone: experimental facts and clinical perspectives. J Pineal Res 2003; 34: 81-87.
16. Koyama H, Nakade O, Takada Y, et al. Melatonin at pharmacologic doses increases bone mass by suppressing resorption through down-regulation of the RANKL-mediated osteoclast formation and activation. J Bone Miner Res 2002; 17: 1219-1229.
17. Cutando A, Gomez-Moreno G, Arana C, et al. Melatonin: potential functions in the oral cavity. J Periodontol 2007; 78: 1094-1102.
18. Barone A, Crespi R, Aldini NN, et al. Maxillary sinus augmentation: histologic and histomorphometric analysis. Int J Oral Maxillofac Implants 2005; 20: 519-525.
19. Kim SH, Shin JW, Park SA, et al. Chemical, structural properties and osteoconductive effectiveness of bone block derived from porcine cancellous bone. J Biomed Mater Res Part B: Appl Biomater 2004; 68B: 69-74.
20. Orsini G, Scarano A, Piattelli M, et al. Histologic and ultrastructural analysis of regenerated bone in maxillary sinus augmentation using a porcine bone-derived biomaterial. J Periodontol 2006; 77: 1984-1990.
21. Nannmark U, Sennerby L. The bone tissue responses to prehydrated and collagenated cortico-cancellous porcine bone grafts: A study in rabbit maxillary defects. Clin Implant Dent Related Res 2008; 10: 264-270.
22. Piatelli M, Favero GA, Scarano A, et al. Bone reactions to anorganic bovine bone (Bio-Oss) used in sinus augmentation procedures: a histologic long-term report of 20 cases in humans. Int J Oral Maxillofac Implants 1999; 14: 835-840.
23. Hallman M, Lundgren S, Sennerby L. Histologic analysis of clinical biopsies taken after 6 months and 3-years after maxillary sinus floor augmentation with 80% bovine hydroxyapatite and 20% autogenous bone mixed with fibrin glue. Clin Implant Dent Relat Res 2001; 2: 87-96.
24. Donath K, Breuner G. A method for the study of undecalcified bones and teeth with attached soft tissues. The Sage-Schliff (sawing and grinding) technique. J Oral Pathol Med 1982; 11: 318-326.
25. Satomura K, Toblume S, Tokuyama R, et al. Melatonin at pharmacological doses enhances human osteoblastic differentiation in vitro and promotes mouse cortical bone formation in vitro. J Pineal Res 2007; 42: 231-239.
26. Conconi S, Hertens E, Skwarlo-Sonta K, et al. Evidence for melatonin synthesis in mouse and human bone marrow cells. J Pineal Res 2000; 28: 193-202.
27. Roth JA, Kim Bg, Lin Wl, et al. Melatonin promotes osteoblast differentiation and bone formation. J Biol Chem 1999; 274: 22041-22047.
28. Hakanson DO, Penny R, Bergstrom WH. Calcemic responses to photic and pharmacologic manipulation of serum melatonin. Pediatr Res 1987; 22: 414-416.
29. Ostrowska Z, Kos-Kudla B, Nowak M, et al. The relationship between bone metabolism, melatonin and other hormones in sham-operated and pinealectomized rats. Endocr Regul 2003; 37: 211-224.
30. Klinge B, Alberius P, Isaksson S, et al. Osseous response to implanted natural bone mineral and synthetic hydroxyapatite ceramics in the repair of experimental skull bone defects. J Oral Maxillofac Surg 1992; 80: 241-249.
31. Hallman M, Sennerby L, Lundgren S. A clinical and histologic evaluation of implant integration in the posterior maxilla after sinus floor augmentation with autogenous bone, bovine hydroxyapatite, or a 20: 80 mixture. Int J Oral Maxillofac Implants 2002; 17: 635-643.
32. Radio Nm, Doctor Js, Witt-Enderby Pa. Melatonin enhances alkaline phosphatase activity in differentiating human adult mesenchymal stem cells grown in osteogenic medium via MT2 melatonin receptors and the MEK/ERK (1/2) signaling cascade. J Pineal Res 2006; 40: 332-342.
33. Halleen Jm, Raisanen S, Salo Jj, et al. Intracellular fragmentation of bone resorption products by reactive oxygen species generated by osteoclastic tartrate-resistant acid phosphatase. J Biol Chem 1999; 274: 22907-22910.
34. Bai XC, Lu D, Liu AL, et al. Reactive oxygen species stimulates receptor activator of NF-kappaB ligand expression in osteoblast. J Biol Chem 2005; 280: 17497-17506.
35. Cutando A, Gomez-Moreno G, Arana C, et al. Melatonin reduces oxidative stress because of tooth removal. J Pineal Res 2007; 42: 419-420.
36. Cutando A, Arana C, Gomez-Moreno G, et al. Local application of melatonin into alveolar sockets of beagle dogs reduces tooth removal-induced oxidative stress. J Periodontol 2007; 78: 576-583.
37. Gomez-Moreno G, Cutando-Soriano A, Arana C, et al. Melatonin expression in periodontal disease. J Periodontal Res 2007; 42: 536-540.
38. Simon Z, Watson PA. Biomimetic dental implants – new ways to enhance osseointegration. J Can Dent Assoc 2002; 68: 286-288.
39. Calvo-Guirado JL, Gómez-Moreno G, Barone A, Cutando A, Alcaraz-Baños M, Chiva F, López-Marí L, Guardia. Melatonin plus porcine bone on discrete calcium deposit implant surface stimulates osteointegration in dental implants.J Pineal Res. 2009 Sep; 47(2): 164-72.
40. Calvo-Guirado JL, Gómez-Moreno G, López-Marí L, Guardia J. Martinez González Jm, Barone A, Tresguerres IF, Paredes SD, Fuentes-Breto L. Actions of melatonin mixed with collagenized porcine bone versus porcine bone only on osteointegration of dental implants. J Pineal Res. 2010; 48: 194-203.




