Dra. Clara Gómez. Científico Titular del CSIC – Dra. Arantza Domínguez. Odontóloga. Departamento de Química Láser Instituto de Química Física Rocasolano
Consejo Superior de Investigaciones Científicas (CSIC), Madrid / Dra. Ana Isabel García Kass. Odontóloga. Máster en Periodoncia / Dr. Juan Antonio García Núñez
Doctor en Medicina y Cirugía. Profesor Titular de la UCM). Departamento de Estomatología III. Facultad de Odontología. Universidad Complutense de Madrid (UCM), Madrid
Fuentes de financiación
El trabajo descrito en el presente estudio fue financiado por un Proyecto Intramural (Ref. 200880I215) del Consejo Superior de Investigaciones Científicas, CSIC, concedido a la doctora. Clara Gómez. Además queremos agradecer a Schütz Dental Group, Weil-Dental GmbH Enterprise, por habernos cedido el equipo de Nd:YAG (Diodium-Schütz Weil-Dental) y a Kavo Biberach, Alemania, por prestarnos el equipo de Er.YAG (Key III Plus).
Resumen
Objetivos: Comparar efectos clínicos, antimicrobianos y antiinflamatorios de dos terapias láser (láser Nd:YAG y láser Er:YAG) aplicadas adicionalmente al raspado y alisado radicular (RAR).
Material y métodos: 45 pacientes con periodontitis crónica distribuidos aleatoriamente en 3 grupos de 15 para recibir: RAR, RAR complementado con láser de Nd:YAG o de Er:YAG: (RAR+NDL) y (RAR+ERL), respectivamente. Se analizó: porcentaje de placa en boca total (PPBT), porcentaje de sangrado en boca total (PSBT) y profundidad de sondaje (PS), y se procedió a la recogida de fluido crevicular gingival (FCG) y de placa subgingival antes del tratamiento, a las 4 y 8 semanas posteriores, para la determinación de Interleuquina 1ß (IL1ß), Factor de Necrosis Tumoral a (FNT-a) y estado antioxidante total (EAT) y cuantificación de 10 periodontopatógenos.
Resultados: No se encontraron diferencias estadísticamente significativas entre los tres tipos de tratamientos en la evolución de PPBT, PSBT, PS y EAT, ni en la reducción de la flora subgingival total analizada. Sí se encontró un descenso significativo en los niveles de IL-1ß y FNT-a tras RAR+NDL y RAR+ERL.
Conclusiones: La aplicación complementaria de Nd:YAG y Er:YAG promueve un descenso de la inflamación al reducir los niveles de IL-1ß y FNT-a en bolsa periodontal.
Palabras clave
Láser, RAR, Nd:YAG, Er:YAG, periodontitis crónica.
Introducción
La periodontitis crónica es una enfermedad inflamatoria de los tejidos de soporte de los dientes, causada por grupos específicos de microorganismos, que provocan la destrucción progresiva del ligamento periodontal y hueso alveolar con la consiguiente formación de bolsas, recesiones o ambas (1).
En la boca humana, la acumulación no restringida de microorganismos en las superficies expuestas de los dientes y en las células epiteliales de revestimiento de la bolsa periodontal, origina la placa subgingival dental, que conduce a la enfermedad periodontal (2, 3). Las especies bacterianas que lo integran constituyen un conjunto de más de 500 especies, algunas potencialmente patógenas que conviven con un amplio rango de especies compatibles no patógenas para el hospedador, que van colonizando secuencialmente el área periodontal durante un prolongado periodo de tiempo antes de la iniciación de la enfermedad.
Es un hecho conocido que la difusión de productos microbianos (especialmente los producidos por los bacilos Gram negativos) promueve la inflamación local, de forma que una gran cantidad de polimorfonucleares (PMN) son atraídos a la zona de interacción entre las bacterias y la superficie tisular. Los PMN son leucocitos predominantes en el conectivo subepitelial, su número aumenta en presencia de bacterias y migran a través del epitelio hacia el fluido crevicular, provocando ruptura de hemidesmosomas epiteliales de los tejidos blandos del periodonto. Esta ruptura es inducida por las especies reactivas del oxígeno (ERO): O2-, H2O2, HOCl y el radical OH, generados por los PMN activados (4).
El raspado y alisado radicular (RAR) es el método tradicional de control de la microflora subgingival en el manejo de la enfermedad periodontal. El objetivo del desbridamiento subgingival no sólo consiste en la eliminación de la placa bacteriana adherida y no adherida, sino también es importante la eliminación de los depósitos de cálculo que favorecen la nueva formación de biofilms. Para llevar a cabo el RAR se emplean métodos mecánicos manuales como curetas o aparatos sónicos y ultrasónicos (5). Diversos estudios indican que tanto la anatomía radicular, la morfología y la profundidad de la bolsa periodontal, así como una técnica inadecuada o la propia rugosidad de la superficie del diente, limitan estos procedimientos. Así, tras la instrumentación con curetas se observa cálculo residual y una capa de barrillo dentinario o “smear layer”, constituida por bacterias y mediadores citotóxicos, que podría dificultar la reinserción de los fibroblastos retardando la curación del proceso (6). En los últimos años han aparecido nuevos diseños de curetas y ultrasonidos, así como ácidos y polvos abrasivos, que no obstante, presentan igualmente limitaciones sobre todo a nivel subgingival (7-11).
En la búsqueda de terapias eficaces para lograr una superficie radicular biocompatible, con mayor grado de descontaminación y reducción de la inflamación de los tejidos periodontales adyacentes, aparecen los láseres como terapia alternativa o coadyuvante de los métodos tradicionales. La capacidad de la radiación láser de causar mortalidad bacteriana (12) ha servido para concebir la técnica de la esterilización láser como una herramienta quirúrgica dentro del campo odontológico.
Gracias a los últimos avances, el intervalo de longitudes de onda de emisión de la radiación láser se ha visto ampliado considerablemente, y numerosos estudios sugieren que los láseres pueden ser aplicados en diferentes tipos de tratamientos dentales. Actualmente, existen numerosos láseres comerciales de uso en Periodoncia: Nd:YAG (acrónimo del inglés neodymiun-doped yttrium aluminium garnet), CO2, Er:YAG (acrónimo del inglés erbium-doped yttrium aluminium garnet), diodo… Cada láser tiene una aplicación terapéutica de elección, no pudiendo abordar de forma totalmente efectiva todos los tratamientos. La radiación láser, en función de su longitud de onda de emisión no se absorbe de igual forma en los tejidos, lo que produce una amplia gama de efectos relacionados con su absorción o profundidad de penetrado en el tejido. Diferentes estudios con diferentes sistemas láser muestran cómo el láser de Nd:YAG contribuye a la eliminación del cálculo dental y a la reducción de los microbios endodónticos (13); también los láseres de diodo y de CO2 han mostrado alto poder desinfectante (14). Más recientemente se ha introducido el láser de Er:YAG por su versatilidad en la ablación de tejidos duros y blandos (15) y por su demostrada capacidad para eliminar no sólo bacterias sino también toxinas bacterianas difundidas por el cemento radicular (16). Por último, láseres de diodo de baja potencia (~mW) ejercen un efecto positivo disminuyendo el sangrado, profundidad de la bolsa y reduciendo niveles de metaloproteinasa-8 (MMP-8) en bolsa periodontal (17).
El medio activo del láser de Nd:YAG es un granate (cristal) y está compuesto por los elementos itrio, aluminio y oxígeno formando una matriz cristalina (Y3Al15O12), dopados con neodimio (ión trivalente de la familia de los lantánidos). Es un láser de luz pulsada con una longitud de onda de emisión de 1.064 nm, por tanto emitiendo dentro de la región espectral del infrarrojo cercano, lo que permite su transmisión a través de fibra óptica de 200 a 400 micras de diámetro, facilitando su manejo y consiguiendo llegar hasta cualquier lugar de la cavidad bucal, inclusive dentro del conducto radicular y del surco periodontal. Por otra parte, debido a que su longitud de onda de emisión apenas es absorbida por el agua, su energía se dispersa o penetra en mayor cuantía en los tejidos biológicos, a diferencia de otros láseres infrarrojos con fuerte absorción por el agua: Er:YAG o CO2. Los efectos fototérmicos del láser de Nd:YAG son útiles para cirugía de tejidos blandos. Gracias a las características de penetración y termogénesis, el láser de Nd:YAG produce una capa gruesa de coagulación en la zona irradiada y es ahí donde muestra un gran poder hemostático. Por consiguiente, el láser de Nd:YAG es efectivo para la ablación de tejidos blandos potencialmente hemorrágicos (18-20).
El medio activo del láser de Er:YAG es también un cristal sintético formado por itrio y aluminio con impurezas de erbio y estructura de granate. Su radiación pulsada e infrarroja emitiendo a 2.940 nm, se caracteriza por ser muy bien absorbida por el agua, tanto es particularmente indicada para una precisa y localizada ablación de los tejidos biológicos con alto contenido acuoso. El coeficiente de absorción del agua para el láser Er:YAG es teóricamente 10.000 y 15.000-20.000 veces mayor que el coeficiente para el láser CO2 y Nd:YAG, respectivamente. Además, como componente de la apatita, los grupos OH muestran su máxima absorción alrededor de 2.800 nm, hecho que explica su capacidad de ablación sobre el esmalte, dentina y hueso, es decir, este láser está indicado tanto para tejidos blandos como duros.
Conviene resaltar que pese a la gran variedad de estudios publicados desde la introducción de la radiación láser en la terapéutica periodontal, apenas existen estudios que comparen el tratamiento convencional y el tratamiento láser conjuntamente sobre estos tres aspectos: reducción de un mismo grupo de periodontopatógenos, inhibición de ciertos mediadores de la inflamación y modulación del estado antioxidativo del FCG; es decir apenas correlacionan la fotodesinfección con el aspecto inflamatorio de la enfermedad. Por ello, el objetivo final del presente trabajo es la realización de un estudio sistemático que evalúe el potencial antimicrobiano y antiinflamatorio que presenta cada tipo de radiación láser aplicada complementariamente al RAR.
Material y métodos
1. Diseño del estudio y población estudiada
Esta investigación es un estudio clínico a corto plazo que compara la respuesta al tratamiento periodontal convencional, con la obtenida con ese mismo tratamiento complementado con terapia láser, en pacientes con periodontitis crónica del adulto.
Durante el periodo comprendido entre marzo de 2007 a enero de 2009, se estudiaron 45 pacientes (15 hombres y 20 mujeres), de 45 a 58 años de edad, con una edad media de 51 ± 6 afectados de periodontitis crónica. Como criterios de inclusión se consideraron: presencia de al menos 4 dientes por cuadrante, en los cuales no hubiera coronas, puentes o apoyo de prótesis removible, ni amalgamas tipo II o IV. Presencia de al menos 6 dientes con una profundidad de sondaje > 4 mm y una pérdida de hueso radiográfica (de 30% en los lugares relacionados), de acuerdo a la clasificación de severidad periodontal basada en la localización de la cresta alveolar. Ausencia de lesiones de furca tipo III. Como criterios de exclusión se consideraron: pacientes fumadores o anteriormente fumadores, antecedentes de tratamiento periodontal previo, terapia antibiótica o antiinflamatoria recibida en los últimos tres meses anteriores al tratamiento o durante el tratamiento, uso de colutorios antisépticos, corticoesteroides o inmunosupresores, o cualquier condición sistémica que pudiera afectar al periodonto o el protocolo de tratamiento.
Los 45 participantes recibieron tratamiento periodontal básico incluyendo raspado y alisado radicular (RAR) e instrucciones de higiene oral. Además, 15 pacientes aleatoriamente asignados, recibieron tratamiento complementario con la radiación fundamental de un láser de Nd:YAG (l = 1.064 nm) (RAR+NDL). Del mismo modo, otros 15 recibieron tratamiento complementario con la radiación de un láser Er:YAG (l = 2.940 nm) (RAR+ERL). Todos los pacientes fueron tratados por el mismo operador experimentado (A.D). Para asegurar el carácter ciego del estudio, los pacientes fueron tratados por un examinador (A.G) y un operador (A.D). Además las muestras tomadas se cegaron en el laboratorio donde se procesaron.
En cuanto a los requisitos éticos, una vez explicado el tratamiento por los operadores, los pacientes de forma voluntaria decidieron enrolarse en el estudio mediante la firma del Consentimiento Informado del estudio de investigación. Este estudio cuenta con la aprobación de la Unidad de Coordinación de Ensayos Clínicos del Hospital San Carlos de Madrid.
2. Programa de higiene oral
Antes de realizar el tratamiento en ambos grupos, los pacientes fueron instruidos en la técnica de cepillado de Bass así como en la capacidad de diferenciar la presencia o ausencia de placa bacteriana en las superficies dentales.
Además dependiendo de las exigencias de cada paciente, instruimos en la utilización de cepillos interproximales o seda dental. Los pacientes no utilizaron colutorios durante el estudio, para no modificar los resultados obtenidos.
3. Mediciones clínicas: porcentaje de placa en boca total, porcentaje de sangrado en boca total y profundidad de sondaje
Los parámetros clínicos fueron estudiados en todos los dientes, excluyendo los terceros molares en seis localizaciones: mesio-vestibular, vestibular, disto-vestibular, mesio-lingual, lingual y disto-lingual. Se calculó el Porcentaje de placa en boca total (PPBT), Porcentaje de sangrado en boca total (PSBT) y Profundidad de Sondaje (PS) antes de realizar el tratamiento correspondiente a cada grupo.
El PPBT fue determinado mediante una sonda periodontal en seis localizaciones de cada diente y se registró ausencia o presencia de la misma (Índice modificado de O´Leary y col).
La PS fue obtenida con la ayuda de una sonda periodontal calibrada (CP 15 UNC; Hu-Friedy Instrument Co, Chicago, IL, EEUU). El PSBT se obtuvo simultáneamente a la PS, basándonos en la presencia o ausencia de sangrado después de 30 segundos tras el sondaje.
Dichos parámetros clínicos se anotaron tanto antes de realizar los tratamientos correspondientes a cada grupo, así como, 4 y 8 semanas después del tratamiento, de la misma forma descrita con anterioridad y en las mismas localizaciones en cada uno de los pacientes.
4. Recolección de Fluido Crevicular Gingival (FCG)
La localización seleccionada para la toma de fluido fue la bolsa más profunda de cada cuadrante, tomando así 4 muestras en 4 bolsas periodontales de cada paciente del estudio, excluyendo los terceros molares para evitar contaminación por saliva. La toma de muestras se efectuó al día siguiente de la profilaxis supragingival y del periodontograma para evitar el sangrado y la contaminación de las puntas en la toma de muestras.
Una vez aislado el diente con rollos de algodón se removió la placa supragingival con sonda periodontal sin tocar la encía marginal para una correcta extracción de la muestra. La superficie dentaria fue secada con una jeringa de aire y se recolectó el FCG con puntas de papel prefabricadas (Periopaper, Oraflow INC., Plainview, NY, EEUU), las cuales fueron introducidas en las bolsas periodontales, hasta que la resistencia lo permitiera, y se dejaron durante 30 segundos absorbiendo dicho líquido. Las muestras contaminadas de sangre fueron desechadas.
Después de la recogida de FCG, el volumen de la muestra fue medido con Periotron 8000 (Pro-Flow Inc., Amityville, New Cork, EEUU). Las lecturas del Periotron 8000 fueron convertidas en volumen actual (µl), previa realización de una curva de calibrado realizada con suero humano de pacientes sanos (donantes de sangre) y ajustada a una regresión polinómica de cuarto orden (21).
Las puntas de periopaper fueron almacenadas en viales estériles con filtro y congeladas a -80 ºC para su posterior análisis.
Las muestras se tomaron antes y a las 4 y 8 semanas del tratamiento para analizar los niveles de IL-1ß y TNF-a en FCG y la variación de la capacidad antioxidante total del FCG.
5. Muestras de placa subgingival
Las muestras de placa subgingival fueron recolectadas en localizaciones muy cercanas a las de recogida del FCG.
Una vez aislada la localización con rollos de algodón y secada con jeringa de aire, los depósitos supragingivales fueron removidos cuidadosamente con sonda periodontal. Las muestras de microbiota subgingival se obtuvieron introduciendo 2 puntas de papel estériles N 30 (Dentsply) hasta el nivel más profundo de la bolsa periodontal durante 30 segundos, teniendo cuidado con la posible contaminación con saliva.
Las puntas de papel de cada localización fueron introducidas en viales estériles conteniendo 1,5 ml de medio de transporte RTF y se mandaron al laboratorio 5 minutos después de su recogida, para realizar cultivo microbiológico.
6. Técnicas de tratamiento
Los distintos tratamientos del estudio se realizaron en la Facultad de Odontología, Universidad Complutense de Madrid.
6.1. Tratamiento periodontal básico
Los 45 sujetos enrolados en la investigación (15 pacientes del grupo RAR, 15 pacientes del grupo RAR+NDL y 15 del grupo RAR+ERL) recibieron un tratamiento periodontal básico en la enfermedad periodontal crónica moderada/avanzada, que consistió en la eliminación del sarro supragingival y subgingival.
La eliminación del cálculo supragingival se realizó con ultrasonidos sonicador SONYflex 2003 de Kavo y punta accesoria universal, y posteriormente se aplicó una pasta abrasiva (Dentsply) mediante un cepillo profilaxis de cerda natural (Stoddard., diámetro 8 mm para contra-ángulo).
La eliminación del cálculo subgingival se realizó de forma manual mediante curetas (Hu-Friedy Co., Chicago, IL, EEUU) bajo anestesia con lidocaína 2% (Octocaine 1:100.000, Laboratorios Clarben, S.A., Madrid), durante al menos 30 min/cuadrante o hasta que el operador considerara la correcta eliminación del cálculo.
6.2. Tratamiento láser Nd:YAG
A los 15 pacientes elegidos aleatoriamente para constituir el grupo RAR+NDL, además de realizarles el tratamiento periodontal básico (RAR), se les aplicó de forma complementaria la radiación fundamental de un láser de Nd:YAG (Diodium-Schütz Weil-Dental) emitiendo a 1.064 nm, con una duración de pulso de 2 ms, una frecuencia de 10 Hz y transmitida a través de una fibra óptica de 200 µm introducida dentro de la bolsa periodontal.
La energía de salida del láser, medida con un detector piroeléctrico Gentec-DE 500+ en combinación con una consola Gentec-EO SOLO, fue de 100 mJ, y el tiempo de exposición utilizado por cada superficie de diente (vestibular y lingual) fue de 30 segundos.
6.3. Tratamiento láser Er:YAG
Los 15 pacientes ubicados en el grupo láser RAR+ERL, recibieron la aplicación complementaria de la radiación infrarroja de un láser de Er:YAG (KEY 3+; KaVo, Biberach, Alemania) emitiendo a una longitud de onda de 2.940 nm y en combinación con un sistema de detección de cálculo dental (mediante la señal de fluorescencia inducida en los tejidos mineralizados irradiados con un láser diodo de InGaAsP emitiendo a 655 nm) fue seleccionado para el tratamiento láser usando un nivel de energía de 160 mJ/pulso (medida con el detector piroeléctrico descrito previamente) y una frecuencia de 10 Hz con irrigación de agua destilada de acuerdo a las instrucciones del fabricante. La introducción del láser en la bolsa periodontal se realizó mediante una pieza especialmente diseñada (2261, KaVo, Biberach, Alemania) y una fibra de vidrio biselada (tamaño 0.4 mm x 1.65 mm, factor de transmisión: 0.81) (“blue light wedge”, KaVo , Biberach, Alemania). El tratamiento se efectuó en sentido corono-apical con una inclinación de la fibra de vidrio de 15º-20º respecto a la superficie radicular (22). El tiempo de exposición utilizado por cada superficie de diente (vestibular y lingual) fue de 30 segundos.
7. Procesado de las muestras
Las muestras fueron analizadas en el Laboratorio de Investigación de la Facultad de Odontología, Universidad Complutense, Madrid.
7.1. Medición de IL-1ß y TNF-a
Las muestras diluidas de FGC fueron analizadas para determinar la concentración de mediadores de la inflamación mediante la técnica ELISA (ensayo inmunoabsorbente ligado a enzimas). Los niveles de IL-1ß y TNF-a en FCG fueron determinados por duplicado mediante BLK-223 (kit de ELISA para determinación del TNF-a humano) y BLK-224 (kit de ELISA para la determinación de IL-1ß) respectivamente, ambos de Biolink (Biolink 2000, Barcelona, España), siguiendo las instrucciones del fabricante. Los resultados se calcularon a partir de las curvas estándar creadas para cada estudio. La concentración de citoquina en una determinada posición se calculó dividiendo la cantidad de citoquina determinada por ELISA entre el volumen de FCG extraído correspondiente a esa misma posición, previamente calculado a partir de la curva de calibrado del Periotron 8000, y por tanto se expresó en pg/µl.
7.2. Estado antioxidante total
La determinación de la capacidad antioxidante total se midió mediante el test fotométrico [ImAnOx (TAS) Kit, Immundiagnostik AG, Stubenwald-Allee 8a, D 64625 Bensheim]. Esta determinación se llevó a cabo mediante la reacción de los antioxidantes de la muestra con una cantidad definida de peróxido de hidrógeno proporcionado exógenamente (H2O2). Los antioxidantes de la muestra eliminan una cantidad determinada del H2O2 proporcionado, de manera que el H2O2 residual se determina fotométricamente mediante la reacción enzimática que implica la conversión de 3,3´,5-5´-tetrametilbencidina (TMB) en un producto coloreado. Las muestras se miden a 450 nm, y son expresadas en µmol/l.
7.3. Cultivo microbiológico
Las muestras fueron dispersadas mediante un vortex durante 30 segundos con el fin de conseguir una correcta homogeneidad. Se realizaron diluciones décimo normales (10-0, 10-1, 10-2, 10-3, 10-4) en medio PBS antes de proceder al procesado de las muestras. Para ello se tomaron 0,1 ml del vial y se dispersaron en un tubo con 0,9 ml de tampón fosfato salino (PBS) (10-1), de este tubo se tomaron de nuevo 0,1 ml y se añadieron a otro de nuevo con 0,9 ml de PBS (10-2), y así sucesivamente hasta dilución 10-4, según las necesidades. Se dispensó 0,1 ml de las diluciones 0 y 1 en un medio de cultivo selectivo de Aggregatibacter actinomycetemcomitans (Aa) y 0,1 ml de las diluciones 2, 3 y 4 en un medio de agar-sangre. La muestra se distribuyó homogéneamente en la placa de Petri con ayuda de un asa de vidrio.
El medio Dentaid para Aggregatibacter actinomycetemcomitans (Aa) se incubó 2-3 días en estufa a 37 ºC en una atmósfera con un 5% de CO2 (23).
El medio Agar-sangre (Oxoid no. 2, Oxoid Ltd, Basingstoke, UK) con un 5% de sangre de caballo y un 5% de solución de hemina-menadiona se incubó durante 7 días en estufa a 37 ºC y en jarras de anaerobiosis con 80% de N2, 10% de H2 y 10% de CO2. Para algunas especies de crecimiento más lento es necesario incubar otros 7 días.
La identificación morfológica de Aa se realizó 2 días después del sembrado. Las colonias de Aa son pequeñas, aunque el tamaño varía según el número de colonias en la placa, con borde, y por lo general con una cruz en el centro. Para confirmar la presencia de Aa se realizó la prueba de la catalasa con adición de H2O2 al 3% que sólo en caso positivo producirá la aparición de burbujas.
Pasados 7 días de incubación en medio agar-sangre se detectaron los patógenos periodontales Porphyromonas gingivalis (Pg), Prevotella intermedia (Pi), Parvimonas micra (Pm), Fusobacterium nucleatum (Fn), Campylobacter rectus (Cr), Eikenella corrodens (Ec), Tanerella forsythia (Tf), Capnocytophaga species (Cs) y Eubacterium nodatum (En). Se procedió al recuento de los distintos tipos morfológicos existentes realizando tinción de Gram con el fin de confirmar si se trata de bacilos o cocos y sin son + o – .
Pasados 14 días desde la inoculación de las placas, se procedió al recuento total de colonias existentes para conocer el total de unidades formadoras de colonias por mililitro (UFC/ml), así como el porcentaje de los distintos tipos morfológicos.
8. Análisis estadístico
Se procedió al análisis estadístico descriptivo de los resultados obtenidos (media y desviación típica). Se analizaron las diferencias en la evolución de los parámetros clínicos, microbiológicos e inmunológicos (antes del tratamiento, a las 4 y 8 semanas) entre los tres diferentes tipos de tratamientos aplicados: RAR, RAR+NDL y RAR+ERL.
Para establecer comparaciones intragrupos (entre post-terapia y estado basal), el test utilizado para el análisis estadístico fue el test no paramétrico de Wilcoxon, considerándose los valores de p < 0.05 como estadísticamente significativos. Para establecer comparaciones intergrupos, el test utilizado fue análisis de las varianzas (ANOVA) y para determinar las diferencias entre grupos se procedió a realizar pruebas a posteriori mediante el test Duncan. Los valores p < 0,05 fueron aceptados como estadísticamente significativos.
Resultados
1. Estudio de índices clínicos
En primer lugar, se procedió a evaluar la evolución del PPBT (Figura 1a) durante el periodo estudiado. A las 4 semanas del tratamiento se observó una marcada reducción de dicho índice disminuyendo de manera más suave en el periodo comprendido entre 4 semanas hasta las 8 semanas finales del tratamiento en los grupos tratados con RAR y RAR+NDL. En el grupo tratado con RAR+ERL se observó un ligero aumento (de 21,93 a 25,33) a las 8 semanas. Sin embargo, no se encontraron diferencias significativas entre los tres grupos estudiados.
En cuanto a la evolución del PSBT (Figura 1b), se observó cómo su reducción también fue marcada a las 4 semanas del tratamiento en los tres grupos de estudio. Por otra parte, de los datos de profundidad de sondaje (PS) representados en la Figura 1c, se deduce que los tres tipos de terapia consiguieron reducir la PS durante el tratamiento. A las 4 semanas, la reducción de PS fue estadísticamente significativa en el grupo tratado con RAR+ERL. Sin embargo, a las 8 semanas del tratamiento se observó una reducción más acusada en los grupo tratados con RAR y RAR+NDL frente a la obtenida con el tratamiento RAR+ERL, aunque no significativa estadísticamente.
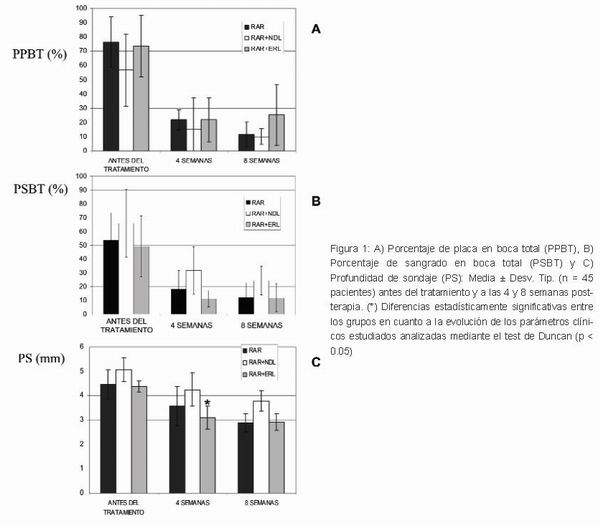 |
2. Estudio microbiológico
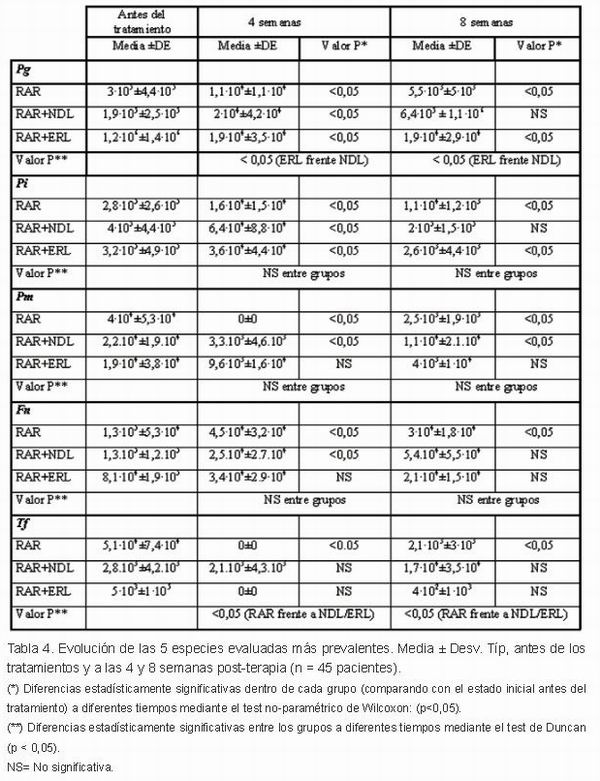
El análisis de la flora total subgingival para cada tratamiento en cada periodo de seguimiento no indica diferencias significativas entre los grupos de tratamientos (Tabla 1), aunque se encontraron diferencias intragrupos estadísticamente significativas (p < 0,05) antes del tratamiento y entre 4 y 8 semanas (Tabla 1).
El número de sitios colonizados por especie en cada periodo del estudio para los tres tratamientos realizados se recoge en la Tabla 2. En general, cada una de las especies evaluadas se redujo 4 semanas después de la terapia, y se observó un pequeño aumento tras 8 semanas. En los grupos RAR+NDL y RAR+ERL, Fn fue la especie más prevalente durante todo el estudio, mientras que en el grupo de RAR, Pi fue la especie más prevalente antes del tratamiento y de nuevo Fn fue la especie más frecuente durante el estudio.
Analizando la Tabla 3, observamos que en los tres grupos la mayoría de las localizaciones estaban infectadas por 3 y 4 especies antes del tratamiento, en el grupo control 75% de las localizaciones, en grupo RAR+NDL 60% y en el grupo RAR+ERL 61%. A las 4 semanas la mayoría de las localizaciones (66%) estaban colonizadas por una sola especie en el grupo control, un 35% en el grupo RAR+NDL y un 25% en el grupo RAR+ERL. A las 8 semanas del tratamiento tan sólo un 8% de las localizaciones seguían estando colonizadas por una especie en el grupo control, un 10% en el grupo RAR+NDL y un 28% en el grupo RAR+ERL. Por tanto, no se observó ventaja adicional después del tratamiento con láser de Nd:YAG en relación a la recolonización bacteriana frente a RAR, sin embargo en el grupo RAR+ERL se puede observar un retraso en la recolonización bacteriana respecto al resto de grupos.
El análisis de las cinco especies más prevalentes en cada periodo (Tabla 4), indicó que no existieron diferencias significativas en cuanto a la reducción de Pi, Pm y Fn entre las tres modalidades de tratamiento. En cuanto a la reducción de Pg, RAR+ERL mostró una mayor reducción, estableciéndose diferencias estadísticamente significativas respecto al tratamiento con RAR+NDL. La cantidad de Tf se redujo significativamente en el grupo RAR a las 4 y 8 semanas si se compara con RAR+NDL y RAR+ERL.
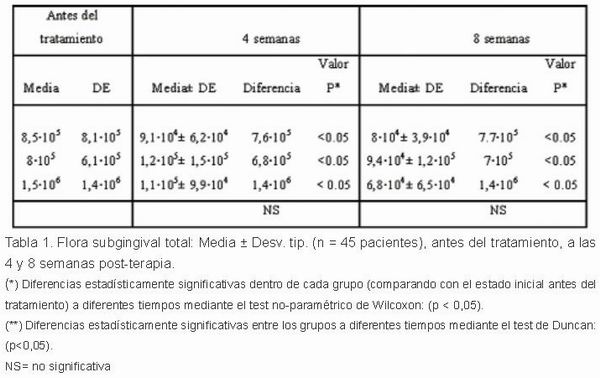 |
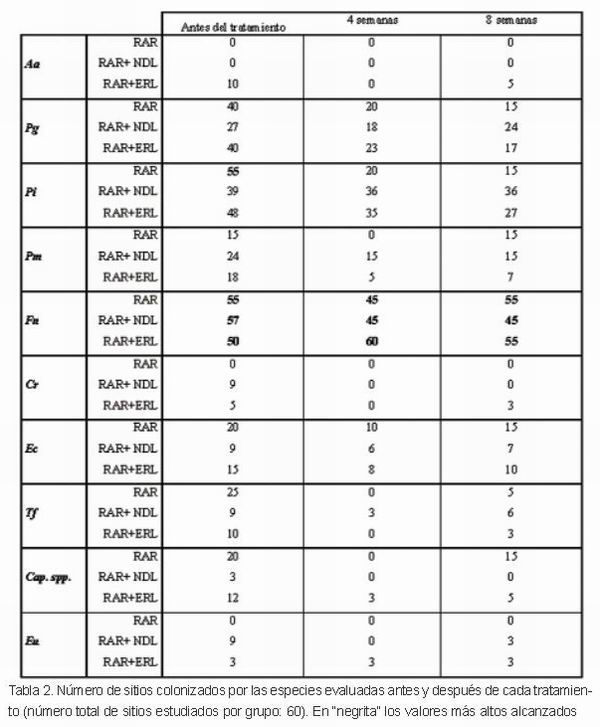 |
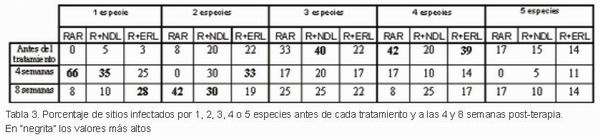 |
 |
3. Estudio antiinflamatorio
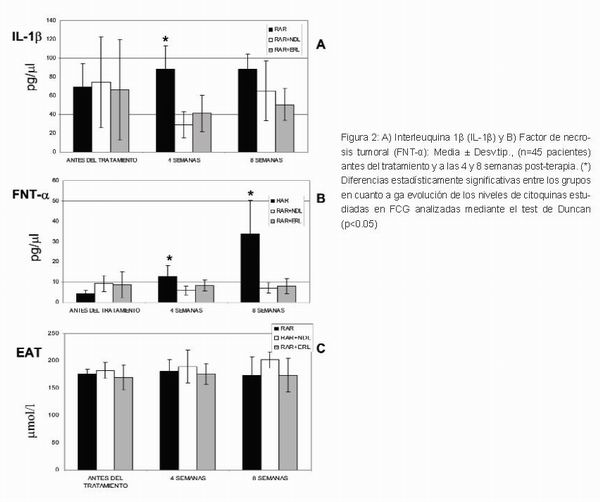
Se procedió a la evaluación de la concentración de IL-1ß y TNF-a en bolsa periodontal antes del tratamiento y a las 4 y 8 semanas después, cuyos resultados se muestran en las Figuras 2a y 2b respectivamente. En cuanto al estudio de la IL-1ß, el grupo control (tratamiento RAR) mostró un incremento de la concentración a las 4 semanas y un mantenimiento de dicha concentración a las 8 semanas (Figura 2a). También dentro del grupo control, observamos cómo los niveles de TNF-aα en FCG aumentan suavemente a las 4 semanas respecto al estado inicial de los pacientes, y como el incremento se hace más acusado durante las siguientes semanas, llegando a alcanzar valores bastante más altos que los iniciales 2 meses después del tratamiento (Figura 2b).
Por otra parte, el grupo tratado con RAR+NDL mostró una importante reducción de la concentración de IL-1ß a las 4 semanas del tratamiento, estableciéndose diferencias estadísticamente significativas entre este grupo y el grupo control en cuanto a la concentración de IL-1ß entre las 0 y 4 semanas (p < 0,00). El grupo tratado con RAR+ERL, también mostró un descenso de esta citoquina a las 4 semanas post-tratamiento, sin embargo esta disminución resulta ser algo menos marcada que en el grupo tratado con RAR+NDL. Aun así, no se hallaron diferencias estadísticamente significativas comparando el efecto adicional de ambos láser, y sí se encontraron diferencias estadísticamente significativas entre los grupos RAR+NDL y RAR+ERL frente al grupo tratado con RAR, en cuanto a la evolución de la IL-1ß antes del tratamiento y a las 4 semanas. Entre las 4 y 8 semanas siguientes al tratamiento, tanto en el grupo RAR+NDL como en el grupo RAR+ERL la concentración de IL-1ß se ve incrementada (Figura 2a). Este incremento es mayor en el grupo RAR+NDL que en el grupo RAR+ERL, aunque no estadísticamente significativo entre ambos tratamientos con láser. En cuanto a la evolución de la concentración de TNF-a, en el grupo RAR+NDL podemos observar cómo disminuye a las 4 semanas y se incrementa durante las 4 semanas finales, sin llegar a alcanzar los valores iniciales. En el grupo RAR+ERL, podemos observar un perfil similar a las 4 semanas, sin embargo a las 8 semanas todavía se observa una disminución de esta citoquina. El análisis estadístico muestra diferencias estadísticamente significativas en cuanto a la evolución de los niveles de TNF-a en bolsa periodontal en grupo RAR frente a los grupos tratados adicionalmente con láser (RAR+NDL y RAR+ERL) durante todo el tratamiento (p < 0,00). La Figura 2c muestra la evolución de la capacidad antioxidante en los grupos estudiados tras 4 y 8 semanas post-tratamiento. Mientras que en el grupo RAR y en el grupo RAR+ERL la capacidad antioxidante se mantiene casi constante (apenas aumentando a las 4 semanas y disminuyendo suavemente a las 8 semanas), la capacidad antioxidante en el grupo RAR+NDL se va incrementando durante todo el estudio, registrándose su valor máximo a las 8 semanas. Sin embargo, no se han encontrado diferencias estadísticamente significativas entre los tratamientos a lo largo de todo el estudio.
 |
Discusión
Los resultados del presente estudio muestran que el tratamiento periodontal no quirúrgico sólo o en combinación con la radiación láser de Nd:YAG o con la radiación láser de Er:YAG controlada por la señal de fluorescencia emitida por los tejidos dentales irradiados, fue bien tolerado y no se observaron complicaciones durante el periodo de estudio como abscesos o infecciones.
Los parámetros clínicos mejoraron significativamente tras las tres modalidades de tratamiento realizadas, aunque es evidente que el tratamiento complementario tanto con el láser de Nd:YAG como con el de Er:YAG, no es el que conduce a esta mejora, sino el tratamiento básico con RAR. Estos resultados concuerdan con los mostrados en el estudio realizado por Assaf y colaboradores. (2007), comparando “RAR con ultrasonidos” y “RAR con ultrasonidos y láser de diodo” donde no se observaron diferencias significativas entre los grupos en cuanto a IP, IG y PS, por tanto, concluye afirmando que ambos grupos de tratamiento respondieron de manera similar a la terapia (24). En otro estudio clínico reciente realizado por Tomasi y colaboradores (2006), donde se evaluaron los efectos de la terapia no quirúrgica en pacientes dentro de programas de mantenimiento, tratados bien con láser de Er:YAG o ultrasonidos, no mostró mejoría adicional con el tratamiento láser en cuanto a los parámetros clínicos evaluados (25). Jepsen y colaboradores (2000) (26), en un ensayo clínico controlado, trataron a 10 pacientes bien con RAR+ERL o bien con RAR, y observaron al igual que en el presente estudio, diferencias estadísticamente significativas intragrupos, y no estadísticamente significativas entre los dos grupos en ninguno de los parámetros clínicos investigados. Sin embargo, estos resultados son contradictorios con los expuestos por Qadri y colaboradores (2005), donde en el grupo tratado con láser de diodo de baja potencia, el IG y PS descienden más acusadamente que en el grupo control (17).
Los parámetros microbiológicos evaluados muestran que el uso de cualquiera de los tratamientos es eficaz, pero no causa la completa eliminación de bacterias. Las bacterias pueden residir en las irregularidades de la superficie radicular y en los túbulos dentinarios, así como en otros sitios de la cavidad oral, en particular en zonas extra-dentales, tales como la superficie dorsal de la lengua, mucosa bucal, paladar y amígdalas (27). Estas consideraciones deben tenerse en cuenta a la hora de interpretar los resultados antimicrobianos.
Los resultados obtenidos en el presente estudio muestran que la reducción microbiana tras los tratamientos con RAR+NDL y RAR+ERL es similar a la obtenida tras el RAR. Además, el cambio más acentuado en la distribución de bacterias se produjo en el primer periodo de tiempo (es decir, a las 4 semanas post-tratamiento) con las tres modalidades realizadas. El número de especies patógenas albergadas en cada localización estudiada cambió de 4 especies antes del tratamiento a 1 después de 4 semanas, y a 2-3 especies después de 8 semanas posterapia. Además, los resultados demuestran que la recolonización con una especie se mantiene durante más tiempo en el grupo RAR+ERL que en el grupo RAR+NDL, y en este último durante más tiempo que en el grupo RAR. El grupo tratado complementariamente con la radiación láser de Er:YAG controlada por fluorescencia, al contar con este sistema añadido para la detección selectiva del cálculo subgingival, permite prácticamente la entera eliminación del cálculo sin producir efectos mecánicos adicionales como es una eliminación excesiva de cemento y extremada irregularidad en la superficie radicular y por ello dificultando el asentamiento bacteriano.
Se han observado asociaciones específicas microbianas no sólo entre diferentes bacterias sino entre complejos bacterianos: por ejemplo, es extremadamente poco común encontrar especies del complejo rojo (Pg, Td, Tf) en ausencia de miembros del complejo naranja (por ejemplo. Pi) (28). Obviamente, es esta la razón por la que en este estudio la mayoría de las localizaciones pre-operatorias estaban infectadas por 4 o 3 especies. Se ha visto que el nuevo crecimiento y recolonización de las bolsas, ocurre 3-7 días post tratamiento, pero con una clara alteración en la microflora subgingival (29). Los colonizadores primarios de la placa dental con frecuencia ocupan las bolsas periodontales más rápido, inhibiendo así el establecimiento de otras especies patógenas (30). Esto puede explicar porqué en este estudio hay más localizaciones infectadas por una o dos especie después de la terapia, mientras que la mayoría de las localizaciones albergan 3 o 4 especies antes del tratamiento.
El Fn fue el periodontopatógeno más frecuente entre las especies evaluadas tras la realización de los tres procedimiento estudiados, actuando como bacteria puente en el proceso de recolonización, favoreciendo así la formación de biofilm gracias a la co-agregación de todas las bacterias bucales (31). Además, aunque en la mayoría de los casos se produjo una eliminación significativa desde el punto de vista estadístico de Pg, Pi, Pm, Fn y Tf, la radiación láser controlada por fluorescencia de Er:YAG ha demostrado ser más eficaz que RAR y sobre todo frente al tratamiento con RAR+NDL en la reducción de unidades formadoras de colonia de Pg. Otras investigaciones (32, 33) mostraron ya esta misma selectividad de Er:YAG sobre Pg. Sin embargo, se necesitan más estudios para interpretar y explicar la reducción significativamente mayor de Pg, encontrada en el grupo RAR+ERL.
Aunque la mayoría de los estudios clínicos publicados muestran la disminución de la concentración de citoquinas en surco periodontal después del tratamiento periodontal no quirúrgico (RAR), especialmente en cuanto a la reducción de la concentración de IL-1ß (34-36), nuestros resultados se aproximan más a los obtenidos por Yoshinari y colaboradores (2004) (37), en un estudio donde se investigó la relación entre los cambios clínicos e IL-1ß después de la terapia periodontal en pacientes con periodontitis crónica, observándose clara mejoría de los índices clínicos y ligero aumento de la concentración de IL-1ß.
A partir de estos resultados podemos constatar el poder antiinflamatorio de la terapia con los láseres de Nd:YAG y de Er:YAG, que conduce a una inhibición en la producción de citoquinas, resultados que muestran concordancia con investigaciones previas realizadas con instrumentación láser (17, 38, 39). Más recientemente, Safavi y colaboradores (2008) cuantificando los niveles de TNF-a después de la aplicación de un láser de He:Ne, concluye en que la aplicación del láser en la enfermedad periodontal disminuye la inflamación y acelera la curación de la enfermedad mediante el cambio en la expresión de los genes responsables de la producción de las citoquinas inflamatorias (40). Lopes y colaboradores (2008) valoraron el cambio en los niveles de Il-1ß en FCG tras la aplicación de RAR+ERL y observaron, al igual que en nuestro estudio, cómo esta citoquina disminuía a los 12 días y a los 30 días post-tratamiento, aunque no de manera estadísticamente significativa respecto al procedimiento con RAR (41). Nuestros resultados demuestran cómo los dos tipos de radiación láser promueven un descenso de la inflamación, descendiendo los niveles de los mediadores inflamatorios estudiados, de forma más aguda con la radiación de Nd:YAG frente a una forma más sostenida con la de Er:YAG. La capacidad de este nuevo prototipo láser con radiación controlada por fluorescencia para detectar y eliminar con precisión el cálculo subgingival, especialmente cuando el cálculo se encuentra en la parte más profunda de la bolsa periodontal o en una superficie radicular con contornos anatómicos complejos, retrasa la nueva acumulación de placa, lo que permite la disminución durante un periodo mayor de tiempo de los niveles de citoquinas en FCG.
Chapple y colaboradores (2007) estudiando la capacidad antioxidante del FCG observaron cómo dicha capacidad se ve comprometida en la periodontitis. Este compromiso parece deberse más a una consecuencia de la enfermedad inflamatoria que a factores que predisponen a ello (42). Varios estudios indican que las especies reactivas del oxígeno (ERO) juegan un papel importante en la reacciones fisiológicas e inmunoinflamatorias. En el cuerpo humano hay un mecanismo antioxidante para mantener el equilibrio redox (43). La ruptura de este equilibrio puede conducir a un daño que se ve incrementado por las ERO. De hecho, muchas enfermedades se han correlacionado con la pérdida de este balance redox, o estrés oxidativo. Brock y colaboradores (2002) y Tsai y colaboradores (2005) mostraron que la defensa antioxidante es reducida, y el tratamiento no quirúrgico con mejoras en los parámetros clínicos puede aumentar la defensa antioxidante en pacientes con periodontitis crónica (44, 45). En este estudio, sí que hemos podido constatar que la capacidad antioxidante total del FCG se ve influida por la reducción de la inflamación periodontal tras el éxito de la terapia no quirúrgica realizada con RAR+NDL.
Por otra parte, es un hecho conocido que la no eliminación del biofilm subgingival inicia una reacción inflamatoria periodontal y que el establecimiento de este proceso infeccioso provoca la disminución de la tensión de oxígeno molecular y consecuentemente una disminución del potencial redox. Además, el crecimiento y supervivencia de diversas bacterias anaerobias en un ecosistema depende, entre otros factores, de un bajo potencial redox, así por ejemplo, encontramos Eh ~ -300 mV en las bolsas periodontales, permitiendo la supervivencia de bacterias anaerobias y Eh ~ +70 mV en surco gingival sano. Aumentando el potencial redox se crearía un ambiente incompatible con el crecimiento de los periodontopatógenos anaerobios, causando inhibición de su crecimiento (46, 47). Por ello, para controlar la reacción inflamatoria, además de la eliminación de la placa subgingival, un posible tratamiento adicional sería aquel capaz de alterar el potencial redox (Eh) de la región subgingival, originando un incremento del mismo (48). En ese aspecto, sólo el tratamiento complementario con la radiación de Nd:YAG sería el único candidato a tener en cuenta, según podemos deducir de nuestros resultados.
Conclusión
La terapia complementaria con Nd:YAG ejerce un efecto antiinflamatorio adicional, disminuyendo los niveles de IL-1ß y TNF-a en FCG e incrementa el estado antioxidante total del FCG.
La terapia complementaria con Er:YAG también ejerce un efecto antiinflamatorio adicional, menos marcado pero más sostenido que en el caso del tratamiento coadyuvante con el láser de Nd:YAG, y además ralentiza ligeramente el proceso de recolonización.
Correspondencia
Dr. JA García Núñez
Dpto. Estomatología III
Facultad de Odontología
Universidad Complutense de Madrid
c/ Plaza Ramón y Cajal, s/n
28040 Madrid, España
Teléfono: +34 91 3942018
Fax: +34 91 3941973
garcinu@odon.ucm.es
Bibliografía
1. Armitage GC. Development of a classification system for periodontal diseases and conditions. Ann. Periodontol. 1999: 4: 1-7.
2. Potera C. Forging a link between biofilms and disease. Science 1999: 19: 1837-1839.
3. Socransky SS, Haffajee AD. Dental biofilms: difficult therapeutic targets. Periodontol. 2000. 2002: 28: 12-55.
4. Waterman W.H., Sha'afi R.I. A mitogen-activated protein kinase independent pathway involved in the phosphorylation and activation of cytosolic phospholipase A2 in human neutrophils stimulated with tumor necrosis factor-alpha. Biochem. Biophys. Res. Commun. 1995: 209(1): 271-278.
5. Sbordone L, Ramaglia L, Gulletta E, Iacono V. Recolonization of the subgingival microflora after scaling and root planing in human periodontitis. J. Periodontol. 1990: 61(9): 579-584.
6. Stambaugh RV, Dragoo M, Smith DM, Carasali L. The limits of subgingival scaling. Int. J. Periodon. Restor. Dent. 1981:1(5): 30-41.
7. Breininger DR, O'Leary TJ, Blumenshine RV. Comparative effectiveness of ultrasonic and hand scaling for the removal of subgingival plaque and calculus. J. Periodontol. 1987: 58(1): 9-18.
8. Berkstein S, Reiff RL, McKinney JF, Killoy WJ. Supragingival root surface removal during maintenance procedures utilizing an air-powder abrasive system or hand scaling. An in vitro study. J. Periodontol. 1987: 58(5): 327-330.
9. Gankerseer EJ, Walmsley AD. Preliminary investigation into the performance of a sonic scaler. J. Periodontol. 1987: 58(11): 780-784.
10. Lasho DJ, O'Leary TJ, Kafrawy AH. A scanning electron microscope study of the effects of various agents on instrumented periodontally involved root surfaces. J. Periodontol.1983: 54(4): 210-220.
11. Thomas D, Rapley J, Cobb C, Spencer P, Killoy W. Effects of the Nd: YAG laser and combined treatments on in vitro fibroblast attachment to root surfaces. J. Clin. Periodontol. 1994: 21(1): 38-44.
12. Coffelt DW, Cobb CM, MacNeill S, Rapley JW, Killoy WJ. Determination of energy density threshold for laser ablation of bacteria. An in vitro study. J. Clin. Periodontol. 1997: 24(1): 1-7.
13. Gutknecht N, Moritz A, Conrads G, Sievert T, Lampert F. Bactericidal effect of the Nd: YAG laser in in vitro root canals. J. Clin. Laser Med. Surg. 1996: 14(2): 77-80.
14. Gutknecht N, Van Gogswaardt D, Conrads G, Apel C, Schubert C, Lampert F. Diode laser radiation and its bactericidal effect in root canal wall dentin. J. Clin. Laser Med. Surg. 2000: 18(2): 57-60.
15. Schoop U, Moritz A, Kluger W, Patruta S, Goharkhay K., Sperr W, Wernisch J, Gattringer R, Mrass P, Georgopoulos A. The Er: YAG laser in endodontics: results of an in vitro study. Lasers Surg. Med. 2002: 30(5): 360-364.
16. Ishikawa I, Aoki A, Takasaki AA. Potential applications of Erbium: YAG laser in periodontics. J. Periodontal. Res. 2004: 39(4): 275-285. Review.
17. Qadri T, Miranda L, Tunér J, Gustafsson A. The short-term effects of low-level lasers as adjunct therapy in the treatment of periodontal inflammation. J. Clin. Periodontol. 2005: 32: 714-719.
18. Perry DA, Goodis HE, White JM. In vitro study of the effects of Nd: YAG laser probe parameters on bovine oral soft tissue excision. Lasers Surg. Med. 1997: 20: 39-46.
19. White JM, Goodis HE, Yessik M.J, Myers TD. Histologic effects of a high-repetition pulsed Nd: YAG laser on intraoral soft tissue. Proc. SPIE 1995: 2394: 143-153.
20. White J.M, Gekelman D, Shin K, Park J, Swenson T, Rouse B., Tran K, Bullard S, Scott-Beckles B, Oto MJSB, Yamamoto A. Laser interaction with dental soft tissues: What do we know from our years of applied scientific research? Proc. SPIE 2002: 4610: 39-48.
21. Chapple ILC, Landini G, Griffiths GS, Patel NC. Calibration of the Periotron 8000 and 6000 by polinomial regression. J. Periodont. Res. 1999: 34: 79-86.
22. Folwaczny M, George G, Thiele L, Mehl A, Hickel R. Root surface roughness following er:YAG laser irradiation at different radiation energies and working tip angulations. J. Clin. Periodontol. 2002: 29(7): 598-603.
23. Alsina M, Olle E, Frias J. Improved, low-cost selective culture medium for Actinobacillus actinomycetemcomitans. J. Clin. Microbiol. 2001: 39(2):509-13.
24. Assaf M, Yilmaz S, Kuru B, Ipai SD, Noyun V, Kadir T. Effect of diode laser on bacteremia associated with dental ultrasonic scaling: a microbiological study. Photomed. Laser Surg. 2007: 25(4): 250-256.
25. Tomasi C, Sahander K, Dahlen G, Wennström JL. Short-Term clinical and microbiologic effects of pocket debridement with Er: YAG laser during periodontal maintenance. J. Periodontol. 2006: 77: 111-118.
26. Jepsen S, Rühling A, König J, Dietzel K, Keller U, Albers H.K. Treatment of periodontitis with a novel Er:YAG laser system. J. Dental Res. 2000: 79 (Spec Iss): Abstract no. 2281.
27. Quirynen M, De Soete M, Dierickx K, van Steenberghe D. The intra-oral translocation of periodontopathogens jeopardises the outcome of periodontal therapy. A review of the literature. J Clin. Periodontol. 2001: 28: 499-507.
28. Socransky SS, Haffajee AD, Cugini MA, Smit C & Kent RLJr. Microbial complexes in subgingival plaque. J. Clin. Periodontol. 1998: 25: 134-144.
29. Harper DS, Robinson PJ. Correlation of histometric, microbial, and clinical indicators of periodontal disease status before and after root planing. J. Clin. Periodontol. 1987: 14(4): 190-6.
30. Cugini MA, Haffajee AD, Smith C, Kent RLJr, Sokransky SS. The effect of scaling and root planning on the clinical and microbiological parameters of periodontal diseases: 12-month results. J. Clin. Periodontol. 2000: 27: 30-36.
31. Kolenbrander PE. Oralmicrobial communities: biofilms, interactions, and genetic systems. Annu Rev. Microbiol. 2000: 54: 413-27.
32. Ando Y, Aoki A, Watanabe H, Ishikawa I. Bactericidal effect of erbium YAG laser on periodontopathic bacteria. Lasers Surg. Med. 1996: 19(2): 190-200.
33. Derdilopoulou FV, Nonhoff J, Neumann K, Kielbassa AM. Microbiological findings after periodontal therapy using curettes, Er:YAG laser, sonic, and ultrasonic scalers. J. Clin. Periodontol. 2007: 34: 588-598.
34. Tsai IS, Tsai CC, Ho YP, Ho KY, Wu YM, Hung, CC. Interleukin-12 and interleukin-16 in periodontal disease. Cytokine 2005: 31: 34-40.
35. Gamanol J, Acevedo A, Bascones A, Jorge O, Silva A. Levels of Interleukin 1?, -8, -10 and RANTES in gingival crevicula fluid and cell populations in adult periodontitis patients and the effect of periodontal treatment. J. Periodontol. 2000: 71: 1535-1545.
36. Giannopoulou C, Cappuyns I, Mombelli, A. Effect of smoking on gingival crevicular fluid cytokine profile during experimental gingivitis. J. Clin. Periodontol. 2003: 30: 996-1002.
37. Yoshinari N, Kawase H, Mitani A, Ito M, Sugiishi S, Matsuoka M. Shirozu N, Ishihara Y, Bito B, Hiraga M, Arakawa K, Noguchi T. Effects of scaling and root planing on the amounts of interleukin-1 and interleukin-1 receptor antagonist and the mRNA expression of interleukin-1beta in gingival crevicular fluid and gingival tissues. J. Periodontal Res. 2004: 39(3):158-67.
38. Shimizu N, Yamaguchi M, Goseki T, Shibata Y, Takiguchi A, Iwasawa T, Abiko Y. Inhibition of prostaglandin E2 and interleukin 1? production by low-power laser irradiation in stretched human periodontal ligament cells. J. Dental Res. 1995: 74: 1382-1388.
39. Funk JO, Kruse A, Kirchner H. Cytokine production after helium-neon laser irradiation in cultures of human peripheral blood mononuclear cells. J. Photochem. Photobiol. B. 1992: 16 (3-4): 347-355.
40. Safavi SM, Kazemi B, Esmaeili M, Fallah A. Effects of low-level He-Ne laser irradiation on the gene expression of IL-1?, TNF-?, IFN, TGF, bFGF, and PDGF in rat´s gingival. Lasers Med. Sci. 2008: 23(3): 331-335.
41. Lopes BM, Marcantonio RA, Thompson GM, Neves LH, Theodoro LH. Short-term clinical and immunologic effects of scaling and root planning with Er:YAG laser in chronic periodontitis. J. Periodontol. 2008: 79 (7): 1158-1167.
42. Chapple ILC, Brock GR, Milward MR et al. Compromised GCF total antioxidant capacity in periodontitis: cause or effect? J. Clin. Periodontol. 2007: 34:103-110.
43. Teng, YT. The role of oxygen radicals in human disease with particular acquired immunity and periodontal disease progression. Crit. Rev. Oral Diseases 2003: 6: 138-151.
44. Brock GR, Matthews J, Butterwoth C, Chapple ILC. Plasma and crevicular fluid antioxidant defense in periodontitis and health. J. Dent. Res. 2002: 81 (Special Issue A): Abstract 1524.
45. Tsai CC, Chen HS, Chen SL, Ho YP, Ho YM, Hung CC. Lipid peroxidation: a possible role in the induction and progression of chronic periodontitis. J. Periodontal. Res. 2005: 40: 378-384.
46. Gibson MT, Mangat D, Gagliano G, Wilson M, Fletcher J, Bulman J, Newman HN. Evaluation of the efficacy of a redox agent in the treatment of chronic periodontitis. J. Clin. Periodontol. 1994: 21(10): 690-700.
47. Wilson M, Gibson M, Strahan D, Harvey W. A preliminary evaluation of the use of a redox agent in the treatment of chronic periodontitis. J. Periodontal Res. 1992: 27(5): 522-527.
48. Ower PC., Ciantar M, Newman HN, Wilson M, Bulman JS. The effects on chronic periodontitis of a subgingivally-placed redox agent in a slow release device. J. Clin. Periodontol. 1995: 22(6), 494-500.




¡Excelente! A pesar de haber muchas palabras lo he analizado de un tirón y
he bajado a la zona de comentarios directamente para agradecerte esta entrada, impresionante
! Felicidades