Resumen
Son muchas las enfermedades infecciosas que se pueden transmitir en la clínica dental, siendo una de las principales vías de transmisión la utilización de material contaminado.
La bibliografía más reciente, y el aumento de publicidad sobre el potencial de transmisión de agentes infecciosos en el gabinete odontológico, han hecho centrar la atención en los instrumentos dentales como posibles agentes de transmisión de patógenos.
En el presente estudio de revisión, se pretende recoger cuáles son las principales causas de una mala esterilización y, por consiguiente, de la transmisión de enfermedades infecciosas.
Palabras clave: Esterilización, efectividad, seguridad, hepatitis, transmisión de enfermedades, infecciones cruzadas, indicadores biológicos.
Introducción
Son muchas las enfermedades infecciosas que se pueden transmitir en la clínica dental, siendo una de las principales vías de transmisión la utilización de material contaminado. Algunas de las enfermedades que se pueden transmitir por esta vía son de especial importancia por su elevada morbilidad y mortalidad. Entre ellas, podemos destacar la hepatitis B, la hepatitis C y el VIH (1-2).
El riesgo de transmisión en una exposición percutánea con sangre contaminada es mayor en hepatitis B (6-30%) que en hepatitis C (1-7%) y VIH (0,3%) (17). En la actualidad se muestra una mayor preocupación por el contagio con el virus de la hepatitis C (VHC), puesto que pesar de que el riesgo de transmisión del virus de la hepatitis B es mayor, sólo un 10% de los infectados pasan a ser portadores crónicos, además, gracias a la existencia de una vacuna efectiva este elevado riesgo se reduce, mientras que el riesgo de transmisión del VIH es muy bajo, sobre todo en la clínica dental (2).
El principal problema del virus hepatitis C (VHC) es que un 80% de los infectados resultan portadores crónicos y, en gran medida, contribuye a la aparición de cirrosis y carcinoma hepatocelular. Actualmente hay 130-170 millones de portadores crónicos, lo que supone que un 2,2-3% de la población mundial tiene capacidad para transmitir la enfermedad (3).
La bibliografía más reciente, y el aumento de publicidad sobre el potencial de transmisión de agentes infecciosos en el dentista, han hecho centrar la atención en los instrumentos dentales como posibles agentes de transmisión de patógenos (4).
En el presente estudio, que ha abarcado la revisión de la bibliografía disponible en los últimos 10 años, se pretende recoger cuáles son las principales causas de una mala esterilización y, por consiguiente, de la transmisión de enfermedades infecciosas.
La esterilización
La esterilización es todo proceso físico o químico que destruye todas las formas de vida microbiana, incluyendo las formas de resistencia (esporas) y los virus. Es el nivel más alto posible de destrucción microbiana y, por tanto, el método que proporciona el mayor nivel de protección al paciente (5-7).
Los métodos de esterilización pueden ser físicos o químicos.
Entre los métodos de esterilización físicos podemos utilizar la esterilización con vapor de agua o con calor seco, mientras que la esterilización química podemos realizarla mediante la inmersión del instrumental en líquidos químicos, siendo el principal el glutaraldehído al 2%, o por medio de gas de óxido de etileno o gas-plasma de peróxido de hidrógeno (7-8).
Métodos físicos de esterilización
a) Esterilización con vapor de agua
 |
| Tabla 1. Comparativa de la efectividad de los distintos métodos de esterilización, por autores. |
Emplea calor húmedo que tiene un efecto mayor y más rápido sobre los microorganismos, al ser el agua un buen conductor, con lo que el calor penetra mejor y se distribuye más uniformemente. Al aplicarlo como vapor de agua destruye los microorganismos por coagulación y desnaturalización de las proteínas y las enzimas.
Este sistema es el más ampliamente utilizado y el más fiable, puesto que no es tóxico, es barato, un microbicida de acción rápida, esporicida y calienta y penetra rápidamente los tejidos. Así, este sistema se emplea para la gran mayoría de los materiales, excepto en aquellos casos que puedan ser dañados por la humedad o el calor, ya que produce corrosión y combustión sobre algunos materiales como los lubricantes asociados a las piezas de mano.
El procedimiento consiste en la generación de vapor de agua en una cámara de agua y el consiguiente desplazamiento del aire al exterior. En dicho proceso deben tenerse en cuenta cuatro parámetros fundamentales: vapor, presión, temperatura y tiempo. El principio sobre el que se sostiene este sistema de esterilización es el de exponer cada elemento con vapor a la temperatura y presión requerida durante el tiempo necesario para la destrucción de los organismos biológicos que contenga dicho material. Previamente se realiza la extracción del aire, ya que su presencia es un impedimento para el proceso de esterilización. Los periodos de exposición mínimos para la esterilización de productos sanitarios envueltos son 30 minutos a 121 ºC (250 ºF) en un esterilizador de desplazamiento por gravedad, o 4 minutos a 132 ºC (270 ºF) en un esterilizador de vacío previo. Esta diferencia en cuanto a la duración del proceso, estriba en que en el caso de la esterilización por gravedad no se consigue eliminar todo el aire. Además, existen ciclos rápidos de esterilización o flash en los que el material sin envolver se mantiene a 134ºC durante 3 minutos, sin embargo, no se recomienda su uso rutinario debido a la falta de indicadores biológicos adecuados para comprobar su efectividad, a la ausencia de protección tras la esterilización (por la ausencia de embalaje) y a que los parámetros del ciclo de esterilización son mínimos (5, 8-10).
b) Esterilización con calor seco
El fundamento de este método estriba en el calentamiento del aire y la transferencia de la energía calórica al instrumental que se pretende esterilizar, lográndose la muerte de los microorganismos por coagulación o deshidratación de las proteínas, con la consabida pérdida de las funciones vitales (9).
El calor seco, al tener menor capacidad de penetración y de transferencia del calor que el calor húmedo, requiere temperaturas más elevadas y un periodo más prolongado de calentamiento y mantenimiento para conseguir la esterilización. La principal ventaja de este tipo de esterilización es que el instrumental de acero no se corroe con el carbono al contrario de lo que ocurre con la esterilización con vapor.
Los esterilizadores por calor seco pueden ser de dos tipos: de aire estático o de circulación forzada del aire. En los primeros el aire caliente generado por una resistencia va subiendo por convección natural al interior de la cámara. La esterilización ocurre después de 2 horas a 160ºC o 1 hora a 170ºC. El tiempo de calentamiento (hasta que se alcanzan los 160ºC o 170ºC) varía de acuerdo con la calidad y cantidad de la carga (9).
En los de aire forzado el aire calentado es impulsado y circula a gran velocidad por la cámara, esto permite la rápida transferencia del calor al instrumental, de modo que se reduce el tiempo necesario para conseguir la esterilización. Cuando la temperatura alcanza los 190ºC comienza el tiempo de mantenimiento, que oscila entre 12 minutos para el instrumental envuelto y 6 minutos para los elementos que no están empaquetados.
Los esterilizadores de perlas aplican al instrumental calor seco. Se trata de un calentador eléctrico que hace que unas perlas alcancen temperaturas cercanas a los 220ºC. Este método presenta los inconvenientes de que la temperatura no es homogénea y de que no es posible realizar un control biológico del proceso de esterilización. Para que sea eficaz el tiempo de esterilización tiene que ser mayor de 60 segundos (11).
Métodos químicos de esterilización
a) Esterilización con óxido de etileno
 |
| Tabla 2. Eventos adversos publicados relacionados con la transmisión de enfermedades infecciosas por defectos en la esterilización en el ámbito odontológico. |
Se utiliza para la esterilización de materiales termosensibles (gomas, plásticos, etc.), puesto que la temperatura alcanzada no supera los 30-60ºC. La duración del ciclo es de 90 minutos, sin embargo, posteriormente, requiere un periodo de aireación de 12 horas para eliminar los residuos del gas, ya que es inflamable, tóxico y reactivo, siendo este excesivo tiempo el principal inconveniente de este método (5-6).
b) Esterilización con gas-plasma de peróxido de hidrógeno
Consiste en la difusión del peróxido de hidrógeno en fase de plasma (entre líquido y gas). La temperatura alcanzada al igual que en el caso anterior es baja y no es necesaria la posterior aireación del material porque el peróxido de hidrógeno, al finalizar el proceso, se convierte en agua y oxígeno, no quedando ningún residuo tóxico. La completa esterilización se consigue en 55 minutos. Sin embargo, tiene una serie de inconvenientes: no se pueden esterilizar materiales que contengan celulosa, ni líquidos (el instrumental debe estar perfectamente seco antes de introducirlo en la cámara). Además es el método más caro de los citados (5-6).
c) Esterilización con glutaraldehído al 2%
Debe utilizarse a temperaturas de 25º C (77ºF) manteniendo el instrumental sumergido durante 10 horas. Este producto, al ser tóxico, requiere posteriormente el lavado del instrumental con agua hervida o estéril (6,12).
Instrumental y esterilización
Casi tan importante como la prevención del contagio por contacto directo, es la prevención del contagio por contacto indirecto.
En este sentido es fundamental hacer hincapié en que se puede prevenir por un adecuado procesamiento del material.
En primer lugar, hemos de tener en cuenta el grado de desinfección que deseamos que presente el material: estéril, desinfectado o limpio. Depende del tipo de instrumento:
– Críticos: están destinados a ser introducidos en el torrente sanguíneo o en zonas habitualmente estériles, como tejidos blandos y hueso, y deben ser esterilizados después de cada uso. Entre estos se incluyen fórceps, cinceles, limas para hueso, elevadores, etc.
– Semicríticos: van a entrar en contacto con mucosas intactas, pero no penetran en ellas ni en hueso. Deben esterilizarse después de cada uso. Incluyen espejo dental, condensadores de amalgama, etc.
– No críticos: van a entrar en contacto con piel intacta. Son instrumentos tales como componentes externos de cabezas radiográficas. Debido a que estas superficies tienen bajo riesgo de transmitir infecciones los instrumentos podrán ser tratados entre pacientes con desinfectantes de nivel medio o bajo, o detergentes y lavado con agua dependiendo de la naturaleza de la superficie y del grado de contaminación (5,13).
Al utilizar instrumental crítico existen dos opciones: utilizar material estéril de un solo uso o material reusable sometido a esterilización entre un paciente y otro.
Para que la esterilización sea eficaz es imprescindible que el material sea previamente lavado y empaquetado (para que tras la esterilización no se contamine).
Efectividad de los métodos de esterilización
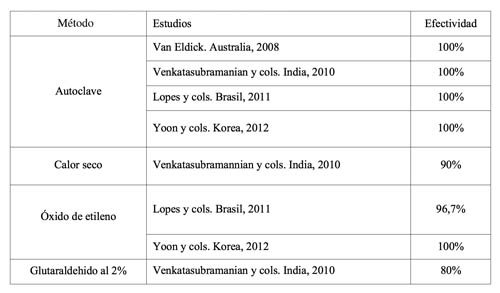
En la tabla 1 se hace una comparativa de la efectividad de los distintos métodos según la bibliografía disponible (14-17).
A modo de resumen, podemos señalar que la esterilización por vapor de agua es el único método que consigue una efectividad del 100% en cualquiera de los casos. El segundo método más efectivo es la esterilización por óxido de etileno (próxima al 100%), seguida de la esterilización por calor seco y mediante inmersión es glutaraldehído, siendo estos métodos menos seguros.
Control de los procesos de esterilización
Los procesos de esterilización deben ser sometidos de manera rutinaria a controles que demuestren su eficacia. Estos controles pueden ser de tres tipos: físicos, químicos o biológicos. Se deben utilizar las tres formas de control.
Controles físicos
 |
| Tabla 3. Porcentaje de fallo entre los métodos de esterilización, por autores. |
Los controles físicos consisten en un registro del ciclo que documenta que se ha alcanzado la presión, temperatura y tiempo adecuados, siendo elementos tales como: termómetros, manómetros, sensores de carga, entre otros. Si se aprecia alguna anomalía en estos parámetros la carga no puede ser considerada estéril, por lo que a pesar de ser de utilidad no son un medio eficaz de comprobar la esterilización. Deben realizarse todos los días y en todos los ciclos, al inicio, en su transcurso y al finalizar el ciclo (7,18).
Controles químicos
Los controles químicos se realizan comúnmente mediante productos comerciales, consistentes en sustancias químicas que cambian de color si se cumple uno o varios elementos clave (temperatura, humedad, presión, concentración del agente esterilizante) en el proceso de esterilización. Al igual que los anteriores no garantizan que el equipo esté realizando una esterilización efectiva, aunque sí garantizan el funcionamiento del mismo, ya que reaccionan al alcanzarse dichos parámetros. Son diferentes de acuerdo al proceso de esterilización utilizado (calor seco, húmedo, gas).
– Controles químicos externos: se colocan en el exterior del paquete o de los elementos a esterilizar y sirven para comprobar si el material fue sometido a un ciclo de esterilización o no.
– Controles químicos internos: Se colocan en el interior del paquete. En ciclos de calor seco estos indicadores cambian de color a una determinada temperatura y tras cierto tiempo, mientras que para ciclos de calor húmedo se emplean indicadores de temperatura y vapor.
Ambos tipos deben ser colocados en cada paquete.
También existen controles químicos de funcionamiento para autoclaves como el Bowie y Dick, que consiste en ubicar una lámina de control en el centro de un paquete textil estándar, para detectar la penetración del vapor en el interior del paquete. Se realiza siempre en las mismas condiciones: primer ciclo del día, cámara vacía, el paquete es situado en la zona más fría (anteroinferior, sobre la llave de purgado), en horizontal, a 134ºC durante 210 segundos. El indicador debe cambiar de manera uniforme y en toda su longitud (7,18).
Controles biológicos
Los controles biológicos son los únicos universalmente aceptados y sirven para verificar la eficacia de la esterilización. Consisten en preparaciones estandarizadas de esporas de microorganismos muy resistentes, que son procesadas en el esterilizador para comprobar si se han destruido o no y, por tanto, si se ha llevado a cabo o no el proceso de esterilización. Utilizan dos tipos de esporas:
Bacillus stearotermophilus (para los procesos de esterilización con vapor de agua o con vapores químicos) y Bacillus subtilis (para los procesos con óxido de etileno o con calor seco), que se comercializan sobre tiras de papel o discos. Tras el proceso de esterilización se incuban durante 24-48 horas y, posteriormente, en el caso de que haya esporas vivas éstas volverán a su forma vegetativa, y se reproducirán teniendo lugar un crecimiento bacteriano que será detectable por la aparición de turbidez o por la modificación de color en el medio de cultivo, lo que pondrá de manifiesto un fallo en la esterilización.
También están disponibles en el mercado indicadores biológicos de lectura rápida, en forma de ampollas que contienen un medio de cultivo inoculado con las mismas esporas, el cual además contiene un substrato no fluorescente que por la acción de la enzima del
Bacillus stearotermophilus se transforma, al cabo de 3 horas de incubación, en un producto fluorescente (5,7,18).
En un estudio realizado por Villalobos (2001) se demostró que los resultados obtenidos con ambos tipos de indicadores biológicos eran idénticos, con una confiabilidad y eficiencia del 100% (19).
Según la bibliografía disponible, en México la NOM recomienda, para la prevención de enfermedades bucodentales, que se evalúen los equipos con IB una vez al mes, mientras que en EE.UU. la ADA, OSAP y CDC recomiendan aplicarlos una vez a la semana. Debe asimismo llevarse un registro del resultado por cada equipo analizado.
Eventos adversos en esterilización en la práctica odontológica
El muestreo con IBs ha permitido demostrar que hasta el método más seguro de esterilización puede fallar.
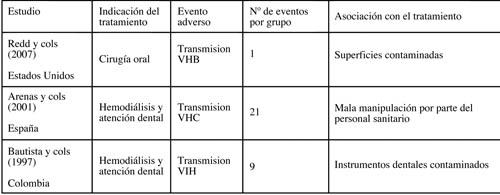
En la tabla 2 se consignan los eventos adversos publicados relacionados con la transmisión de enfermedades infecciosas por defectos en la esterilización en el ámbito odontológico (4).
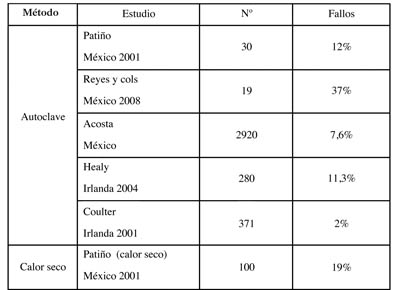
En la tabla 3 se especifica el porcentaje encontrado de fallo en los diversos estudios, siendo destacable por su habitual empleo del autoclave que oscila entre un 2 y un 37%, según los datos consultados (10,12, 20-22).
A pesar de estos datos la aplicación de indicadores biológicos es escasa y, a menudo, se confunde con indicadores de calentamiento (cintas testigo), poniéndose en peligro la seguridad del paciente al no identificar los fallos en el proceso de esterilización (20).
En 2001, Patiño evaluó el porcentaje de dentistas que empleaban indicadores: un 73% no utilizaba ningún tipo de indicador, un 10,7% empleaba indicadores químicos y sólo un 16,2% usaba indicadores biológicos. Es de destacar que según este estudio un 57,6% no conocen los indicadores biológicos (20).
Conclusiones
A pesar de la elevada eficacia de los principales métodos de esterilización, siendo del 100% la del autoclave, estos métodos en ocasiones fallan, haciendo que el instrumental no esté estéril.
Actualmente debido al poco uso de los indicadores biológicos, no se detectan de forma adecuada estos errores en el proceso de esterilización, convirtiéndose dicho instrumental en portador de enfermedades.
BIBLIOGRAFÍA
1. Araujo M, Andreana S. Risk and prevention of transmission of infectious diseases in dentistry. Quintessence Int 2002; 33: 376-82.
2. Thomas MV, Jarboe G, Frazer RQ. Regulatory Compliance in the Dental Office. Dent Clin N Am 2008; 52: 629-639.
3. Lavanchy D. Chronic viral hepatitis as a public health issue in the world. Rev Lat Am Enfermagem 2008; 22: 991-1008.
4. Kohn WG, Collins AS, Cleveland JF, Harte JA, Eklund KJ, Malvitz DM. Guideliness for Infection Control in Dental Health: Care Settings. MMWR Recomm Rep 2003; 52 (RR-17):1-61.
5. Conde M. Esterilización en Odontología. www.dentisnet.com
6. Silvestre C, Fagoaga L, Garciandía MJ, Lanzeta I, Mateo MC, Zapata MC. Esterilización. An Sist Sanit Navar 2000; 23: 95-103.
7. Sanz P. Esterilizante. Esteripharma, México.
8. Rojo M, Sardiñas S, Sosa MC, García I, Garay MI. Manual de Bioseguridad para Servicios Estomatológicos. Dirección Nacional de Estomatología. Programa Nacional VIH/SIDA. MINSAP, 2008.
9. Díaz Alfonso GR. Estado actual de los procesos de esterilización. Sociedad Cubana de Bioingeniería, 2003.
10. Healy CM, Kearns HP, Coulter WA, Stevenson M, Burke FJ. Autoclave use in dental practice in the Republic of Ireland. Int Dent J 2004; 54: 182-6.
11. Zadik Y, Peretz A. The effectiveness of glass bead sterilizer in the dental practice. Refuat Hapeh Vehashinayim 2008; 25: 36-9.
12. Acosta-Gío E. Prevención y control de infecciones en su consultorio dental. www.dentegra.com.
13. Casillas E, Morán MA. Bioseguridad en estomatología. Odontología Actual 2008; 59: 16-8.
14. Van Eldik DA, Zilm PS, Rogers AH, Marin PD. Microbiological evaluation of endodontic files after cleaning and steam sterilization procedures. Aust Dent J 2004; 49: 122-7.
15. Venkatasubramanian R, Das Um, Bhatnagar S. Comparisson of the effectiveness of sterilizing endodontic files by 4 different methods: an in vitro study. J Indian Soc Pedod Prev Dent 2010; 28:2-5.
16. Lopes C, Graziano KU, Pinto TJ. Evaluation of single-use reprocessed laparoscopic instrument sterilization. Best Pract Res Clin Gastroenterol 2011; 19: 370-7.
17. Yoon JH, Yoon BC, Lee HL, Kim YT, Lee DH, Choi IJ y cols. Comparison of sterilization of reusable endoscopy biopsy forceps by autoclaving and ethylene oxide gas. Dig Dis Sci 2012; 57: 405-12.
18. Negroni M. Microbiología estomatológica: fundamentos y guía práctica. 2º edición. Buenos Aires, Editorial Médica Panamericana, 2009.
19. Villalobos SG. Comparación del resultado del proceso de esterilización con dos indicadores biológicos. Rev Enfermería IMSS 2001; 9:143-6.
20. Patiño N, Loyola JP, Tovar LF. Uso y verificación con indicadores biológicos en esterilizadores de cirujanos dentistas de San Luis de Potosí, México. Salud Pública Méx 2001; 43: 455-8.
21. Reyes CA, Castillo JM, Martínez MP, Galan D, Aranda I. Muestreo biológico de autoclaves dentales, 2008.
22. Coulter WA, Chew-Graham CA, Cheung SW, Burke FJ. Autoclave performance and operator knowledge of autoclave use in primary care: a survey of UK practices. J Hosp Infect 2001; 48: 180-5.






