Rico Romano, C. Alumna del Master en Endodoncia y Odontología Estética y Conservadora de la Institución Universitaria Mississippi. / Vera Moros, C. – Reviejo Fraguas, M. Profesor del Master en Endodoncia y Odontología Estética y Conservadora de la Institución Universitaria Mississippi. / Garrido Lapeña, P. Subdirectora del Master en Endodoncia y Odontología Estética y Conservadora de la Institución Universitaria Mississippi. / Rodríguez Arrevola, N. Directora del Master en Endodoncia y Odontología Estética y Conservadora de la Institución Universitaria Mississippi
El perjuicio sobre el nervio dentario inferior puede desembocar en alteraciones sensitivas como la parestesia labiomandibular. La parestesia provocada por tratamientos endodónticos y sus efectos químicos se da cada vez con más frecuencia, representando un 35,3% de las quejas. Sin embargo, los pacientes recuperan su sensibilidad en un 85,1% de las lesiones.
La etiología es muy diversa, destacamos factores locales de origen mecánico, químico y térmico: técnica anestésica, sobreinstrumentación, sobreextensión del material de obturación, extrusión de hipoclorito de sodio al periápice, procesos infecciosos, uso de gutapecha-termoplástica y otras causas como la alergia a materiales de restauración. Para poder evitarlo es imprescindible conocer la anatomía, recorrido y neuropatología del nervio dentario inferior y sus ramificaciones. Y, por supuesto, realizar un correcto tratamiento de conductos.
Abstract
Severe injury to the inferior alveolar nerve could lead to sensory disturbances such a paresthesia of the lower lip and chin area. Paresthesia provoked by endodontic treatments and their chemical effects are cited more and more frequently in nerve injuries, representing 35,3% of complaints. However, patients´ sensitivity returned to normal in 85,1% of endodontic injuries. The etiology is very diverse: we emphasize local factors of mechanical, chemical and thermal origin: local anesthetic, endodontic overinstrumentation, overfills of root filling material, injection with sodium hypochlorite periapically, infectious processes, thermomechanical compaction and other reasons as the allergy to adhesive resine. To be able to avoid it, it is indispensable to know the anatomy, course and neuropathology of the inferior alveolar nerve and his branches. And, of course, it is necessary to carry out a correct treatment of conduits.
Introducción
Eliminar la pulpa y dentina infectadas, así como preparar y sellar el conducto radicular de forma correcta, constituyen los principios básicos del tratamiento de conductos (1). Son muchas las complicaciones que debemos evitar en este proceso, entre ellas, dañar el nervio dentario inferior (NDI) así como sus ramificaciones.
El perjuicio sobre el NDI puede desembocar en síntomas como la parestesia labiomandibular. De acuerdo con la Asociación Internacional del Estudio del Dolor, la parestesia ha sido definida como una sensación anormal, a veces espontánea y a veces provocada (2), que nuestros pacientes describen como quemazón, zumbido, pinchazo, prurito, frío y entumecimiento (2-8) y que en la mucosa oral puede dar lugar a xerostomía (9).
El objetivo de la siguiente revisión bibliográfica es documentar todas las causas que durante nuestro tratamiento de conductos puedan alterar la función del NDI, ya sea de forma permanente o transitoria.
 |
Epidemiología
La parestesia provocada por tratamientos endodónticos y sus efectos químicos se da cada vez con más frecuencia, representando un 35,3% de las quejas. Sin embargo, los pacientes recuperan su sensibilidad en un 85,1% de las lesiones (10).
Únicamente encontramos un estudio, el de Knowles et al. 2003 (3), en el que hablan de porcentajes de parestesia en función del grupo dental. Así la parestesia por endoncia en premolares mandibulares presentan una incidencia del 0,96%. Este no es un dato estadísticamente significativo, pero constituye un factor a tener en cuenta en nuestra consulta.
Neuropatología
Las alteraciones sensoriales derivadas del daño en el NDI pueden manifestarse en el paciente de forma transitoria o por el contrario permanecer a lo largo del tiempo, y todo depende de la estructura del nervio que dañemos. De este modo distinguiremos tres tipos de alteraciones en la estructura del nervio: neuropraxia (se caracteriza por la imposibilidad de conducir el impulso nervioso de forma transitoria, los casos más severos pueden tardar entre tres o cuatro meses en recuperarse), axonotmesis (se define como una rotura del axón, pero sin llegar a dañar el tronco del nervio) y neurotmesis (es la rotura completa del axón y del tejido conectivo que rodea el tronco nervioso, en este caso será necesaria la cirugía para que se produzca la regeneración del axón) (11-12).
Por lo tanto, todos los síntomas dependen de la estructura histológica del nervio que se vea afectada, ya sea por una iatrogenia o por un proceso infeccioso en periápice. Si el agente agresor queda fuera del epineuro puede que las manifestaciones orales no aparezcan; todo cambia cuando atraviesa esta capa más externa y difunde por el perineuro en íntimo contacto con los fascículos nerviosos (13). Así el paciente podrá referir distintos cuadros clínicos: hiperestesia, hipoestesia, parestesia, disestesia y anestesia (12, 14)
El diagnóstico de la anestesia o parestesia se basa en una exacta anamnesis, en la evaluación del inicio de las alteraciones sensoriales y su evolución. El examen del área afectada puede llevarse a cabo mediante pruebas térmicas, mecánicas, eléctricas o químicas, de las que obtendremos respuestas subjetivas. Los nervios más afectados son el NDI y el nervio mentoniano (NM) (15).
Etiología
La parestesia del NDI y NM puede estar causada por factores sistémicos o locales (5, 6, 8, 11, 16, 17) (ver Tabla 1). Nosotros nos centraremos en las alteraciones locales. Para un mejor estudio las dividiremos en tres grupos: mecánicas, químicas y térmicas.
1. De origen mecánico: formadas por alteraciones derivadas de la compresión, dilatación, resección parcial o total y laceración del nervio. La compresión determina una isquemia neural que puede ser externa, causada por una hemorragia derivada de una extracción o una cirugía, un edema o un hematoma, quistes, implantes o sobreextensión de las limas y material de obturación en endodoncia. O interna, producida por un edema intraneural.
2. De origen químico: pueden derivar de los componentes tóxicos de los materiales de obturación en endodoncia (paraformaldehído, corticoesteriodes, y eugenol) y de irrigación (hipoclorito de sodio). También de los efectos de la anestesia local, de los productos inflamatorios segregados tras producirse un daño en los tejidos y de los productos bacterianos en infecciones periapicales.
3. De origen térmico: es una consecuencia más inusual, puede derivar de técnicas de obturación con gutapercha termoplástica, o de un sobrecalentamiento del hueso tras el uso de la pieza de mano en cirugía oral (4, 7, 17).
Sea cual sea la causa del perjuicio en la fibra nerviosa, debemos tener siempre presente que el daño aumenta con la duración de la injuria (18). Por lo que cuanto antes determinemos y eliminemos la causa, la recuperación será más rápida.
Técnica anestésica
El daño provocado por la inyección de anestesia en odontología es una de las causas más comunes de parestesia del NDI (11). Aparentemente no está causada por el trauma que puede ocasionar la aguja. La aguja dental de un calibre 27 es de 500 a 1.000 veces mayor en diámetro que los 0,1 mm de la fibra nerviosa del dolor, frío y calor. Parece imposible dañar las finas fibras del dolor y dejar intactas las más grandes, la de la presión y la propiocepción. Es más probable que la parestesia causada por la anestesia local derive de la irritación de la zona producida por sus componentes alcohólicos en contacto con las fibras sensitivas (5).
A la hora de anestesiar nunca debemos olvidar la anatomía del plexo neurovascular alveolar inferior: la vena reside en una situación anterior a la arteria, y entre ellas el nervio, por lo que la primera es más vulnerable a la aguja durante la inducción del bloqueo nervioso. Esto explica lo positivo de la aspiración (19.
Extensión de la instrumentación más allá del ápice radicular
En casos de sobreinstrumentación, la parestesia puede estar causada por el daño físico de la lima a nervios periapicales, NDI y NM; el daño químico inducido por los productos inflamatorios segregados por los tejidos alterados; y por la presión que ejerce el edema inflamatorio (5).
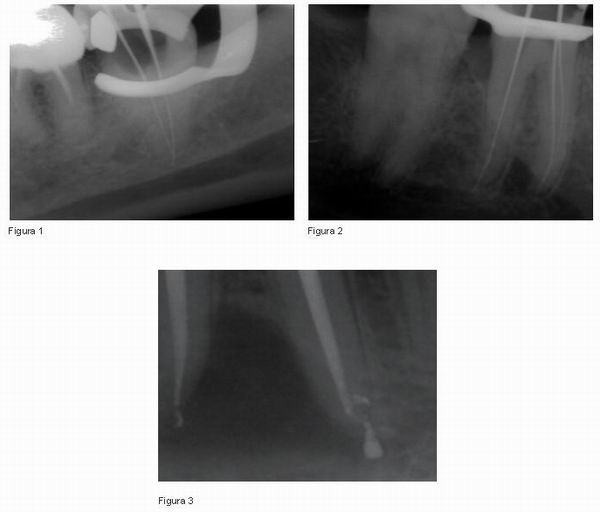
Durante el tratamiento, la radiografía de conductomentría es esencial no sólo para asegurarnos el trabajo correcto, sino para evitar posibles perforaciones y daños en el nervio derivados de nuestro tratamiento de conductos (20) (ver Figuras 1 y 2). Es probable que el daño mecánico ocasionado en el nervio como consecuencia de un exceso en la longitud de trabajo se pueda reparar por un proceso de cicatrización, y por lo tanto sólo produzca una parestesia temporal (5, 7).
Difusión de materiales de obturación al periápice
En pacientes en los que los materiales empleados para la obturación del conducto radicular han excedido la longitud de la raíz, la parestesia puede estar originada por la presión mecánica ejercida por el material sobreextendido; los productos inflamatorios liberados tras producirse el daño físico; la presión ejercida por el edema inflamatorio; el daño químico ocasionado por los componentes tóxicos del cono maestro o cementos selladores; y por el daño químico derivado de la combinación de las toxinas del material de obturación con mediadores químicos liberados como resultado de la inflamación (5).
La baja densidad de trabeculación en el hueso poroso de la región molar y la presencia de numerosas vacuolas facilitan la difusión de productos de obturación e irrigación cerca del tronco nervioso. Por otro lado, esta difusión se verá favorecida por la presencia de infección periapical, ya que ésta debilita la barrera ósea que existe entre el ápice radicular y el paquete neurovascular (7).
Ligeras extrusiones de materiales biocompatibles son generalmente bien toleradas por los tejidos circundantes al periápice (21), pero la completa biocompatibilidad de los materiales utilizados en nuestras consultas como selladores de conductos radiculares no es posible (1). Por ello materiales considerados tradicionalmente inertes, como los conos de gutapercha, han sido documentados como factores eventuales de alteraciones sensoriales en la región mentoniana tras la endodoncia de premolares y molares. La mayoría de los casos presentados son de gutapercha caliente, por lo que el daño causado no deriva tanto de su composición química, sino de trastornos térmicos y mecánicos (1, 22).
Diversos estudios han demostrado que todos los cementos son neurotóxicos en mayor o menor medida (13), siendo los que más efectos negativos ocasionan aquellos que presentan en su composición paraformaldehído o eugenol (1, 7, 5 13, 20, 21, 23, 24).
El paraformaldehído posee una acción neurotóxica muy fuerte, y la parestesia originada por este compuesto parece deberse a la destrucción química del axón (5). Tilotta-Yasukawa F. et al. 2006 (7) confirman que los cementos que contienen eugenol provocan la activación del sistema de complemento, la inhibición de la adherencia de los macrófagos, y como consecuencia, una respuesta inflamatoria significativa. A pesar de ello son muchos lo odontólogos que continúan usando este tipo de selladores (ver Figura 3).
Escoda Francoli J. et al. 2007 (25), y Fanibunda K. et al 1998 (21), afirman que la propagación de materiales como el hidróxido de calcio son bien tolerados por los tejidos perirradiculares. Sin embargo en la investigación llevada a cabo por Yatsuhashi T. et al. 2003 (26), exponen casos en los que la parestesia de la zona mentoniana es originada por el empleo de cementos a base de hidróxido de calcio, ya que éste forma una capa necrótica que puede extenderse al nervio. Ahlgren F. et al. 2003 (27), corroboran este trabajo. Los efectos de este material tienen lugar por exceso de calcio e iones hidróxido dando lugar a una desestabilización del potencial de la membrana del nervio. Lo mismo ocurre en el trabajo de Poveda R. et al. 2006 (1), en el que relatan que a pesar de ser el hidróxido de calcio un material compatible con el hueso, ha sido implicado en daños irreversibles en el nervio tanto en modelos experimentales como en pacientes.
La mejor forma de prevenir la difusión de material es introducir el cemento con los conos de gutapercha o con limas-K. Léntulos. Las medidas preventivas, como el empleo de un localizador de ápice, la formación de un buen stop apical o una condensación moderada nos pueden ayudar a evitar esta complicación (20, 25).
Extrusión de hipoclorito de sodio al tejido periapical
La biocompatibilidad del NaOCl es inversamente proporcional a su concentración (28), siendo la más indicada la que se encuentra en un rango de 0,5 al 5,25% (29).
Distintas complicaciones clínicas han sido descritas en la literatura cuando difunde de forma inadvertida a los tejidos circundantes al ápice radicular (28), entre ellas la parestesia del NDI y NM. Tolotta-Yasukawa et al. 2006 (7), nos cuentan cómo Hülsmann y Hahn, 2000 (30), seguidos de Gernhardt et al., han cuestionado el uso del NaOCl (al 3% y 5,25%) durante al irrigación del canal de molares y premolares inferiores y la aparición de parestesia combinada con la tumefacción del labio inferior y sensación de quemazón. La acción tóxica de este irrigante en un diente con foramen amplio, puede permitir su difusión y el consiguiente daño químico al paquete neurovascular. Debido a que la propagación es facilitada por el hueso esponjoso de la mandíbula, la alteración puede ocurrir sin que exista proximidad de los ápices al nervio, y además de forma rápida. Este hecho puede explicar la aparición de parestesia antes de que hayamos obturado los conductos radiculares, o en los casos en los que no hay sobreextensión del material de relleno.
Proceso infeccioso-quístico
Varias lesiones patológicas en las que podríamos incluir, infecciones periapicales y perirradiculares, alteraciones periodontales, tumores metastásicos y el adenocarcinoma mandibular, son consideradas la principal causa de parestesia en el labio inferior (12).
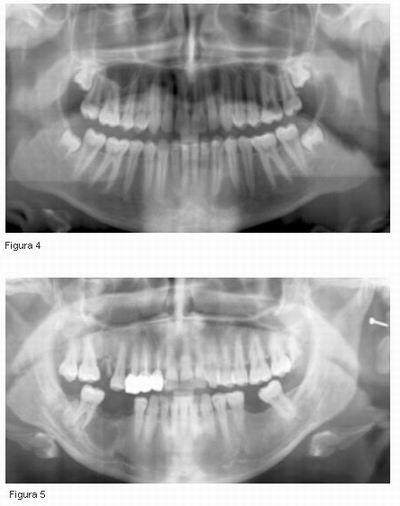
La expansión del proceso infeccioso y la inflamación asociada (edema) pueden causar presión sobre las fibras nerviosas, este hecho es lo suficientemente severo como para causar síntomas de parestesia. Como consecuencia se formará un hematoma que también presionará el nervio. Por otro lado, deberemos tener en cuenta los productos microbianos derivados de la infección, respecto a los cuales se ha hipotetizado que puedan romper el perineuro, introducirse en el canal y detener la conducción en el axón. Se ha demostrado además que ciertos microorganismos como los gram negativos, pueden dar lugar a neropatías. Es posible también que la alteración en el metabolismo del tejido de la zona afectada pueda alterar el impulso nervioso (4, 5, 8, 15, 31). (ver Figuras 4 y 5).
En la mayoría de los casos expuestos la parestesia remite tras eliminar la infección con nuestro tratamiento de conductos o tras retirar el quiste.
 |
Uso de gutapercha-termoplástica
Las temperaturas de ablandamiento de la gutapercha varían de unas marcas a otras, pero un aumento de sólo 10 ºC se ha demostrado que es perjudicial para la estructura ósea, siendo el nervio mucho más sensible (21, 22, 25). El mecanismo por el que se produce la alteración de la fibra nerviosa no se conoce (22).
A este daño además debemos sumarle la compresión que ejerce el material extendido sobre el paquete neurovascular. Las fibras más largas no son tan sensibles como las de menor longitud y las situadas en fascículos circunferenciales son afectadas en mayor grado que las que residen en el centro (21).
 |
Conclusiones
• La causa más frecuente de parestesia en odontología se relaciona con la extracción del tercer molar, a pesar de ello el tratamiento de conductos representa el 35,3% de los casos (10), por lo que es un hecho a tener en cuenta.
• La proximidad del canal mandibular a los ápices de molares y premolares requiere un diagnóstico radiográfico cuidadoso cuando planeamos la endodoncia de estos dientes. Deberemos tener en cuenta las posibles variaciones en su posición y sus posibles ramificaciones.
• La sintomatología referida por el paciente variará mucho en función de la estructura del axón que esté alterada.
• Cuanto antes eliminemos la causa de la parestesia, mayor será la posibilidad de remisión de los síntomas.
• Es muy importante conocer y realizar una buena técnica anestésica para evitar dañar el nervio. Aunque es raro que se produzca un daño permanente en el nervio secundario a la anestesia local.
• Una infección descontrolada y permanente a lo largo del tiempo puede llevar a parestesia del NDI y NM.
• Aunque el hipoclorito de sodio es relativamente inocuo cuando permanece dentro del conducto, puede ser extremadamente peligroso cuando difunde por el periápice.
• Son imprescindibles las radiografías de conductometría y conometría para evitar la sobreestensión de limas y gutapercha al periápice.
• Debemos evitar el uso de materiales de obturación que contengan formaldehídos y eugenol, ya que se ha demostrado que son los más agresivos.
• Si empleamos la técnica de gutapercha-temoplástica deberemos estar bien entrenados para impedir tanto un daño térmico como mecánico en el nervio.
BIBLIOGRAFÍA
1 .Poveda R, Bagán JV, Díaz Fernández JM, Sanchis JM. Mental nerve paresthesia associated with endodontic paste within the mandibular canal: report a case. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2006; 102: e46-9.
2. Scolozzi P, Lombardi T, Jaques B. Successful inferior alveolar nerve decompression for dysesthesia following endodontic treatment: Report of 4 cases treated by mandibular sagittal osteotomy. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2004; 97: 625-31.
3. Kowles KI, Jergenson MA, Howard JH. Paresthesia Associated with Endodontic Treatment of Mandibular Premolars. Journal of Endodontics 2003; 29 (11): 768-70.
4. Di Lenarda R, Cadenaro M, Satacchi C. Paresthesia of the mental nerve induced by periapical infection. A case report. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2000; 90: 746-9.
5. Morse DR. Endodontic-Related Inferior Alveolar Nerve and Mental Foramen Paresthesia. Compendium 1997; 18 (10): 963-87.
6. Cohenca N, Rotsein I. Mental nerve paresthesia associated with a non-vital tooth. Endod Dent Traumatol 1996; 12: 298-300.
7. Tilotta-Yasukawa F, Millot S, El Haddioui A, et al. Labiomandibular paresthesia caused by endodontic treatment: an anatomic and clinical study. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2006; 102: e47-e59.
8. Taha Ozkan B, Celik S, Durmus E. Paresthesia of the mental nerve stem from periapical infection of mandibular canine tooth: a case report. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2008; 105: e28-e31.
9. Zmener O. Mental Nerve Paresthesia Associated with an Adhesive Resin Restoration: A Case Report. Journal of Endodontics 2004; 30 (2): 117-9.
10. Libersa P, Savignat m, Tonnel A. Neurosensory Disturbances of the Inferior Alveolar Nerve: A Retrospective Study of Complaints in a 10-Year Period. J Oral Maxillofac Surg 2007; 65: 1486-9.
11. Giuliani M, Lajolo C, Deli G, Silveri C. Inferior alveolar nerve paresthesia caused by endodontic pathosis: A case report and review of the literature. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2001; 92: 670-4.
12. Jerjes W, Swinson B, Al Khawalde M, Hopper C. Paresthesia of the lip and chin area resolved by endodontic treatment: A case report and review of literature. British Dental Journal 2005; 198 (12): 743-5.
13. Progel MA. Damage to the inferior alveolar nerve as the result of root canal therapy. JADA 2007; 138: 65-9.
14. Missika P, Khoury G. Paresthesias and local and regional anaesthesia. Faculté de Chirugie Dentaire, Université Paris 7.
15. Yeler H, Özeç I, Kiliç E. Infection-related inferior alveolar and mental nerve paresthesia: Case reports. Quintessence International 2004; 35 (4): 313-6.
16. Pogrel MA,. The Results of Microneurosurgery of the Inferior Alveolar and Lingual Nerve. J Oral Maxillofac Surg 2002; 60: 485-9.
17. Gallas Torreira MM, Reboiras López MD, García García A, Gándara Rey J. Parestesia del nervio dentario inferior provocada por un tratamiento endodóncico. Med Oral 2003; 8: 299-303.
18. Scarano A, Di Carlo F, Quaranta A, Piattlli A. Injury of the inferior alveolar nerve after overfilling of the root canal with endodontic cement: a case report. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2007; 104: e56-e9.
19. Wadu SG, Penhall B, Townsend GC. Morphological Variability of the Human Inferior Alveolar Nerve. Clinical Anatomy 1997; 10: 82-7.
20. Gürkan Köseoglu B, Tanrikulu S, Kemal Sübay R, Sencer S. Anesthesia following overfilling of a root canal sealer into the mandibular canal: A case report. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2006; 101: 803-6.
21. Fanibunda K, Whitworth J, Steele J. The management of thermomechinically compacted gutta percha extrusion in the inferior dental canal. British Dental Journal, 1998; 184 (7): 330-2.
22. Blanas N, Kienle F, Sándor GKB. Inferior Alveolar Nerve Injury Caused by Thermoplastic Gutta-Percha Overextension. Journal of the Canadian Dental Association 2004; 70 (6): 384-7.
23. Yaltirik M, Ozbas H, Erisen R. Surgical management of overfilling of the root canal: A case report. Quintessence Int 2002; 33 (9): 670-2.
24. Kothari P, Hanson N, Cannell H. Bilateral mandibular nerve damage following root canal therapy. British Dental Journal 1996; 180 (5): 189-90.
25. Escoda-Francoli J, Canalda-Sahli C, Soler A, et al. Inferior Alveolar Nerve Damage Because of Overextended Endodontic Material: A Problem of Sealer Cement Biocompatibility? Journal Endodontic 2007; 33 (12): 1484-9.
26. Yatsuhashi T, Nakagawa KI, Matsumoto M, et al. Inferior alveolar nerve paresthesia relieved by microscopic endodontic treatment. Bull.Tokio dent Coll 2003; 44 (4): 209-12.
27. Ahlgren FKEK, Johannessen AC, Hellem S. Displaced calcium hidroxide paste cusing inferior alveolar nerve paresthesia: Report of a case. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2003; 96: 734-7.
28. Motta MV, Chaves-Mendoca MAL, Cardozo SyHF. Accidental injection with sodium hypochlorite: report a case. International Endodontic Journal 2009; 42: 175-82.
29. García Varela S, González Bahillo J, Varela Patiño P, et al. Extrusión de hipoclorito de sodio hacia los tejidos periapicales. Caso clínico. Endodoncia 2000; 18 (2): 73-8.
30. Hülsmann M, Hahn W. Complications during root canal irrigation – literatura review and case reports. International Endodontic Journal 2000; 33: 186-93.
31. Donald R. Infection-Related Mental and Inferior Alveolar Nerve Parestesia: Literatura Review and Presentation of Two Cases. Journal of Endodontics 1997; 23 (7): 457-60.
32. Concepcion M, Rankow HJ. Accessory Branch of the Mental Nerve. Journal of Endodontics 2000; 26 (10): 619-20.
33. Hu K-S, Yun H-S, Hur M-S, et al. Braching Patterns and IntraosseousCourse of the Mental Nerve. J Oral Maxillofac Surg 2007; 65: 2288-94.
34. Sato I, Ueno R, Kawai T, Yosue T. Rare Courses of the Mandibular Canal in the Molar Regions of the Human Mandible: A Cadaveric Study. Okajimas Folia Anat. Jpn. 2005; 82 (3): 95-102.
35. Levine MH, Goddard AI, Dodson TB. Inferior Alveolar Nerve Canal Position: A Clinical and Radiographic Study. J Oral Maxillofac Surg 2007; 65: 470-4.
36. Alantar A, Tarragano H, Lefèvre B. Extrusion of endodontic filling material into the insertions of the mylohyoid muscle: a case report. Med Oral Pathol 1994; 78: 646-9.
37. Estrela C, Estrela CRA, Barbin EL, et al. Mechanism of Action on Sodium Hypochorite. Braz Dent J 2002; 13 (2): 113-7.
38. Pogrel MA, Thamby SRI. Permanent nerve involvement resulting from inferior alveolar nerve blocks. JADA 2000; 131: 901-7.




