Jesús López Espinosa. Alumno de 5.º curso de Odontología de la UEM / Dr. Octavio Corral Pazos de Provens / Doctor en Medicina y Cirugía y Especialista en Microbiología Clínica. Madrid
Resumen
El Liquen Plano Oral (LPO) es una enfermedad inflamatoria crónica de la mucosa oral con una alta prevalencia, capaz de sufrir transformación maligna, y cuya etiología permanece desconocida.
Se han propuesto como factores etiológicos diferentes factores genéticos, enfermedades sistémicas como la Diabetes Mellitus, enfermedades hepáticas crónicas, algunos materiales dentales, fármacos, microorganismos, fenómenos de autoinmunidad o estrés.
Palabras clave
Liquen plano oral, enfermedad sistémica, enfermedad hepática, autoinmunidad, fármacos.
Abstract
Oral Lichen Planus (OLP) is a highly prevalent chronic inflammatory disease, susceptible to undergo malignant transformation whose etiology remains unknown, and factors like genetic background, chronic liver diseases, systemic diseases as Diabetes Mellitus, some dental materials, drugs, microbes, autoimmunity, or stress have been proposed as etiologic factors.
Key words
Oral lichen planus, systemic disease, hepatic disease, autoimmunity, drugs.
El liquen plano (LP) es una enfermedad mucocutánea de etiología desconocida, descrita inicialmente por Wilson en 1869 como una enfermedad mucocutánea crónica e histológicamente por Dubreuill en 1906 (1), que puede representar una respuesta inmunológica mediada por células a cambios antigénicos inducidos en las células de la piel y mucosa (2). Es una enfermedad crónica, inflamatoria, que afecta tanto a la mucosa como a la piel. El Liquen Plano Oral (LPO) es una de las enfermedades del adulto más frecuentes que afectan a la mucosa oral. No todos los pacientes que desarrollan lesiones cutáneas desarrollan LPO, y viceversa (3). La forma oral de LP parece que es más frecuente, crónica y grave que la forma cutánea, pudiendo persistir por más de 20 años sin remisión espontánea (4).
Material y métodos
Se ha realizado una búsqueda bibliográfica en MEDLINE de todos los artículos de revisión de la literatura publicados en los últimos 10 años, referentes a la etiología y etiopatogenia del LP y del LPO.
Epidemiología
La prevalencia real del LPO no se conoce exactamente, ya que no se han realizado estudios de prevalencia de la enfermedad sobre la población general, y las únicas referencias sobre la prevalencia del LPO se basan en la asistencia de pacientes a centros odonto-estomatológicos por mostrar algún grado de dolor, sospecha clínica o cualquier otro tipo de sesgo (5).
La prevalencia del LP en la población general de nuestro entorno se estima que oscila entre el 0,5-2 por ciento (1, 2) e incluso hasta el 4 por ciento en algunas zonas (6), mientras que la prevalencia estimada del LPO es de 0,1-2,2 por ciento (2, 7-9). En Estados Unidos la prevalencia del LP es del 2 por ciento (3). Se han descrito casos de LPO en niños (10) y adolescentes; sin embargo, el LPO es una enfermedad del adulto (rango de edad comprendido entre 30 y 70 años) con cierta predilección por el sexo femenino y su aparición suele ocurrir a partir de la cuarta década de la vida (el 60-65 por ciento de los casos se producen en mujeres de edad media) (2, 3, 5, 9-11).
La prevalencia de la infección por VHC en el mundo se estima que ronda el 3 por ciento, lo que representa aproximadamente 170 millones de individuos infectados. En la población general de Estados Unidos la prevalencia es del 1,4 por ciento (12). Sin embargo, existe una gran variación geográfica en la prevalencia de la infección. La prevalencia más baja de anticuerpos anti-VHC (0,01-0,1 por ciento) está en el Reino Unido y en los Países Escandinavos; existen unas tasas algo más superiores (0,05-0,2 por ciento) en Europa Occidental, América del Norte, Central, América del Sur, Australia y Sudáfrica; las tasas intermedias de infección (1-5 por ciento) se localizan en Brasil, Europa del Este, área mediterránea, Oriente Medio, India, Asia; y las mayores tasas de prevalencia de infección por VHC (17-26 por ciento) están en Egipto que, curiosamente, no presenta una importante asociación entre LP y VHC (12).
Naturaleza premaligna
La Organización Mundial de la Salud (OMS) define al LP como una lesión precancerosa (un estado generalizado asociado con un aumento significativo del riesgo de cáncer) (13).
Se ha sugerido que los pacientes con LPO deben ser sometidos a vigilancia y control estricto, no sólo para controlar la medicación para alivio de la sintomatología, sino también porque existe un pequeño riesgo de desarrollar carcinoma de células escamosas en aquellas áreas de lesión del LPO (5). De hecho, Hallopeau en 1910 ya describió el primer caso de LPO con degeneración maligna (1).
Diferentes autores afirman que el LPO tiene una naturaleza premaligna (3), y un potencial de transformación maligna que varía de unos estudios a otros: del 0,4 por ciento (8), del 0,8 por ciento (10), del 1,7 por ciento (5), e incluso del 10 por ciento en algunas series (1). Esta horquilla de porcentajes tan amplia podría deberse a que en las series publicadas, los estudios histológicos no se usaron siempre para el diagnóstico, o a que los patólogos usan diferentes parámetros para evaluar las lesiones (1). Se postulan tres teorías sobre la posible etiología del carcinoma de células escamosas: la primera, es que el LPO se transforma directamente en cáncer oral; la segunda, es que un epitelio alterado previamente podría ser más susceptible a los carcinógenos, virus o irritantes químicos; y la tercera, es que el carcinoma oral podría aparecer casualmente coincidiendo con un área afectada por LPO (1). Sin embargo, sí parece existir una pequeña tendencia del LPO a sufrir transformación maligna; además, existe una forma clínica de leucoplasia, la displasia liquenoide (13), que es una forma precancerosa y que comparte características histológicas comunes con el LP (1).
Los pacientes con LPO, cuando están expuestos a otros factores predisponentes de cáncer oral, puede transformarse ulteriormente en carcinoma oral; los factores más conocidos son la edad avanzada, el tabaco y el alcohol (13), y de hecho, el epitelio oral atrófico está especialmente predispuesto a estos factores predisponentes (13). El intervalo medio de tiempo entre el diagnóstico histológico inicial de LPO y el desarrollo de carcinoma puede variar desde 3,4 años hasta 10,1 años (13).
Existe mayor riesgo de carcinoma de células escamosas en pacientes con LPO, sobre todo en la variedad erosiva más que en la variedad atrófica, y en el borde de la lengua (8, 9).
La levadura Candida albicans, que produce una sustancia carcinogénica llamada N-nitrosobenzilmetilamina que se ha asociado con el desarrollo maligno de algunas leucoplasias, también puede ser importante en la transformación maligna del LPO. De hecho, hay una mayor prevalencia de portadores y de infección por C. albicans en los pacientes con LPO; además, los pacientes con LPO también están predispuestos a la candidiasis por los tratamientos tópicos y sistémicos con inmunosupresores (corticoides) empleados. Por otro lado, el virus herpes simples o el papilomavirus humano también pueden jugar un papel patogénico semejante al de la Candida, ya que ambos han sido implicados como factores de riesgo de cancerogénesis oral. No obstante, el papel de estos agentes infecciosos en la transformación maligna del LPO necesita ser más estudiado (10, 13).
No obstante, existe controversia sobre si el LPO se considera hoy en día una lesión premaligna (1). Se dice que el LPO no es realmente una lesión premaligna ya que muchas lesiones diagnosticadas clínica y/o histológicamente como LPO son realmente displasias liquenoides, que son displasias premalignas con apariencia liquenoide, por lo que el LPO no sería una lesión premaligna (10).
Presentación clínica
El LPO se puede desarrollar en cualquier superficie mucosa, incluyendo los labios y la lengua, pero sobre todo se desarrolla con mayor frecuencia en la mucosa bucal. Las lesiones a menudo son bilaterales y se desarrollan sobre más de una superficie mucosa. No obstante, la presentación clínica también puede estar limitada a un solo sitio. El LPO gingival puede ser más difícil de diagnosticar que las otras formas clínicas de presentación de la enfermedad. Cuando el LPO está confinado a la encía, la apariencia clínica es en forma de gingivitis descamativa y comparte muchas manifestaciones clínicas con las enfermedades vesiculoerosivas. En otras ocasiones se puede semejar a lesiones de leucoplasia, y otras veces no se puede diagnosticar porque coexiste con zonas de gingivitis (10).
Las manifestaciones clínicas pueden abarcar desde la aparición del LPO asintomático, incluso no siendo el paciente consciente de la presencia de lesiones intraorales, hasta lesiones extremadamente dolorosas que pueden entorpecer con la normal masticación afectando gravemente a la calidad de vida.
Las lesiones clásicas en piel de la forma cutánea de liquen plano se describen como placas de color rojo violáceo, poligonales, planas y pápulas pruríticas. Estas lesiones cutáneas generalmente se presentan en las superficies flexoras de las piernas y brazos, especialmente en las muñecas. También se pueden afectar los lechos ungueales (9).
Aproximadamente el 30-50 por ciento de los pacientes con lesiones orales también presentan lesiones cutáneas, por lo que la presencia de estas lesiones cutáneas características puede servir de ayuda para el diagnóstico del LPO.
Existen diferentes factores que precipitan o exacerban las manifestaciones clínicas de los pacientes con LPO. Los traumatismos de los procedimientos dentales, el calor y los irritantes del tabaco, la fricción de las cúspides dentales, las obturaciones mal realizadas, y los hábitos orales deletéreos como el mordisquearse los labios son factores que exacerban la enfermedad erosiva. Cuando se logra disminuir o minimizar estos factores, las lesiones revierten a una forma menos grave, e incluso las formas reticulares desaparecen completamente (10).
El LPO puede presentarse clínicamente en al menos seis formas clínicas diferentes que pueden aparecer por separado o simultáneamente: reticular, papular, en placas, atrófico, erosivo y bulloso (1). Se han descrito varios tipos de LPO, siendo las variedades reticular y erosiva las más frecuentes. Tampoco es raro que un mismo paciente pueda presentar múltiples variedades de LPO (1).
LPO reticular
La variedad reticular es la forma más frecuente de LPO (9). Se caracteriza por presentar líneas blancas entrelazadas queratósicas, llamadas estrías de Wickham, rodeadas de un borde eritematoso.
Las estrías típicamente se localizan bilateralmente en la mucosa bucal, encías y menos frecuentemente en la lengua, paladar y labios. Una forma de LPO reticular es la variante tipo placa, que clínicamente se semeja a una leucoplasia pero que sigue una distribución multifocal.
La forma de presentación de las lesiones tipo placa puede variar mucho, desde áreas planas y suaves hasta áreas irregulares y sobreelevadas. Esta variante de LPO reticular se localiza con mayor frecuencia en el dorso de la lengua y en la mucosa bucal. Tanto la forma reticular como su variante en placas suelen ser asintomáticas.
LPO erosivo
El LPO erosivo es la segunda forma más frecuente. Clínicamente se suele presentar como una mezcla de áreas ulceradas y eritematosas rodeadas por unas finas estrías queratósicas. Las lesiones pueden migrar de zona con el tiempo y convertirse en multifocal.
Los pacientes con esta forma de LPO suelen manifestar síntomas variados desde dolores episódicos hasta graves molestias que pueden interferir con la normal masticación.
Existen dos variantes de LPO erosivo, la variedad atrófica y la variedad bullosa. El LPO atrófico se presenta como placas eritematosas difusas rodeadas por finas estrías blancas; esta variedad suele causar grandes molestias bucales. En el LPO bulloso aparecen vesículas intraorales en la mucosa bucal y en los bordes laterales de la lengua; estas vesículas se rompen rápidamente al aparecer, lo que le da el aspecto clásico de LPO erosivo.
Etiología
La causa exacta no se conoce (3, 9). El LP puede representar un espectro de manifestaciones clínicas e histológicas que son el resultado de un amplio abanico de estímulos antigénicos. Se ha relacionado al LP con varias enfermedades sistémicas. En concreto, se ha relacionado al LPO con Diabetes Mellitus, enfermedades autoinmunitarias (8, 14) (miastenia gravis, síndrome de Sjögren, colitis ulcerosa, psoriasis, timoma, tiroiditis, enfermedad celiaca, crioglobulinemia, glomérulonefritis, anemia perniciosa, vitíligo, alopecia), enfermedades del tejido conectivo incluyendo Lupus Eritematoso, y más recientemente con la enfermedad de injerto contra huésped (EICH). Además, también se ha implicado en su etiopatología diferentes microorganismos (virus de las hepatitis B, C y G, papilomavirus humano, virus Epstein Barr, Helicobacter pylori, herpes virus 6, citomegalovirus, herpes simplex 1), alimentos y situaciones de estrés (3, 4, 8-11, 14, 15).
En el caso concreto del liquen escleroso atrófico, las causas pueden ser: enfermedades autoinmunitarias; origen infeccioso, o un “fenómeno isomórfico” (lesiones que se desarrollan en áreas de irritación o fricción previo trauma o infección), en el que la espiroqueta Borrelia burgdoferi está presente en cerca de la mitad de los casos; origen hormonal, en el que mujeres con liquen escleroso atrófico muestran bajos niveles de testosterona, dihidrotestosterona y androstenediona (15).
David Grinspan fue el primer autor en demostrar la frecuente asociación entre el LP y la Diabetes Mellitus. Esta asociación ha sido extensamente estudiada pero con resultados controvertidos. Muchos estudios asumen esta asociación basándose en dos hechos: el primero sería la mayor incidencia de Diabetes en los pacientes con LP que en la población general (6 por ciento); y el segundo serían los cambios inmunológicos observados en ambas enfermedades. Se estima que el 27,4 por ciento de los pacientes con LPO se asocian con Diabetes Mellitus tipo 2, y que el 17,7 por ciento de los pacientes con LPO se asocian con un metabolismo alterado de la glucosa (MAG). También hay autores que sugieren que los pacientes con LPO y Diabetes Mellitus presentan formas clínicas más agresivas (atrófico-erosivas) que en la población general; asimismo, también se ha sugerido que la lengua sería la localización más frecuente del LPO en los pacientes diabéticos (16).
La asociación entre LP mucocutáneo y enfermedad hepática crónica está reconocida en diferentes estudios (4, 11, 14, 17-20). La asociación entre LP y la enfermedad hepática crónica es patente en pacientes del área mediterránea, sobre todo con la variedad de LPO erosivo. Por el contrario, en el Reino Unido y en los Países Escandinavos no se ha podido constatar esta asociación. Las enfermedades hepáticas relacionadas con LPO son las hepatitis B y C, la colangitis esclerosante primaria y la cirrosis biliar primaria (11). Parece que la asociación del LP con la cirrosis biliar primaria se debe sobre todo al tratamiento con penicilamina (4). Los virus de la hepatitis B y C son los más importantes en esta asociación, aunque su papel se desconoce.
Recientemente se han visto casos de lesiones liquenoides en piel tras la vacunación frente al virus de la hepatitis B. La primera asociación entre LP y virus de la hepatitis B data de 1990; desde entonces, se han informado más de 20 casos, sobre todo en Francia e Italia. Las vacunas comerciales frente a la hepatitis B se preparan utilizando Aluminio, y parece ser posible que estas reacciones liquenoides se deban más a alguno de los constituyentes de las vacunas que al propio antígeno vacunal (proteína S del virus B) (17). El 21-30 por ciento de los pacientes de España e Italia con LP presentan marcadores de infección por el virus de la hepatitis B (VHB). Sin embargo, la mayoría de los pacientes con LP y enfermedad hepática crónica no están infectados por el VHB (4).
Diferentes estudios llevados a cabo en Japón y sur de Europa han demostrado una alta prevalencia (hasta del 65 por ciento) de anticuerpos anti-VHC en pacientes con LPO, siendo los valores más altos para Italia, España y Japón (8, 11, 18-21). Recientes estudios en Estados Unidos, Japón, España, Italia y Alemania confirman que el VHC es la principal causa de enfermedad hepática en los pacientes con LP, y se cree que el VHC podría estar implicado en el desarrollo del LP, especialmente en su variedad oral (20). En los últimos 15 años se ha visto una asociación entre el LP y el VHC; en un estudio de casos y controles se observó que el riesgo de desarrollar LP era superior en pacientes de Italia con antecedentes de enfermedad hepática (18). Esto podría ser debido al hecho de que en estas zonas hay una alta prevalencia de infección por el virus de la hepatitis C (VHC). Sin embargo, esta asociación también se ha producido en áreas geográficas en las que la prevalencia de VHC es baja, como en Estados Unidos (4) y Alemania. Sin embargo, en un estudio sobre 55 pacientes con LPO llevado a cabo en Holanda, zona geográfica de baja prevalencia de infección por VHC, no se observó una mayor incidencia de infección por VHC (19). De igual forma, Inglaterra y el norte de Francia son zonas de baja prevalencia (0-4 por ciento) de infección por VHC, donde muchos casos de LP claramente no están asociados a la infección por el VHC, y el LP está presente en sólo una minoría de pacientes con hepatitis C crónica (20). El mecanismo patogénico de la asociación entre el LPO y el VHC no está totalmente identificado. No se sabe si el VHC actúa localmente sobre las células de la piel y mucosas, o si por el contrario es la respuesta inmunitaria del huésped frente al VHC la que causa el LPO. El VHC podría estar implicado en la patogenia del LP al actuar como un antígeno exógeno o por la presencia en los queratinocitos de epítopos comunes similares a los de los hepatocitos dañados por el virus (21). Parece que existe una mayor tendencia a desarrollar LPO atrófico-erosivo en los pacientes con hepatitis crónica activa; también se ha relacionado la infección por VHC con la aparición de LPO reticular y con la variante clínica en placas (4). Debido a esta asociación, la enfermedad hepática crónica podría considerarse como un factor que agrava o empeora el curso clínico del LPO (a mayor alteración hepática, mayor tendencia a desarrollar presentaciones agresivas de LPO) (8). Los pocos estudios que analizan la frecuencia de LP entre los pacientes con infección por el VHC la estiman entre el 1,6 por ciento y 20 por ciento (4).
Se ha barajado también la infección hepática por otros virus diferentes al VHB y VHC como posible factor etiológico del LPO. En este sentido, se ha estudiado la asociación entre la infección por el virus de la hepatitis G (VHG) y el LPO. Parece que la infección por el VHG no es una característica particular de los pacientes con LPO relacionado con la infección por VHC. La mayor parte de los pacientes co-infectados por VHG padecían LPO reticular, la presentación clínica menos agresiva, lo que sugiere que la co-infección por VHG no aumenta la gravedad del LPO relacionado con el VHC. Por este motivo, la co-infección por VHG no parece tener un papel fundamental en la etiopatogenia del LPO relacionado con VHC (4). Además del VHG, el virus Epstein Barr y el recientemente descubierto virus TTV, tampoco se asocian con el LP (4).
La colangitis esclerosante primaria es una enfermedad hepática de etiología desconocida que generalmente afecta a pacientes de edad media (40 años) y con cierta predilección por el sexo masculino (2:1). Parece ser que existe una base inmunológica en su patogenia (linfocitos T de memoria no activados). Existe gran cantidad de literatura que describe la asociación entre el LPO y la enfermedad hepática crónica (hepatitis C y cirrosis biliar primaria), pero no con la colangitis esclerosante primaria. La asociación entre el LPO y la colangitis esclerosante primaria podría ser debida a varios factores: en primer lugar, a alteraciones inmunológicas relacionadas con el antígeno mayor de histocompatibilidad HLA; en segundo lugar, a metabolitos que produzcan cambios epiteliales que se manifestarían clínicamente en la cavidad oral como LPO, en el aparato digestivo como colitis ulcerosa y en el hígado como colangitis esclerosante primaria; en tercer lugar, a los efectos de la medicación con aminosalicilatos; y en cuarto lugar, a una respuesta anormal de la apoptosis de los tejidos implicados, ya que se ha demostrado una respuesta de apoptosis mediada por Fas/FasL en los tejidos de pacientes con Sjögren y LPO (11).
La enfermedad de Wilson, la hemocromatosis y el déficit de a1-antitripsina, se han relacionado esporádicamente con el LP (4).
También se ha descrito una asociación entre el LPO y la enfermedad inflamatoria intestinal, sobre todo con la colitis ulcerosa, que a su vez se asocia con colangitis esclerosante primaria. En estos pacientes parece que el tratamiento con sulfasalazina produce un derivado denominado ácido 5-aminosalicílico (5-ASA) que también se ha relacionado con la aparición de LPO (11).
Las reacciones liquenoides pueden ser indistinguibles clínica e histológicamente del LPO.
 Las reacciones liquenoides pueden estar producidas por fármacos (Tabla 1) (3, 9).
Las reacciones liquenoides pueden estar producidas por fármacos (Tabla 1) (3, 9).
Algunos autores han demostrado que las reacciones liquenoides orales con patrón papular/reticular y estrías de Wickham pueden aparecer en zonas de mucosa que están en contacto directo con las obturaciones de amalgama, las llamadas lesiones de contacto, y parece que estas lesiones pueden curar clínicamente después de reemplazar las obturaciones de amalgama por otros materiales (22, 23).
Se cree que el contacto genera una reacción de hipersensibilidad al mercurio liberado por la corrosión y desgaste de las obturaciones de amalgama de plata (24). Este dato está respaldado por el hecho de que el 16-62 por ciento de los pacientes con reacciones liquenoides orales muestran reacciones de hipersensibilidad al mercurio, en comparación al 2-4 por ciento de hipersensibilidad al mercurio en la población normal (22, 23, 25).
Algunos autores afirman que existen factores que precipitan la aparición del LPO. En concreto, el LPO se puede exacerbar por estrés, comidas, procesos dentales, enfermedades sistémicas y mala higiene oral (6, 10). Otros autores dicen que la propia placa dental puede actuar como antígeno e inducir LPO en algunos pacientes (3). En este sentido, parece que ciertos factores locales como la placa dental y los cálculos exacerban las lesiones de LPO. También parece que el depósito de placa y cálculo se asocia con una mayor incidencia de lesiones gingivales eritematosas y erosivas (10). Ya en 1958 Erpenstein observó que la eliminación de la placa dental en pacientes con LPO atrófico-erosivo mejoraba la lesión gingival, con disminución de los síntomas y de la inflamación gingival e incluso con reducción del componente erosivo, por lo que se sugirió que una minuciosa e intensa higiene oral podría contribuir a la mejora de las lesiones orales (6). No obstante, posteriormente se ha observado que los pacientes con lesiones de LPO atrófico-erosivo y aquellos con lesiones orales muy extensas, muestran grandes depósitos de placa dental y cálculos, y que contrariamente sería la grave sintomatología de estas lesiones la que podría explicar la mala higiene oral de estos pacientes y, por lo tanto, el mayor depósito de placa y cálculos. Por otro lado, la placa dental sí que puede actuar como factor irritante que empeora las lesiones ya presentes y formar así un pequeño círculo vicioso patogénico (6).
Cualquiera que sea el estímulo inicial, existe una respuesta inmunitaria mediada por células T contra antígenos extraños o autógenos en las células epiteliales basales.
Patogénesis
Parece existir una respuesta inmunitaria anormal de células T en la que las células basales epiteliales son reconocidas como extrañas por cambios en la antigenicidad de su superficie. Un estudio en el que compara dos variantes de LPO dice que pueden existir dos mecanismos inmunopatogénicos diferentes. El LPO y la enfermedad de injerto contra huésped (EICH) tienen en común una presentación clínica y características histológicas similares (9).
En diferentes estudios se ha explorado la posibilidad de la existencia de procesos autoinmunitarios como causa del LP, especialmente en aquellos casos en los que el LP se asociaba o aparecía en el seno una o más enfermedades autoinmunitarias. Sin embargo, estas asociaciones son raras; incluso en muy raras ocasiones se pueden encontrar autoanticuerpos y anticuerpos antinucleares. Además, tampoco parece existir evidencia sólida de inmunodeficiencia en el LP como lo demuestran los estudios realizados sobre los niveles séricos de inmunoglobulinas (Ig), complemento (C), ß2-microglobulina o inmunidad mediada por células. Recientes estudios señalan fuertemente la posibilidad de que tanto el LP como el LPO representen una respuesta inmunológica mediada por células a un cambio antigénico inducido en piel y mucosas. Además, y para apoyar esta hipótesis, se han observado erupciones similares al LP en la EICH.
Patogénesis del LP relacionado con VHC
Aparentemente, no existen diferencias significativas en las características histopatológicas específicas del LPO o en el infiltrado linfocitario, independientemente de la presencia o ausencia de infección por el VHC (4). La morbilidad asociada a la infección por el VHC no sólo se debe a las secuelas de la enfermedad hepática crónica, sino también a una gran variedad de manifestaciones extrahepáticas entre las que se encuentran las manifestaciones de la cavidad oral.
Alteraciones inmunitarias
La hepatitis C crónica se caracteriza por una respuesta inmunitaria anormal con aumento de autoanticuerpos, crioglobulinemia, glomerulonefritis, tiroiditis y vasculitis cutánea. El liquen plano también se ha asociado con alteraciones inmunitarias como presencia de autoanticuerpos, crioglobulinemia y tiroiditis, especialmente en pacientes con LPO erosivo y con LPO relacionado con VHC. En los pacientes con LPO e infección por el VHC, no se sabe exactamente cómo el VHC desarrollaría el LPO, pero el virus podría iniciar directamente el LPO o producir alteraciones inmunológicas similares a otras enfermedades extrahepáticas mediadas por mecanismos inmunitarios, como la crioglobulinemia mixta o la vasculitis cutánea. Se han detectado anticuerpos anti-epiteliales en pacientes con LPO, cuyo papel podría ser activar la citotoxicidad celular dependiente de anticuerpos o podrían simplemente estar dirigidos frente a subproductos del daño celular epitelial. En pacientes con LPO e infección por VHC no hay evidencia de daño hepático autoinmunitario ni respuesta inmunitaria humoral anormal. Estudios virológicos no han demostrado diferencias entre los niveles séricos de ARN de VHC y de genotipos de VHC en pacientes infectados por VHC con LPO y sin LPO. Por este motivo, es probable que los factores dependientes del huésped sean más importantes que los factores víricos en la patogénesis del LPO relacionado con el VHC (4, 14).
Factores víricos
El virus de la hepatitis C (VHC) es un virus ARN identificado por primera vez en 1989, que actualmente se considera la principal causa de enfermedad hepática crónica en el mundo (12, 26). Su genoma abarca aproximadamente 9.500 nucleótidos y, debido a los frecuentes errores que sufre en su replicación y a la falta de mecanismos de reparación genómica, es un virus extremadamente variable que se puede presentar en forma de cuasi-especies infectando a la vez al mismo individuo. Los diferentes genotipos tienen una distribución geográfica mundial un tanto heterogénea. El genotipo 1b es la variante más frecuente en Europa, Estados Unidos y Japón; el genotipo 2 es menos frecuente en Europa que en Japón y China; el genotipo 3 es el más frecuente en Tailandia, Singapur e India; el genotipo 4 es frecuente en Egipto, Oriente Medio y África Central; y los genotipos 5 y 6 son los más frecuentes en Suráfrica y Hong Kong respectivamente (12, 26).
El papel de determinados genotipos de VHC en la patogénesis del LPO relacionado con el VHC se ha descartado debido a que el LP se asocia con los mismos genotipos de VHC encontrados en los pacientes sin LP. El genotipo 1b es el genotipo que más se asocia con el LP; este genotipo es muy poco frecuente en el Reino Unido (4, 20). Lodi y cols. en 1997 (26) observaron que los pacientes con LPO erosivo y con manifestaciones clínicas importantes, tendían a estar infectados por el genotipo 1b; y este genotipo también está posiblemente asociado con la enfermedad hepática más agresiva, y además parece que este genotipo 1b responde peor al tratamiento con interferón que el resto de los genotipos. Por lo tanto, parecería posible pensar que también fuese el responsable de una forma clínica de presentación de LPO más agresiva. No obstante, otros autores no han podido detectar una asociación significativa entre el LP y un genotipo particular de VHC (26).
Tampoco existen diferencias en los niveles séricos de ARN de VHC en pacientes con y sin LP (4, 20).
Algunos autores sugieren que los factores que dependen exclusivamente del huésped son más importantes que los propios factores víricos en la patogenia del LP relacionado con el VHC (20).
Infección directa de las lesiones de LP
Algunos datos sugieren que las lesiones de LPO pueden contener material genético del VHC. Sin embargo, no es probable que el VHC produzca un daño directo en las células epiteliales de las lesiones del LPO porque también se han encontrado los mismos cambios en las células de la mucosa normal. El infiltrado linfocitario en banda típico de las lesiones de LPO sugiere que la destrucción de la mucosa oral se debe a la agresión inmunitaria local y no al propio virus.
Aspectos inmunogenéticos
Parece que existen diferencias genéticas en diferentes poblaciones. La mayor parte de los pacientes con LP idiopático se relacionan con HLA-DR1, mientras que el LP secundario y el LPO no. En Italia el LPO se relaciona con el HLA-DR6, lo que podría explicar parcialmente la heterogeneidad geográfica de la asociación del LP con el VHC (4, 20).
En diferentes estudios se ha sugerido una posible causa genética de LP como consecuencia de los estudios realizados en pacientes con LP familiar y de estudios de HLA en pacientes con LP (27):
1. Liquen Plano familiar
Se define como LP que afecta a dos o más miembros de una familia. La causa que lo produce se desconoce. No es probable la causa infecciosa ya que el LP familiar se presenta en personas de la misma familia que no viven juntos y puede aparecer en diferentes momentos a lo largo de la vida (intervalos de tiempo separados hasta por 30 años). Tampoco se ha encontrado ninguna asociación con un determinado antígeno HLA; sin embargo, son muy pocos los casos de LP familiar descritos en la literatura y sí que se podría esperar algún tipo de correlación entre los antígenos HLA de familiares cercanos.
2. Asociación de Liquen Plano con antígenos HLA
En la Tabla 2 se muestran diferentes estudios que demuestran asociaciones de antígenos HLA específicos con el LP.
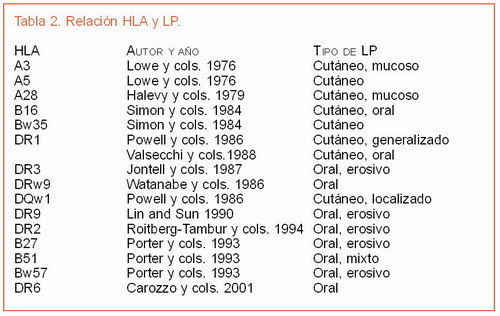
Esta variedad de resultados puede reflejar diferencias raciales de los pacientes y diferencias en la selección clínica de los pacientes. Además, en algunos de estos estudios, se agruparon en el mismo grupo a pacientes con LP cutáneo y LP mucoso, mientras que en otros estudios estaban en grupos separados. También parece que el LPO relacionado con el VHC podría estar particularmente asociado con el HLA-DR6 (20).
También parece existir un significante descenso en la frecuencia de HLA-DQ1 en pacientes con LP, lo que sugiere que este HLA-DQ1 podría conferir resistencia al desarrollo de LP, de forma similar a la hipótesis propuesta de los genes de resistencia a la Diabetes Mellitus y a la Leucemia.
Los estudios inmunogenéticos realizados en pacientes con LP y LPO han dado resultados contradictorios. El LP cutáneo idiomático se asocia frecuentemente al HLA-DR1, particularmente con el alelo DRB1*0101, mientras que esta asociación no está presente en los casos de LPO ni en el LP relacionado con enfermedad hepática (20).
Antígenos diana
Para identificar la naturaleza del antígeno implicado en el LPO se han llevado a cabo estudios de expresión del gen del receptor de células T que sugieren que el LPO no está causado por un único antígeno. Con gran probabilidad, el LPO es el resultado de un pequeño número de antígenos extrínsecos, antígenos propios alterados o superantígenos (4, 7). Los antígenos extrínsecos podrían venir de diferentes fuentes como alimentos, flora bacteriana, un gran número de medicamentos y materiales dentales; de hecho, en pacientes susceptibles, los fármacos y los empastes de amalgama inducen lesiones liquenoides. En las lesiones producidas por las amalgamas, las sales de mercurio liberadas del empaste pueden ser el antígeno responsable. Las sales de mercurio son moléculas de bajo peso molecular que atraviesan fácilmente la barrera epitelial y actúan como haptenos para alterar la antigenicidad de los antígenos propios epiteliales.
El virus de la hepatitis C (VHC) también podría estar implicado en la patogenia del LP actuando como un antígeno exógeno o debido a la presencia en los queratinocitos de epítopos comunes similares a los de los hepatocitos dañados por el virus (21). Independientemente de la fuente del antígeno responsable, éste es captado por las células de Langerhans del epitelio, y bajo la influencia del TNFa liberado por los queratinocitos de alrededor las células de Langerhans migran a los ganglios linfáticos. Aunque el número de células de Langerhans del epitelio del LPO parece no ser más elevado que el número de células de Langerhans de la mucosa oral normal, sí parece que están más activadas y que viajan más y con más frecuencia entre la mucosa oral y el tejido linfoide. En el tejido linfoide, las células de Langerhans presentan el antígeno a una gran variedad de células T. Así, cualquier célula T con receptores que reconozca al antígeno se activará, proliferará y recirculará a través de la mucosa oral (7).
Características histológicas
Las características histológicas del LPO, inicialmente descritas por Dubreuill en 1906, son similares a las del LP cutáneo (2).
El proceso inmunológico que se pone en marcha en esta enfermedad tiene como resultado degeneración vacuolar, lisis de las células basales y posteriormente licuefacción de las células basales. Además del infiltrado linfocitario superficial en banda y de la degeneración celular por licuefacción, las características histopatológicas del LP incluyen hiperparaqueratosis focal, acantosis irregular y una banda amorfa eosinofílica en la membrana basal (1, 10).
Infiltrado linfocitario
Histológicamente, la respuesta del epitelio muestra hiperparaqueratosis o hiperortoqueratosis y acantosis, licuefacción de la capa de células basales, destrucción del tejido conectivo, ruptura de la membrana basal epitelial y destrucción de los queratinocitos basales (3, 7). En las lesiones orales no suele haber hiperortoqueratosis (15).
Existe un infiltrado linfocitario en banda adyacente a la respuesta epitelial (7). Las lesiones de LP muestran un gran infiltrado linfocitario local subepitelial de linfocitos T activados con una mayor expresión local de citoquinas y expresión alterada de moléculas de adhesión. Este infiltrado linfocitario está formado principalmente por células T (CD4+, CD8+). También existen linfocitos B en menor cantidad y es muy rara la presencia de células NK. Los linfocitos T CD8+ se acumulan gradualmente en las lesiones según evoluciona la enfermedad. También parece que existe una mayor actividad supresora en este infiltrado inflamatorio, que un desequilibrio en la actividad de linfocitos T helper y supresores, y quizás éste es el determinante fundamental de la actividad inmunológica del infiltrado linfocitario (27).
Queratinocitos y células dendríticas
Los queratinocitos son la diana de las células T porque expresan un antígeno extraño en su superficie o un antígeno propio que ha sido alterado. Este hecho lo corroboran estudios de xenotrasplantes de médula ósea en los que las células T xenotrasplantadas reconocen como extraños los queratinocitos de la mucosa oral y se producen lesiones similares a las de la enfermedad de injerto contra huésped (7).
Los queratinocitos de las lesiones de LP son una fuente importante de citoquinas inflamatorias, y éstas a su vez serían importantes en la aparición de las lesiones. Parece ser que este infiltrado inflamatorio aumenta la expresión de antígenos del complejo mayor de histocompatibilidad de clase II, del antígeno de superficie 27E10, y de la molécula de adhesión ICAM-1, sobre todo en zonas adyacentes al infiltrado inflamatorio (27).
El número de células de Langerhans puede ser normal, pero adquieren un aspecto más dendrítico en el LP que en la mucosa normal, y expresan con mayor frecuencia HLA-DP, HLA-DQ y HLA-DR probablemente inducido por la producción local de citoquinas (27).
Daño producido por las células T a los queratinocitos basales
La presentación de antígenos por los queratinocitos basales a las células T citotóxicas específicas de antígeno tiene como resultado el que los queratinocitos se conviertan en diana de la destrucción inmunitaria mediada por células. Este daño que se produce en los queratinocitos basales es fundamental en el proceso patológico del LPO; el daño es mayor en los queratinocitos basales muy relacionados con infiltrados celulares inflamatorios, en las áreas de destrucción de las membranas basales, o en las áreas de invasión del epitelio por células T. Las células T citotóxicas inducen apoptosis en los queratinocitos de dos formas diferentes. La primera a través de la unión de la molécula Fas situada en la superficie celular del queratinocito, con su ligando Fas-L situado en las células T citotóxicas y en las células NK. En el segundo mecanismo la célula T libera la molécula perforina y produce el daño en la membrana de la célula diana. El TNFa también parece tener un papel en el daño de los queratinocitos basales promoviendo en ellos fenómenos de apoptosis (7).
Moléculas de adhesión celular
La Molécula-1 de Adhesión Intercelular (ICAM-1) tiene importancia en la unión y migración transendotelial de los leucocitos hacia los sitios de inflamación. En el LP existe un mayor aumento en la expresión de ICAM-1 en los queratinocitos basales, células de Langerhans, macrófagos y linfocitos T CD4+ y CD8+. De esta forma, la mayor expresión de ICAM-1 en el LP permite el acúmulo de linfocitos T en las lesiones (10).
La Molécula-1 de Adhesión Celular Vascular (VCAM-1) parece estar presente en los casos de LP cutáneo, pero no siempre en los casos de LP oral.
Papel de citoquinas, quimioquinas y moléculas de adhesión
El TNFa, el IFNg y otras citoquinas liberadas por el infiltrado inflamatorio tienen un papel importante para facilitar el reclutamiento de linfocitos desde la circulación sistémica hacia el infiltrado inflamatorio subepitelial; concretamente, TNFa e IFNg inducen la expresión de moléculas de adhesión en los vasos sanguíneos de la mucosa oral afectada. TNFa e IFNg inducen la expresión de ICAM-1 y VCAM-1 en el endotelio de los vasos sanguíneos locales que facilitan la migración de los linfocitos a través de la pared vascular y por el tejido conectivo. Una vez que los linfocitos salen del vaso sanguíneo la migración hacia el epitelio se realiza gracias a las quimioquinas que liberan las células epiteliales y el infiltrado asociado. Las quimioquinas refuerzan la adhesión de las células T a los vasos sanguíneos y su migración a través del tejido conectivo. Los queratinocitos orales pueden producir diferentes quimioquinas, incluyendo las específicas de células T (RANTES y MCP1). Las citoquinas y quimioquinas juntas servirán para reclutar el infiltrado de células T subepiteliales que caracteriza al LPO. TNFa e IFNg también inducen la expresión de ICAM-1 en los queratinocitos del LPO, lo que permitirá la adhesión de las células T a los queratinocitos y promoverá así la invasión intraepitelial de linfocitos (7).
Proceso de iniciación y susceptibilidad individual al LP
Se sabe muy poco sobre qué hace a una persona y no a otra susceptible a desarrollar la enfermedad o cómo se inician las lesiones. El proceso de iniciación está mejor estudiado en las reacciones liquenoides producidas por amalgamas. En estas reacciones liquenoides las concentraciones subtóxicas de sales de mercurio inducen la expresión de dos moléculas; por un lado aumentan la expresión de ICAM-1 con lo que se favorece la unión de las células T a los queratinocitos orales. Por otro lado, también se estimula la producción de TNFa de los queratinocitos, lo que tiene como consecuencia la migración de células de Langerhans, la liberación de quimioquinas RANTES, y la expresión de moléculas de adhesión vascular para reclutar células T. El que esta reacción inicial progrese o no hacia el desarrollo de LPO depende de varios factores, tales como la naturaleza del antígeno, la capacidad del individuo para la presentación del antígeno (por ejemplo, el tipo de HLA), la presencia de células T capaces de reconocer al antígeno, y posiblemente la herencia de un perfil de citoquinas y otros polimorfismos génicos que promueven, en lugar de suprimir, una respuesta mediada por células frente al antígeno.
Inmunidad humoral
Existen muy pocos datos que apoyen la presencia de una respuesta inmunitaria humoral alterada en la patogenia del LP. En alguna ocasión se ha asociado al LP con hipogammaglobulinemia (27).
Se ha descrito en numerosas ocasiones la asociación de LP con otras enfermedades autoinmunitarias. Sin embargo, la frecuencia de enfermedades autoinmunitarias en pacientes con LP no es siempre superior a la de la población general, y no hay una mayor frecuencia de antígenos HLA asociados con fenómenos autoinmunitarios (HLA B8, DR3, DR4) (27).
Conclusiones
Todavía no se conocen con exactitud todos los mecanismos inmunopatogénicos que conducen al desarrollo de LPO.
No se conoce el mecanismo que inicia la lesión. Los fármacos y el VHC pueden inducir o exacerbar el LPO, pero no se sabe si estos agentes exógenos influyen en la función de los queratinocitos o en la función del sistema inmunitario. No parece probable que el LPO represente una respuesta inmunitaria determinada genéticamente frente a algún agente iniciador exógeno identificado o no identificado. Lo que sí está claro es que, una vez que el sistema inmunitario ha sido activado, todo el proceso inmunopatogénico está mediado por células.
El LPO puede representar una reacción de hipersensibilidad tipo IV frente a un agente exógeno que haya podido alterar la función de los queratinocitos.
La alta prevalencia de trastornos del metabolismo de la glucosa en pacientes con LPO justifica la utilización de la glucosa basal plasmática para la selección de diabetes tipo 2 en pacientes con esta patología.
En vista de la elevada prevalencia y el potencial de causar molestias orales en pacientes con LPO, es importante que los odontólogos sean conscientes de su presentación clínica y tratamiento. Además, debido a que el LPO tiene riesgo de desarrollar un cáncer de células escamosas, es recomendable el seguimiento periódico para detectar la transformación maligna.
Sería necesario o se recomienda que los pacientes con LPO se hagan estudios hepáticos. La enfermedad hepática crónica podría considerarse como un factor que agrava o empeora el curso clínico del LPO.
Se debería descartar la infección por VHC en pacientes con LPO. El LP, sobre todo el de la cavidad oral, parece que está asociado a la infección por VHC en el sur de Europa y Japón pero no en el norte de Europa. Esta diferencia se debe sólo parcialmente al nivel de endemismo del VHC en la población general. Los factores inmunogenéticos explican parcialmente la heterogeneidad geográfica de la asociación entre el LP y el VHC. El VHC está relacionado con la patogénesis del LPO induciendo una respuesta inmunitaria específica frente a epítopos del VHC.
En resumen, el LPO es una enfermedad heterogénea con diferentes factores predisponentes, causas y posiblemente diferentes mecanismo patogénicos. G.
Bibliografía
1. Lo Muzio L, Mignogna MD, Favia G, Procaccini M, Testa NF, Bucci E. The possible association between oral lichen planus and oral squamous cell carcinoma: a clinical evaluation on 14 cases and a review of the literature. Oral Oncol. 1998 Jul; 34(4):239-46.
2. Jungell P. Oral lichen planus. A review. Int J Oral Maxillofac Surg. 1991 Jun; 20(3):129-35.
3. Miles DA, Howard MM. Diagnosis and management of oral lichen planus. Dermatol Clin. 1996 Apr; 14(2):281-90.
4. Carrozzo M, Gandolfo S. Oral diseases possibly associated with hepatitis C virus. Crit Rev Oral Biol Med. 2003; 14(2):115-27.
5. Chainani-Wu N, Silverman S Jr, Lozada-Nur F, Mayer P, Watson JJ. Oral lichen planus: patient profile, disease progression and treatment responses. J Am Dent Assoc. 2001 Jul; 132(7):901-9.
6. Ramón-Fluixa C, Bagan-Sebastián J, Milian-Masanet M, Scully C. Periodontal status in patients with oral lichen planus: a study of 90 cases. Oral Dis. 1999 Oct; 5(4):303-6.
7. Thornhill MH. Immune mechanisms in oral lichen planus. Acta Odontol Scand. 2001 Jun; 59(3):174-7.
8. Romero MA, Seoane J, Varela-Centelles P, Diz-Dios P, Otero XL. Clinical and pathological characteristics of oral lichen planus in hepatitis C-positive and –negative patients. Clin. Otolaryngol. 2002; 27: 22-26.
9. Edwards PC, Kelsch R. Oral lichen planus: clinical presentation and management. J Can Dent Assoc. 2002 Sep; 68(8):494-9.
10. Eisen D. The clinical features, malignant potential, and systemic associations of oral lichen planus: a study of 723 patients. J Am Acad Dermatol. 2002 Feb; 46(2):207-14.
11. Tong DC, Ferguson MM. Concurrent oral lichen planus and primary sclerosing cholangitis. Br J Dermatol. 2002 Aug; 147(2):356-8.
12. Lodi G, Porter SR, Scully C. Hepatitis C virus infection: Review and implications for the dentist. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 1998 Jul; 86(1):8-22.
13. Hietanen J, Paasonen MR, Kuhlefelt M, Malmstrom M. A retrospective study of oral lichen planus patients with concurrent or subsequent development of malignancy. Oral Oncol. 1999 May; 35(3):278-82.
14. Carozzo M, Gandolfo S, Lodi G, Carbone M, Garzino-Demo P, Carbonero C, Porter SR, Scully C. Oral lichen planus in patients infected or noninfected with hepatitis C virus: the role of autoinmunity. J Oral Pathol Med. 1999; 28: 16-9.
15. Brown AR, Dunlap CL, Bussard DA, Lask JT. Lichen sclerosus et atrophicus of the oral cavity: report of two cases. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 1997 Aug; 84(2):165-70.
16. Romero MA, Seoane J, Varela-Centelles P, Diz-Dios P, García-Pola MJ. Prevalencia de diabetes mellitus en pacientes con liquen plano oral (LPO). Características clínico-patológicas. Medicina Oral 2002; 7: 121-9.
17. Pemberton MN, Sloan P, Thakker NS. Oral lichenoid lesions after hepatitis B vaccination. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2000 Jun; 89(6):717-9.
18. Lodi G, Carrozzo M, Harris K, Piattelli A, Teo CG, Gandolfo S, Scully C, Porter SR. Hepatitis C virus-associated oral lichen planus: no influence from hepatitis G virus co-infection. J Oral Pathol Med. 2000 Jan; 29(1):39-42.
19. Van der Meij EH, Van der Waal I. Hepatitis C virus infection and oral lichen planus: a report from The Netherlands. J Oral Pathol Med. 2000 Jul; 29(6):255-8.
20. Carrozzo M, Francia Di Celle P, Gandolfo S, Carbone M, Conrotto D, Fasano ME, Roggero S, Rendine S, Ghisetti V. Increased frequency of HLA-DR6 allele in Italian patients with hepatitis C virus-associated oral lichen planus. Br J Dermatol. 2001 Apr; 144(4):803-8.
21. Giménez-García R, Pérez-Castrillón JL. Lichen planus and hepatitis C virus infection. J Eur Acad Dermatol Venereol. 2003 May; 17(3):291-5.
22. Ostman PO, Anneroth G, Skoglund A. Amalgam-associated oral lichenoid reactions. Clinical and histologic changes after removal of amalgam fillings. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 1996 Apr; 81(4):459-65
23. Smart ER, Macleod RI, Lawrence CM. Resolution of lichen planus following removal of amalgam restorations in patients with proven allergy to mercury salts: a pilot study. Br Dent J. 1995 Feb 11; 178(3):108-12.
24. Axell T. Hypersensitivity of the oral mucosa: clinics and pathology. Acta Odontol Scand. 2001 Oct; 59(5):315-9.
25. Warfvinge G, Hellman M, Maroti M, Ahlstrom U, Larsson A. Hg-provocation of oral mucosa in patients with oral lichenoid lesions. Scand J Dent Res. 1994 Feb; 102(1):34-40.
26. Lodi G, Carrozzo M, Hallett R, D»Amico E, Piattelli A, Teo CG, Gandolfo S, Carbone M, Porter SR. HCV genotypes in Italian patients with HCV-related oral lichen planus. J Oral Pathol Med. 1997 Sep; 26(8):381-4.
27. Porter SR, Kirby A, Olsen I, Barrett W. Immunologic aspects of dermal and oral lichen planus: a review. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 1997 Mar; 83(3):358-66.



