Resumen
La colocación de implantes es hoy en día muy frecuente por lo que también aumenta la necesidad de reparar defectos óseos mediante técnicas de regeneración tisular guiada. La utilización de procedimientos de aumento de hueso ha extendido el uso de implantes endoóseos en áreas con insuficiente volumen óseo.
Esta técnica se desarrolló en la década de los 80 para el tratamiento de los defectos periodontales y se basa en los principios de exclusión celular.
La colocación de la membrana de manera que cubra el defecto periodontal, evita el contacto del epitelio y el tejido conectivo con la raíz durante la curación. Al mismo tiempo, se crea un espacio entre la membrana y la superficie de la raíz que permitirá a las células del ligamento periodontal la producción de una nueva inserción y a las células óseas la producción de hueso.
Existen en el mercado una gran variedad de membranas reabsorbibles con diferentes composiciones y características. Conocer sus características, los factores que influyen en su éxito o en su fracaso, así como las diferentes opciones que tenemos a la hora de escoger una membrana, permitirá aumentar el índice de éxito de nuestros tratamientos y al mismo tiempo de mejorar el estado de salud de nuestros pacientes que es lo más importante.
Abstract
The use of implants is nowadays very frequent so it also increases the necessity to repair bony defects by means of techniques of guided tissue regeneration. The use of bone augmentation procedures has extended the use of endosseous implants in areas with insufficient bone volume. This technique was developed in the decade of the 80 for the treatment of the periodontal defects and it is based on the principles of cellular exclusion.The placement of a barrier covering the periodontal defect prevent the contact of epithelium and the connective tissues with the root surface during the treatment. At the same time, a space is formed between the membrane and the root surface to avoid the periodontal ligament cells to produce a new attachment and the bone cells to produce new bone.A great variety of reabsorbable barriers with different compositions and characteristics exist in the market. It´s important to know its characteristics, the factors that influence in their success or its failure, as well as, the different options that we have at the time of choosing a membrane to increase the index of success of our treatments and at the same time to improve the health of our patients that is the important thing.
Palabras clave
Membranas reabsorbibles, regeneración ósea guiada, membranas colágenas.
Introducción
Revisión histórica
La utilización de membranas comenzó en 1982 con los trabajos realizados por Nyman y cols. En los que tras realizar un levantamiento de colgajo de espesor total, tartrectomía y eliminación del tejido de granulación de la superficie radicular de un incisivo mandibular, advirtieron la presencia de un defecto óseo de 11 mm. Colocaron la membrana (filtro millipore) de manera que cubriese la superficie radicular y parte del tejido óseo circundante para posteriormente suturar el colgajo, así se conseguía la exclusión del epitelio gingival y el tejido conectivo.
El análisis histológico realizado tras 3 meses de curación mostró la presencia de nuevo cemento con fibras de colágeno insertadas.
Posteriormente en otro estudio se evaluaron 12 dientes tratados con RTG (1).
Los resultados demostraron que se habían formado diferentes cantidades de inserción de tejido conectivo, siendo la formación de hueso muchas veces incompleta.
Esto demostraba que las células de los diferentes tejidos pueden proliferar de manera independiente.
Las variaciones en los resultados se pensó que podían deberse a causas como la cantidad de ligamento periodontal remanente, la morfología del defecto tratado, las dificultades técnicas en la colocación de la membrana, la retracción gingival y la contaminación bacteriana de la membrana y de la herida durante la cicatrización.
La aplicación de la regeneración ósea guiada para el aumento de reborde óseo fue empleada por Dhalin a principio de los 80 y se basaba también en los principios de exclusión celular.
En su trabajo Dhalin establece cinco condiciones para la predictibilidad de la formación del nuevo tejido óseo:
• Presencia de células osteogénicas en vecindad con el defecto óseo.
• Adecuada vascularización procedente de la superficie ósea adyacente (canales de Volkman y compartimentos medulares).
• Estabilidad mecánica de la zona herida durante el periodo de cicatrización.
• Mantenimiento del espacio entre la membrana y el tejido óseo remanente.
• La membrana debe ser capaz de excluir células del tejido conectivo o de tejidos blandos del espacio creado por la membrana.
Aplicaciones clínicas
Como hemos mencionado anteriormente, la utilización de membranas en la actualidad se divide en periodoncia e implantología (2).
En implantología su uso junto con injertos, ya sean de tejidos óseos como de materiales sustitutivos, mejora los resultados obtenidos en este tipo de cirugías.
Se utilizan para:
• Reparación de defectos óseos previos a la colocación del implante.
A) Fenestraciones.
B) Dehiscencias.
C) Tratamiento de periimplantitis. Defectos circunferenciales aparecidos en la colocación del implante o en el transcurso del tratamiento.
D) Colocación simultánea o diferida de implantes en alvéolos después de extracciones.
E) Colocación de las fijaciones en el sitio predeterminado, por funcionalidad o estética.
• Creación de tejido óseo en zonas no osificadas previamente.
A) Injertos de seno maxilar.
B) Injertos onlay maxilares o mandibulares.
Las dehiscencias son faltas de recubrimiento óseo en la porción más coronal de las raíces. Son defectos mayores que las fenestraciones por lo que vamos a necesitar casi siempre utilizar injertos de hueso autólogo, así como materiales osteoinductores y osteoconductores.
Se llama fenestración a la falta de recubrimiento óseo de la superficie radicular de un diente con presencia de hueso en la porción ms coronaria a la misma, normalmente situados en la tabla vestibular de maxilar y mandíbula, ya que son zonas con poco volumen óseo y por lo tanto más susceptibles a la perforación debido a la presión del implante. Normalmente son áreas con poco componente celular por lo que para que su regeneración sea adecuada vamos a necesitar utilizar hueso autólogo, factores de crecimiento y materiales osteoconductores. Aunque al ser áreas con menor perdida ósea no siempre será necesario utilizar autoinjertos de hueso.
Muchas veces, vamos a tener que realizar exodoncias previas a la colocación de los implantes por lo que es frecuente encontrar zonas de grandes defectos óseos en las que tendremos que utilizar técnicas de ROG para su recuperación. Son zonas de una gran celularidad, no siempre vamos a necesitar utilizar autoinjertos debido a la elevada cantidad de osteoblastos presentes pero sí materiales que favorezcan la osteoinducción.
En estos casos la mejor opción es colocar membranas no reabsorbibles que son de mayor rigidez y proporcionarán una mejor configuración anatómica.
Su uso en periodoncia esta destinado al tratamiento de defectos óseos verticales y de lesiones de furca de grado II, en el tratamiento de lesiones de furca más avanzadas y en defectos de 3 paredes se utilizaría junto con injertos óseos (3).
Regeneración tisular guiada
Hoy en día los procesos regenerativos periodontales, ya sea para tratar los diversos defectos óseos en la colocación de implantes o en el tratamiento de recesiones gingivales, son muy demandados por lo que es importante poder predecir con cierta aproximación los resultados que podemos obtener mediante nuestros tratamientos y así poder proporcionarles a nuestros pacientes la mejor solución posible a sus problemas.
Para saber por qué funcionan las membranas, sus ventajas e inconvenientes y en qué ocasiones están más o menos indicadas, es importante analizar primero la fisiología del organismo lo que nos ayudará a comprender mejor por qué tienen éxito o por qué fracasan las membranas.
Hay diferentes estudios que demuestran que se puede formar ligamento periodontal (LPO) alrededor de los implantes. Gottlow y cols. en sus trabajos han observado que el LPO tiene capacidad para regenerar los tejidos periodontales ya que puede producir células con la habilidad de diferenciarse en cementoblastos, fibroblastos y osteoblastos, mientras que las células del hueso alveolar y del tejido conectivo gingival no (1).
En otros estudios posteriores se ha visto que se depositaba una capa de cemento con fibras colágenas insertadas perpendicularmente en la superficie de los implantes, es decir, que las células del LPO pueden producir un nuevo tejido similar al ligamento periodontal alrededor del implante (4-42).
El principio de exclusión celular en el que se basan las membranas parte del conocimiento de los acontecimientos que tienen lugar en el ligamento periodontal durante la curación de una herida.
Tras realizar un colgajo mucoperióstico de espesor total y el raspado y alisado radicular, quedan en contacto la superficie de la raíz y el tejido conectivo del colgajo. El primer paso en la curación de esta herida es la formación de un coágulo sanguíneo que comienza con la migración de las células sanguíneas a la zona de la herida. Posteriormente se desarrolla un coágulo de fibrina que se une a la raíz.
Unas horas más tarde comienza la fase temprana de la inflamación con la migración de células inflamatorias, principalmente neutrófilos y monocitos. A los pocos días la fase tardía de la inflamación tiene lugar, con la migración de macrófagos hacia la herida para formar el tejido de granulación.
Una semana después de la realización del colgajo puede verse tejido conectivo sobre la superficie de la raíz.
Hay que tener en cuenta que para regenerar los tejidos perdidos son necesarias tanto la disponibilidad de células como los signos que estimulan a estas células. La matriz extracelular es la responsable de cómo estas células responden a estos estímulos. Tanto la forma y el tamaño de la herida como el potencial de las células para migrar determinan la curación del tejido.
Es muy importante que las membranas proporcionen una adecuada estabilidad a la herida ya que en lugar de una curación mediante la formación de tejido conectivo se formaría un epitelio largo de unión, que debería ser considerada como un fracaso (5).
Gottlow y cols. en sus estudios observaron que existen diversos factores que se deben tener en cuenta ya que podrían influir en la regeneración periodontal porque la cantidad de fibras formadas no era la misma en todos los dientes que habían tratado, en unos solo se habían formado unos milímetros de cemento mientras en otros la regeneración había sido completa (1).
Hay que tener en cuenta el grado de recesión gingival durante la curación, ya que cuanto mayor sea la recensión, menor superficie de raíz podrá ser repoblada con las células del periodonto.
La morfología del defecto también es importante ya que se vio que en los defectos angulares las células del LPO pueden emigrar hacia la herida desde los laterales y la zona apical mientras que en los defectos horizontales, las células provienen solamente de la zona apical, donde se conserva parte del periodonto (6).
Otro factor a tener en cuenta es la cantidad de LPO remanente ya que a menor cantidad de ligamento periodontal remanente, menor cantidad de células habrá para la regeneración de los tejidos (1).
Al mismo tiempo también importa la disponibilidad de células progenitoras y los problemas que pueda haber a la hora de cubrir adecuadamente la membrana con el colgajo.
La profundidad de sondaje inicial, buena higiene oral, ausencia de inflamación gingival y de infecciones por A. Actinomycetemcomitans y la presencia de células de tejido conectivo sobre la superficie interna de la membrana al retirarla favorecen la regeneración periodontal. Controlando estos factores, podremos aumentar la predictibilidad y el éxito de la regeneración tisular (7).
Existen en el mercado diferentes tipos de membranas disponibles, pueden ser membranas reabsorbibles, por ejemplo membranas de colágeno bovino tipo 1, membranas de ácido poliláctico o de ácido poliglicólico, o también membranas no reabsorbibles de ePTFE.
En estudios se ha visto que no todas actúan de la misma manera ante la presencia de células de LPO (8).
Todas estas membranas tienen diferente composición pero todas ellas tienen como función evitar el contacto de las células del epitelio y del tejido conectivo gingival con la superficie de la herida y permitir así la regeneración gracias al potencial de las células del ligamento periodontal.
Polimeni y cols. sugieren en sus estudios que la actividad de las células del ligamento periodontal esta influenciadas por el material utilizado ya que los resultados indicaron que había membranas en las que no existía proliferación celular, las de Gore-Tex, mientras que en las colágenas si que había aunque era diferente entre ellas. La diferencia en el grado de entrecruzamiento de las fibras colágenas, la rugosidad de la superficie y la estructura de las moléculas colágenas podría causar diferentes efectos en la unión celular y su proliferación (5).
Manipulación de la membrana
Para tener éxito en el tratamiento, es muy importante conocer los pasos que se deben seguir y de que manera actuar, ya que cualquier error podría dar lugar tanto a futuras complicaciones en el postoperatorio como a la consecución de unos peores resultados (3).
• Los bordes de la membrana deben sobrecontornear el defecto por lo menos 3 mm y ser redondeados para que no queden afilados o puntiagudos.
• Es muy importante que la membrana asegure un tejido estable, suficientemente grueso y bien vascularizado, que pueda ser suturado sin tensión, que recubra totalmente la membrana.
• La membrana debe crear un espacio adecuado para la regeneración ósea. Cuando el defecto aporta suficiente soporte a la membrana, como en defectos circunferenciales o de 3 paredes, es fácil que la membrana mantenga este espacio. Las membranas reabsorbibles suelen colapsarse si no poseen soporte óseo adecuado.
• La manipulación del colgajo debe ser conservadora para no dañarlo y no comprometer así su vascularización.
• En el momento de la inserción del material es muy importante asegurarse de una buena adaptación de la membrana al hueso circundante y evitar superposiciones o dobleces del material.
Procedimiento quirúrgico
Las membranas de colágeno pueden dar lugar a reacciones de hipersensibilidad en los pacientes por lo que antes de iniciar el tratamiento es necesario realizar pruebas que nos permitan comprobar la existencia o no de alergias al material.
Para esto, se utiliza el test ELISA. Se extraen 10 cc de sangre del paciente y se hace el test de 7 a 10 días antes del tratamiento y posteriormente, tras la intervención entre 18 y 21 días después y a las 8 semanas. Estas muestras se mandan al laboratorio para analizar la respuesta de los anticuerpos a la membrana colágena bovina, albúmina sérica humana y microfibrillas colágenas (9).
Tras una correcta anestesia, se realiza una incisión marginal o sulcular por vestibular y por lingual de los maxilares para después hacer incisiones de descarga verticales que abarquen como mínimo un diente por delante y por detrás del diente que está siendo tratado. Durante esta fase hay que tener cuidado para el mantenimiento de la papila (10).
Se levanta un colgajo mucoperióstico de espesor total para exponer el defecto.
Se extirpa todo el epitelio de la bolsa de manera que quede tejido conectivo en los colgajos.
A continuación, se elimina todo el tejido de granulación y se realiza el desbridamiento exhaustivo de las superficies radiculares denudadas con curetas e instrumentos rotatorios.
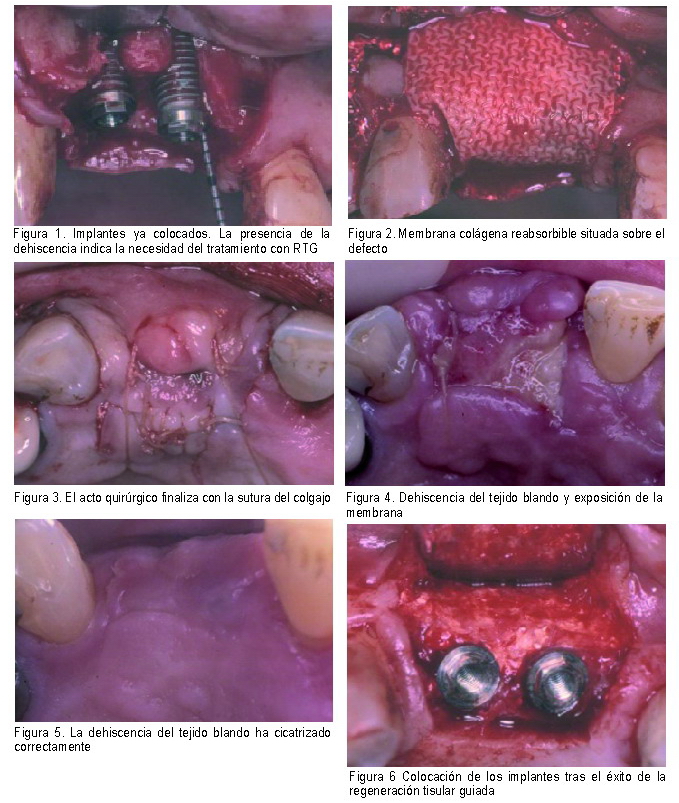 |
Para la adaptación de la membrana primero hay que humedecerla en suero salino estéril para posteriormente seleccionar la configuración más adecuada de manera que cubra todo el defecto y si es necesario, recortarla (9). Se debe adaptar perfectamente al diente, extendiéndose 3 mm más allá de los márgenes del defecto sobre el hueso adyacente para asegurar la estabilidad del material y proteger el coágulo durante la cicatrización.
Posteriormente fijaremos la membrana al diente mediante sutura reabsorbible de tipo cabestrillo y procederemos al reposicionamiento coronal de los colgajos pudiendo hacer una incisión vertical de descarga en el periostio para ayudar al desplazamiento coronario del colgajo, teniendo cuidado de no comprometer su irrigación.
Debemos cerrar primero el espacio interproximal cercano a la barrera mediante una sutura de tipo colchonero y posteriormente continuamos suturando el resto de la herida.
Es muy importante la selección del tipo de sutura. Las primeras semanas tras la cirugía, el periodonto no tiene suficiente capacidad funcional como para resistir las fuerzas tensionales que sobre él se aplican por lo que la integridad de la herida los primeros días depende únicamente de la estabilización del colgajo mediante las suturas (5).
El paciente debe mantener una buena higiene, cepillándose la zona con un cepillo de cerdas suaves y enjuagándose con clorhexidina (0,2%) durante un tiempo entre 4 y 6 semanas (10). También se debe seguir una terapia antibiótica, analgésica, antiinflamatoria y revisiones periódicas para profilaxis y así evitar al máximo la acumulación de placa (3).
En el tratamiento regenerador, uno de los puntos más importantes es la exposición de la membrana que podría dar lugar al fracaso del tratamiento. Por esto, se debe prestar suma importancia al procedimiento quirúrgico para poder así lograr un completo recubrimiento de la membrana y que permanezca así durante el periodo completo de cicatrización para evitar el mayor número posible de exposiciones.
Este tipo de procedimiento quirúrgico descrito anteriormente tiene como objetivo conseguir este completo recubrimiento y además aliviar la tensión del colgajo, si esto no fuese así, ésta daría lugar a una exposición de la membrana (11).
Se ha identificado diferentes factores que pueden influir en la exposición prematura de la membrana, entre ellos están los fallos cometidos a la hora de hacer las incisiones de descarga y el levantamiento del colgajo, de manera que impidan una buena movilidad de éste o el levantamiento del colgajo antes de que la membrana este correctamente fijada, asegurándonos de que no hay fibras de tejido o periostio que estén interfiriendo con el extremo apical de la membrana (12).
También podría dar lugar a futuros problemas mucogingivales debido a que la cantidad de encía queratinizada suele ser insuficiente para proporcionar el suficiente tejido queratinizado alrededor del implante, que permitirá al paciente mantener una buena higiene (11).
Materiales y método
Los artículos utilizados para realizar este trabajo fueron obtenidos de la base de datos MEDLINE, de la colección de artículos de Blackwell Synergy, aunque debido a la dificultad de conseguir los artículos por Internet debido a su relevancia, la mayor parte se sacaron de la biblioteca de la Universidad Complutense de Madrid.
Muchos de los artículos corresponden a estudios o casos clínicos realizados en los últimos años, salvo aquellos que debido a su importancia son de mayor antigüedad.
Discusión
Las membranas utilizadas para el desarrollo de la RTG, no fueron producidas inicialmente para su uso en medicina, sino que se escogieron por su porosidad, que permitía el paso de líquidos y nutrientes pero no de células y también podían ser esterilizadas (13).
Para el tratamiento de los defectos óseos en implantes, ya sea dehiscencias o fenestraciones, podemos emplear membranas reabsorbibles o no reabsorbibles.
Las membranas reabsorbibles se empezaron a utilizar debido a la necesidad de un tipo de membranas que permitiese obtener unos resultados similares o incluso mejores a las no reabsorbibles pero sin tener que realizar una segunda intervención quirúrgica para extraer la membrana ya que esto supone una nueva experiencia traumática para el paciente y podríamos causar daños en los tejidos regenerados.
Gottlow hizo estudios para compararlas. Con ambas se obtiene un aumento significativo en la cantidad de hueso e inserción pero la exposición y la inflamación es mayor cuando se usan las membranas no reabsorbibles. Esta mayor inflamación junto con el trauma causado por remoción de la membrana podría hacer que la ganancia de inserción sea menor y que la migración del epitelio apicalmente sea mayor (13).
Estudios posteriores han demostrado que la utilización de cualquiera de estos dos tipos de membrana nos permite obtener unos resultados positivos en cuanto al aumento de inserción y reducción en la profundidad de sondaje sin que existan diferencias significativas entre ellas y que las membranas reabsorbibles clínicamente cumplen todos los requisitos que debe tener una membrana para su uso en RTG (14, 15).
Dupoirieux y cols., por el contrario, observaron que con las membranas no reabsorbibles se obtenía una regeneración ósea en la mayor parte de los casos mientras que con las reabsorbibles esta era parcial o inexistente (16).
Las membranas deben ser biocompatibles, no tóxicas, no antigénicas, e inducir la mínima respuesta inflamatoria posible hacia el tejido injertado (13).
Al mismo tiempo debe adaptarse al fin para el que está destinada. Si se va a utilizar para el aumento de tejido óseo, debe permanecer estable en su posición para poder guiar al nuevo tejido, y que se integre en los tejidos periodontales para reducir al máximo las posibilidades de recensión gingival que daría lugar a un aumento de las probabilidades de que haya una exposición de la membrana (13).
Estas características también permitirían mantener una buena estética después de la curación de la herida.
Este tipo de membranas son suficientemente rígidas como para proporcionar el espacio necesario para la formación del ligamento y hueso, y al mismo tiempo son también flexibles como para permitir una fácil manipulación y colocación (15).
Los buenos resultados obtenidos con las membranas reabsorbibles en los tratamientos de RTG se deben sobre todo a que muestran una buena biocompatibilidad y a que la respuesta de los tejidos periodontales es la deseada con ausencia de complicaciones en la mayor parte de los casos.
Además, clínicamente son fáciles de adaptar, de fijar al diente y suficientemente capaces de mantener el espacio cuando existe suficiente soporte de las paredes óseas y la superficie radicular adyacentes que evitan el colapso de la membrana y que esta mantenga así su configuración (14).
El problema de las membranas reabsorbibles es que si no tienen el suficiente soporte, si la morfología del defecto no es la adecuada, no son capaces de mantener ese espacio con el consiguiente colapso y fracaso del tratamiento (17).
La ganancia de inserción conseguida con los tratamientos regeneradores se mantiene en el tiempo durante 6-7 años en la mayor parte de los casos según los estudios de Stavropoulos, coincidiendo con los estudios realizados años antes por Gottlow y cols. en los que afirmaban que se mantenían por lo menos 5 años tras el tratamiento (18).
La frecuencia de los controles dentales, el tabaco, la higiene oral y la presencia de sangrado al sondaje no están relacionados con el mantenimiento a largo plazo de los niveles de inserción (19).
Dentro de las membranas reabsorbibles existen varios tipos con diferentes composiciones y características. Pueden ser de colágeno, de copolímeros degradables como son el ácido poliláctico y el ácido poliglicólico y de poliuretano.
Se escogió el colágeno como material para confeccionar las membranas debido a que es la mayor macromolécula extracelular del tejido conectivo periodontal y es fisiológicamente metabolizado por las células presentes en estos tejidos (10), se ha demostrado que quimiotáctico para los fibroblastos, que es una propiedad que favorece la migración de las células del ligamento periodontal al espacio formado entre la membrana y la superficie radicular del diente (20). También se caracteriza por favorecer la hemostasia mediante la formación de un coágulo estable (1), actúa como sustrato para la adhesión, migración, proliferación y orientación de las células del LPO (6).
Las membranas de colágeno pueden tener diferentes orígenes. Pueden ser de origen bovino o porcino, de dermis o de tendón.
La utilización de colágeno bovino de tipo I como membrana es bien tolerado con una suave respuesta inflamatoria y sin causar retrasos en la curación (9-21). Permite obtener una reducción de la profundidad de sondaje, ganancia de inserción y reducción del defecto óseo.
Al mismo tiempo, se adapta bien a la superficie interproximal de las raíces y al defecto. Por lo tanto este material parece ser eficaz en este tipo de tratamientos (9).
Se reabsorben en un periodo de unas 4 semanas (21).
Los estudios indican que las membranas colágenas son capaces de modificar el tipo de curación de los tejidos. Cuando interponemos una membrana entre la superficie de la raíz y la mucosa, la curación se basa principalmente en la formación de nuevo cemento, hueso y ligamento periodontal, mientras que si no se coloca la membrana, se forma un epitelio largo de unión considerado como un fracaso dentro del proceso de regeneración tisular (20).
Además, Pitaru y cols. con sus estudios, certificaron que las membranas de colágeno son capaces de evitar la migración apical del epitelio y al mismo tiempo de permitir la formación de nuevo tejido conectivo.
La presencia de epitelio largo de unión en la parte más coronal del defecto puede explicarse en base a las siguientes causas:
— La membrana había desaparecido a los 10 días de su colocación.
— La aparición de una cuña de epitelio entre la lámina propia de la encía y la porción más coronal de la membrana.
— La presencia de una cuña similar de epitelio observada a los 30 días.
— Esta cuña epitelial se extiende coronalmente desde el epitelio de unión en el tejido conectivo.
Esto sugiere que la porción más coronal de la membrana sería degradada en las etapas más tempranas de la curación mediante enzimas salivares, traumas mecánicos o colagenasa secretada por las células salivares, células polimorfonucleares y mononucleares durante la fase inflamatoria de la curación.
La degradación coronal de la membrana permite el contacto de las células epiteliales con la superficie radicular expuesta que posteriormente será colonizada dando lugar al epitelio largo de unión. Esto explica que uno de los puntos débiles de las membranas de colágeno sea su rápida degradación.
Por otro lado el espacio entre la porción apical del epitelio y la cresta alveolar fue colonizado por células de tejido conectivo (20-22).
Histológicamente se ha visto que las membranas colágenas (Bio-Gide) presentan signos de reabsorción a las 6 semanas de su colocación, aunque el tiempo varía dependiendo del origen del colágeno (23).
Las membranas no reabsorbibles necesitan permanecer colocadas durante un periodo entre 4 y 6 semanas antes de ser removidas, así que es lógico preguntarse cómo puede una membrana reabsorbible favorecer la regeneración a pesar de su rápida reabsorción.
La proliferación del epitelio tiene lugar a las 24 horas de la implantación de la membrana y continúa avanzando de 3 a 5 días después. Por otro lado, el tejido conectivo fibroso e inmaduro presente los primeros días, entre el séptimo y decimocuarto día ya ha madurado (24).
Estudios han demostrado que una vez que el epitelio ha madurado, la integridad de la membrana no es esencial para que el proceso regenerativo se lleve a cabo, ya que lo más importante es que permanezcan intactas en las primeras fases de la curación, cuando el epitelio migra sobre la superficie radicular del diente (25).
En un intento por mejorar las membranas colágenas disponibles, se empezaron a desarrollar técnicas que gracias a un determinado tratamiento de la membrana, conseguían una mejora en sus propiedades.
Los tratamientos más utilizados son con glutaraldehído, formaldehído, difenilfosforilación y hexametilendisocianato.
Estos sistemas proporcionan a la membrana una mayor resistencia frente a la degradación enzimática por colagenasas y así poder mantener su integridad estructural durante más tiempo, hasta que el coágulo formado bajo la membrana alcance un grado adecuado de maduración (26). La tasa de reabsorción de las membranas varía según el grado de entrecruzamiento de los materiales que la componen.
Aquellas membranas colágenas tratadas con glutaraldehído presentan una densa y entrelazada red de fibras colágenas lo que le da a la superficie del material una estructura desigual con poros de diferentes tamaños y el extremo cerrado. Los estudios in vitro a los 5 y 7 días muestran un crecimiento satisfactorio de fibroblastos sobre la superficie de la membrana. Al mismo tiempo se ha visto que el proceso de reabsorción es lento, de unas 8 semanas (27).
El tratamiento con glutaraldehído produce un bloqueo en los grupos amino del colágeno y al mismo tiempo consigue un entrecruzamiento entre las cadenas de péptidos. Sin embargo, con esta técnica, una pequeña parte del material que causa el entrecruzamiento queda depositado en la proteína, lo que hace que el material sea un poco citotóxico (28).
No se han observado reacciones desfavorables tras la colocación de la membrana en los pacientes (6).
Se han hecho estudios comparativos de membranas tratadas con los procedimientos de relación cruzada. Las membranas BioGide®, Ossix® y TutoDent®, presentaron unos índices similares respecto a la adhesión y proliferación de fibroblastos y osteoblastos. Por el contrario la membrana BioMend® pareció ser incompatible con la unión y proliferación celular ya que no se observó la presencia de células.
Estos resultados indican que las membranas interfieren en la proliferación y adhesión de las células, las superficies rugosas o texturas porosas favorecen la unión de las células (39).
Para aumentar la biocompatibilidad de estos materiales y evitar la citotoxicidad del tratamiento con glutaraldehído, se han desarrollado otro tipo de membranas.
Son las membranas colágenas tratadas mediante difenilfosforilación. Son membranas suficientemente rígidas para mantener el espacio adecuado para las células encargadas de la formación del ligamento periodontal y del hueso, pero al mismo tiempo también son flexibles para permitir un buen manejo y adaptación al defecto.
Su uso para el tratamiento de defectos óseos de tres paredes ha demostrado que son un buen material ya que proporcionan unas ganancias significativas en cuanto a la reducción de la profundidad de sondaje y ganancia de inserción (15).
Los estudios han demostrado que este tipo de membranas causan una mínima reacción inflamatoria circunscrita que no se extiende al tejido conjuntivo adyacente. A pesar de que el periodo de reabsorción de las membranas utilizadas en estos estudios fue de entre 15 y 30 días, los resultados indican que éste no influyó negativamente ya que los defectos periodontales fueron completamente cerrados por nuevo hueso (26).
La membrana Paroguide® es un ejemplo de membrana tratada con DPPA. Estudios han obtenido buenos resultados con esta membrana (29).
Se observó un decrecimiento en la profundidad de sondaje, un incremento en la ganancia de inserción, ausencia de recesión gingival y ausencia de signos de inflamación, lo que indica que es biocompatible. El periodo de degradación de la membrana es de unos 5 meses.
Esta membrana de lenta reabsorción, también ha demostrado su capacidad de aislar las células con potencial regenerador del medio oral en caso de exposición accidental por la pérdida de las suturas de los márgenes del colgajo (3).
Su exposición no influye negativamente en los resultados y tampoco da lugar a una pérdida de tejidos queratinizados.
El hexametilendisocianato es otro método de entrecruzamiento del colágeno. El mayor grado de HMDIC produce una persistencia de la inflamación con el consecuente retraso en el crecimiento de las fibras colágenas y al mismo tiempo causa una menor absorción del colágeno. La cantidad de colágeno residual también está relacionada con el grado de maduración del tejido conectivo (24).
Las membranas de ácido poliláctico o de poliuretano, son otras opciones disponibles en el mercado.
En estudios realizados se vio que la cantidad de inserción conseguida con estos tipos de membrana, era similar a la conseguida con ausencia de estas. También se observó que las de poliuretano causan una mayor inflamación de los tejidos que las de ácido poliláctico y que ambas producían recesiones en los márgenes del colgajo (31).
Estudios posteriores indican que los defectos protegidos con este tipo de membranas consiguen una regeneración sustancial de hueso. La reacción inflamatoria y la reacción frente a cuerpos extraños son leves, lo que permite una curación sin complicaciones.
Otro dato a tener en cuenta es que a pesar de que con este tipo de membranas se consiguió mayor cantidad de hueso que con el uso de membranas colágenas, estas mostraron una mayor cantidad de tejidos blandos regenerados a pesar de las distintas porosidades de las membranas de ácido poliláctico estudiadas (32).
La degradación de estas barreras tiene lugar por hidrólisis, proceso que requiere de 30 a 60 días dependiendo de la polimerización del material. El Resolut® es un copolímero de PGA y PLA. Se ha comprobado que es absorbido de una manera segura por el organismo, que es antigénico14 y que se degrada entre 4 y 8 meses causando una mínima reacción tisular (33).
Una proporción bastante alta de membranas sufren una exposición al medio bucal a tras su colocación subgingival.
Esta exposición supone un riesgo ya que puede producirse una infección bacteriana debido a la adherencia de estas a la superficie de la membrana.
Si comparamos la frecuencia de exposición entre los distintos tipos de membranas, las membranas reabsorbibles presentan un mayor índice de exposiciones respecto a las no reabsorbibles. En otros estudios los resultados mostraron que eran las no reabsorbibles las que más se exponían (32). Sin embargo entre las de colágeno y ácido poliláctico no hay diferencias significativas.
Los estudios de Ehmke y cols., sin embargo, muestran que las membranas de PLA son menos susceptibles a la adhesión bacteriana que las de ePTFE. (35).
La adherencia de bacterias es mayor en las membranas colágenas que en las de PLA o de ePTFE, pero todas ellas serán colonizadas tras su exposición al medio oral por bacterias Gram – (S. Mutans y S. Sanguis) y por Gram + (A. Actinomycetemcomitans, P. Intermedia, P. Gingivalis, T. Denticola y T. Vicentii).
En estudios se ha visto que no todas tienen la misma afinidad, siendo el A. Actinomycetemcomitans y A. Viscosus los que mayor predilección tienen por las membranas, mientras que la S. Sputigena fue detectada con mucha menor frecuencia.
La alta frecuencia con que estas bacterias se detectan sobre las membranas, podría dar lugar a pensar que es una de las causas que provoca el fracaso de la terapia regeneradora. Si el A. Viscosus tiene predilección por este tipo de materiales, estos podrían ser un mecanismo de entrada de las bacterias hacia la superficie radicular y la bolsa periodontal.
También hay que tener en cuenta que, en el caso de la exposición, la adherencia bacteriana podría dar lugar a un aumento en la velocidad de reabsorción y comprometer el tratamiento. La colonización de la membrana por bacterias productoras de enzimas proteolíticas podría causar una aceleración en la degradación y por lo tanto dar lugar a una pérdida de las propiedades oclusivas de la membrana (34).
La cantidad total de bacterias no influye en la reducción de la profundidad de sondaje ni en el grado de recesión pero sí en cuanto a los niveles de inserción.
Otros estudios han observado que en aquellos pacientes en los que se expone una membrana, se consigue una menor cantidad de inserción en comparación con los no expuestos, al mismo tiempo que el grado de recesión es significativamente mayor.
Confirmando los estudios anteriores, Ling y cols. comprobaron que la presencia de A. Actimomycetemcomitans está asociada con la menor ganancia de inserción (34).
Teniendo en cuenta estos datos, podemos afirmar que el recubrimiento gingival de la membrana es básico debido al riesgo de infecciones y el fracaso en la regeneración que podría ocasionar su colonización por bacterias orales.
Existen diversos factores que pueden influir en los resultados del tratamiento. Uno de estos factores es el tabaco ya que se ha observado que la frecuencia de exposiciones es mayor en este tipo de pacientes (35-36) y al mismo tiempo la ganancia de inserción también es mayor en los no fumadores.
Otros factores a tener en cuenta son la profundidad
 |
Bibliografía
1. Gottlow J, Nyman S, Lindhe J, Karring T, Wennström J. New attachment formation in the human periodontium by guided tissue regeneration. Case reports. J Clin Periodontol 1986: 13: 604-616.
2. Bowen Antolín A, Benet Iranzo F, Carmona Rodríguez J, Ortega López JJ, González de Vega y Pomar A. Técnicas quirúrgicas avanzadas para la regeneración ósea en implantología. Gaceta Dental 2002; 128: 36-60.
3. Romero Olid MN, Olmedo Gaya MV, Vallecillo Capilla M. La utilización de membranas en cirugía bucal. Ventajas e inconvenientes. Avances en Odontoestomatología. 1999; 15 (1):9-23.
4. Byung-Ho Choi. Periodontal ligament formation around titanium implants using cultured periodontal ligament cells: a pilot study. Int. J Oral Maxillofacial Impl. 2000; 15 (2): 193-196.
5. Polimeni G, Xiropaidis AV, Wikesjö UME. Biology and principles of periodontal wound healing/regeneration. Periodontology 2000 (2006); 41: 36-47.
6. Quteish D, Dolby A. The use of irradiated-crosslinked human collagen membrane in guided tissue regeneration. J Clin Periodontol 1992: 19: 476-484.
7. Machtei EE, Cho MI, Dunford R, Norderyd J, Zambon JJ, Genco RJ. Clinical, microbiological, and histological factors which influence the success of regenerative periodontal therapy. J Periodontol 1994; 65: 154-161.
8. Takata T, Wang H-L, amd Miyauchi M: Attachment, proliferation and differentiation of periodontal ligament cells on various guided tissue regeneration membranes. J Periodont Res 2001; 36: 322-327 © Munksgaard, 2001.
9. Mattson JS, Gallgher SJ, Jabro MH. The use of 2 bioabsorbable barrier membranes in the treatment of interproximal intrabony periodontal defects. J Periodontol 1999; 70: 510-517.
10. Lindhe J, Karring T, Lang N.P. Periodontología clínica e implantología odontológica. Ed. Médica Panamericana 2005 4ªEdición.
11. Novaes AB Jr, Novaes AB. Soft tissue management for primary closure in guided bone regeneration: surgical technique and case report. Int. J Oral Maxillofacial Impl. 1997; 12(1): 84-87.
12. Fugazzoto PA. Maintaining primary closure after guided bone regeneration procedures: introduction of a new flap design and preliminary results. J Periodontol 2006;77(8): 1452-1457.
13. Gottlow J. Guided tissue regeneration using bioresorbable and nonresorbable devices: Initial healing and long.term results. J Periodontol 1993; 64: 1157-1165.
14. Caffesse R, Mota L, Quinones C, Morrison EC. Clinical comparison of resorbable and non-resorbable barriers for guided tissue regeneration. J Clin Periodontol 1997: 24: 747-752.
15. Benque E, Zahedi S, Brocard D, Oscaby F, Justumus P, Brunel G. Guided tissue regeneration using a collagen membrane in chronic adult and rapidly progressive periodontitis patients in the treatment of 3-wall intrabony defects. J Clin Periodontol 1997: 24: 544-549.
16. L Dupoirieux, D Pourquier, MC Picot, M Neves : Comparative study of three different membranes for guided bone regeneration of rat cranial defects. Int JOral Maxillofac. Surg 2001; 30: 58-62 © International Association of Oral and Maxillofacial Surgeons.
17. Christoph H. Hammerle & Ronald E. Jung. Bone augmentation by means of barrier membranas. Periodontology 2000, Vol. 33, 2003, 36-53.
18. Gottlow, J, Nyman, S & Karring, T. Maintenance of new attachment gained through guided tissue regeneration. Journal of Clinical Periodontology 1992; 19, 315-317.
19. Stavropoulos A, Karring T. Long-term stability of periodontal conditions achieved following guided tissue regeneration with bioresorbable membranes: case series results after 6-7 years. J Clin Periodontol 2004; 31: 939-944. Blackwell Munksgaard, 2004
20. Pitaru S, Tal H, Soldinger M, Grosskopf A & Noff M. (1988) Partial regeneration of periodontal tissues using collagen barriers. Initial observations in the canine. Journal of Periodontology 59: 380-386.
21. Hyde PR, Dowell P, Sigh G, & Dolby AE. (1992) Freeze-dried, cross -linked bovine type I collagen: analysis of properties. J Periodontol 63:182-186.
22. Pitaru S, Tal H, Soldinger M, Noff M. Collagen membranes prevent apical migration of epithelium and support new connective tissue attachment during periodontal wound healing in dogs. J Periodont Res 1989; 24: 247-253.
23. Von Arx T., Broggini N., Storgard J., Bornstein M., Schenk R., Buser D. Membrane durability and tissue response of different bioresorbable barrier membranes: A histologic study in the rabbit calvarium. Int J Oral Maxillofac Implants 2005;20:843-853.
24. Minabe M, Kodama T, Kogou T, Tamura T, Hori T, Watanabe Y & Miyata T. (1989) Different cross-linked types of collagen implanted in rat palatal gingiva. Journal of Periodontology 60: 35-43.
25. Bunyaratavej P & Wamg HL. (2001) Collagen membranes: a review. J Periodontol. 72:215-229.
26. Zahedi S, Legrand R, Brunel G, et al. Evaluation of a diphenylphospforylazide-crosslinked collagen membrane for guided bone regeneration in mandibular defects in rats. J Periodontol 1998; 69: 1238-1246.
27. Quteish D, Singrao S and Dolby AE: Light and electron microscopic evaluation of biocompatibility, resorption and penetration characteristics of human collagen graft material. J Clin Periodontol 1991; 18: 305-311.
28. Brunel G, Piantoni P, Elharar F, Benqué E, Marin P, Zhadi S. Regeneration of rat calvarian defects using a bioabsorbable membrana technique: influence of collagen cross-linking. J Periodontol 1996;67:1342-1348.
29. Parodi R, Carusi G, Santarelli G, Nanni F, Pingitore R, Brunel G. Guided tissue regeneration employing a collagen membrane in a human periodontal bone defect: A histologic evaluation. Int J Periodontics Restorative Dent 1997;17: 283-291.
30. Santarelli G, Parodi R & Carusi G (1996) The use of a slowly resorbable collagen barrier in the regeneration of bone in deep wide defects: a case report. Int J of Periodontics and Restorative Dent. 16, 69-77
31. Warrer K, Karring T, Nyman S, Gogolewsky S: Guided tissue regeneration using biodegradable membranes of polylactic acid or polyurethane. J Clin Periodontol 1992; 19: 633-640.
32. Stavropoulos F, Dahlin C , Ruskin JD, Johansson C. A comparative study of Barrier membranes as graft protectors in the treatment of localized bone defects. An experimental study in canine model. Clin. Oral Impl. Res. 15, 2004; 435-442.
33. Garza M, Cepeda JA. Regeneración ósea guiada de cara al año 2000. Consideraciones clínicas y biológicas. Revista ADM. 2000; 4: 147-153.
34. Chen Y, Wang H, Lopatin D, O»neal R, MacNeil R. Bacterial adherence to guided tissue regeneration barrier membranes exposed to the oral environment. J Periodontol 1997; 68: 172-179.
35. Ehmke B, Ru¨diger SG, Hommens A, Karch H and Flemmig FD. Guided tissue regeneration using a polylactic acid barrier. Part II: Predictors influencing treatment outcome. J Clin Periodontol 2003; 30: 368-374. Blackwell Munksgaard, 2003
36. Ling L-J, Hung S-L, Lee C-F, Chen Y-T, Wu K-M. The influence of membrane exposure on the outcomes of guided tissue regeneration: clinical and microbiological aspects. J Periodont Res 2003; 38; 57-63. Blackwell Munksgaard, 2003
37. Al-Arrayed F, Adam S, Moran J, Dowell P. Clinical trial of cross-linked human type I collagen as a barrier material in surgical periodontal treatment. J Clin Periodontol 1995: 22: 371-379.
38. Moses O, Pitaru S, Artzi Z, Nemcovsky CE. Healin of dehiscence-type defects in implants placed together with different barrier membranas: a comparative clinical study. Clin Oral Impl. Res. 16, 2005; 210-219.
39. Rothamel D, Schawrz F, Sager M, Herten M, Becker J. Biodegradation of differently cross-linked collagen membranes: an experimental study in th rat. Clin. Oral Impl. Res 16, 2005; 369-378.
40. Cortellini, P. & Tonetti, M. S. (2000) Focus onintrabony defects: guided tissue regeneration. Periodontology 2000 22, 104-132.
41. Quteish D, Dolbi AE: Inmune responses to implanted human collagen graft in rats. J Periodont Res 1991; 26:114-121
42. Parlar A, Bosshardt DD, Ünsal B, Çetiner D, Haytaç C, Lang NP. New formation of periodontal tissues around titanium implants in a novel dentin chamber model. Clin. Oral Impl. Res. 16, 2005; 259-267
43. Fiedmann A, Strietzel f.P., Maretzki B, Pitaru S, Bernimoulin JP. Observation on a new collagen barrier membrane in 16 consecutively treated patiens. Clinical and Histological findings. J Periodontol 2001; 72 (11): 1616-1623
44. Mattout P, Mattout C. Condition for success in guided bone regeneration: retrospective study on 376 implant sites. J Periodontol 2000; 71(12): 1904-1909.
45. Avera SP, Stampley WA, McAllister BS. Histologic and clinical observations of resorbable and nonresorbable barrier membranes used in maxillary sinus graft containment. Int. J Oral Maxillofacial Impl. 1997;12 (1): 88-94
46. Rosen PS, Reynolds MA. Guided bone regeneration for dehiscence and fenestration defects on implants using an absorbable polymer barrier. J Periodontol 2001; 72(2): 250-255.
47. Nemcovsky CE, Artzi Z., Moses O, Gelernter I. Heallin of dehiscence defects at delayed-inmediate implant sites Primarily closed by a rotated palatal flap following extraction. Int. J Oral Maxillofacial Impl. 2000; 15(4): 550-557.
48. Rothamel D, Schwarz F, Sculean A, Herten M, Scherbaum W, Becker J. Biocompatibility of various collagen membranes in cultures of human PDL fibroblasts and human osteoblast-like cells. Clin. Oral Impl. Res. 15, 2004; 443-449.



