Médico Adjunto. Servicio de Cirugía Oral y Maxilofacial (Jefe de Servicio: Dr. A Berguer). Hospital Clínico San Carlos
Dr. Jorge Giner Díaz Médico Residente. Servicio de Cirugía Oral y Maxilofacial. Hospital Clínico San Carlos
Madrid
Introducción
Los grandes defectos maxilares, resultantes por lo general de traumatismos o de grandes resecciones oncológicas, pueden dar lugar a alteraciones cosméticas y funcionales severas. La reconstrucción de los mismos supone un importante reto en el que el cirujano oral y maxilofacial tiene la responsabilidad de atender a ambos factores preservando la calidad de vida y restaurando una correcta función masticatoria, fonatoria y estética 1,2.
A priori, los grandes defectos óseos en el maxilar superior e inferior pueden ser reconstruidos de diversas maneras: membranas o mallas (ligadas al concepto de regeneración ósea guiada), materiales de relleno propiamente dicho, ya sean materiales sintéticos inorgánicos (miniplacas de reconstrucción de titanio), orgánicos no óseos o hueso (autólogo, homólogo o heterólogo), e injertos 3,4.
Con el perfeccionamiento de las técnicas de microcirugía, la transferencia de tejido óseo vascularizado del propio paciente se ha convertido en los últimos años en un procedimiento fiable y el de elección en la reconstrucción de grandes defectos en el territorio maxilofacial. El hueso peroné, la escápula o la cresta ilíaca son, por distintos motivos, las regiones más comúnmente empleadas como áreas donantes. Además, estos huesos al estar vascularizados permiten de manera fiable tratamientos complementarios como la radioterapia y quimioterapia e incluso pueden soportar implantes dentales osteointegrados que permitan una adecuada rehabilitación dental 3,4.
El objetivo del presente artículo es presentar un caso de reconstrucción compleja de un defecto mandibular extenso tras cirugía oncológica en un paciente joven. Se emplea un autoinjerto libre microvascularizado de peroné y se realiza una rehabilitación oral posterior mediante la colocación de implantes dentales y una prótesis dentaria removible implantomucosoportada.
Caso clínico
Paciente varón de 26 años de edad visto por urgencias en nuestras consultas de cirugía oral y maxilofacial refiriendo inflamación mandibular hacía 1 semana y dolor, que no había cedido al tratamiento antibiótico instaurado por su odontólogo. A la exploración se objetivaba una masa que afectaba al hueso mandibular en su lado derecho y que protuía externamente, dando la impresión de un flemón de origen dentario (Figura 1).
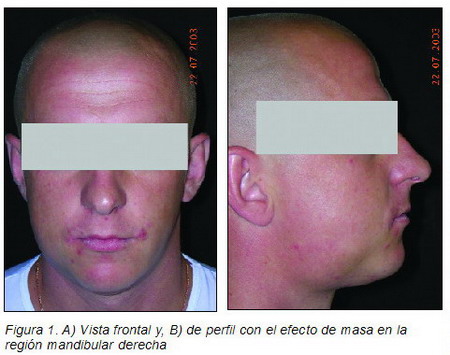 |
No había salida de pus, aunque a la palpación su consistencia era elástica y dolorosa. La prueba de imagen inicial consistió en una ortopantomografía (OPG) donde se evidenció una gran lesión que afectaba a gran parte de la mandíbula desde el cóndilo derecho hasta la región del segundo premolar inferior derecho; la imagen era de una lesión osteolítica con múltiples septos y tabiques, estando en relación con la pieza 47 (Figura 2).
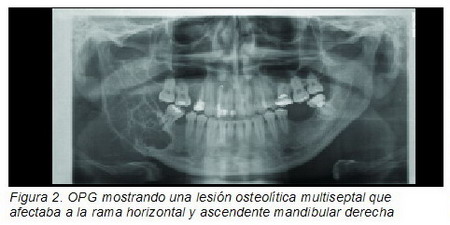 |
Posteriormente, se solicitó una TC que mostró el carácter agresivo de la lesión destruyendo ambas corticales mandibulares aunque sin afectar a las partes blandas (Figura 3).
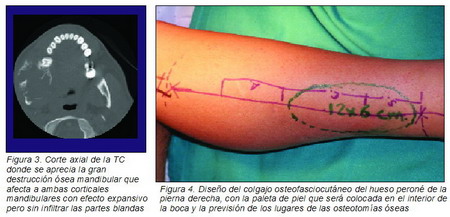 |
Con el diagnóstico de sospecha de ameloblastoma mandibular se tomó una biopsia, que fue informada como posible mixoma mandibular.
Con dicho diagnóstico se llevó a cabo una cirugía bajo anestesia general e intubación nasotraqueal, realizando una cervicotomía media derecha para abordar los vasos cervicales y la lesión, con una resección de la lesión incluyendo parte de los tejidos blandos por vía intra y extraoral. La resección incluyó la mandíbula desde distal al incisivo lateral inferior derecho hasta el cóndilo mandibular derecho incluido, conservando el disco articular. En la misma intervención un segundo equipo quirúrgico se encargó de obtener un autoinjerto osteoseptocutáneo del hueso peroné de la pierna derecha (Figura 4), el cual fue modelado en la misma pierna mediante dos osteotomías, tomando como modelo una placa de titanio conformada a tal efecto manteniendo la oclusión dental con tornillos de fijación intermaxilar (FIM). Una vez modelado se fijó mediante osteosíntesis de titanio con miniplacas y tornillos monocorticales. Posteriormente, se preparó el lecho quirúrgico y se traspuso el peroné a la mandíbula estabilizándolo con miniplacas de titanio. Inmediatamente después se llevó a cabo la microsutura de los vasos donantes y receptores con monofilamento de 8/0 (Ethilon 8/0, Ethicon) empleando el microscopio quirúrgico. Se suturó la arteria peronea a la arteria facial derecha y la vena peronea al tronco venoso tirolinguofacial, ambas con una técnica término-terminal (Figura 5).
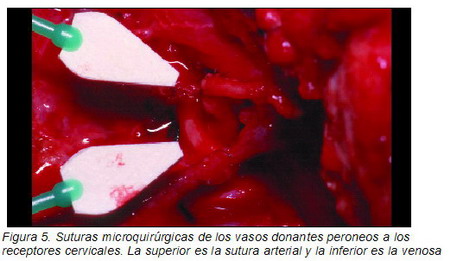 |
La paleta de piel fue colocada hacia la zona intraoral para cerrar el defecto de la resección, suturándolo con seda 2/0. También se colocó una mini ancla de titanio (Mitek mini-anchor, Ethicon) a la parte más superior y posterior del peroné fijando más tarde con una sutura no-reabsorbible el disco articular de la articulación temporomandibular (ATM) derecha (Figura 6).
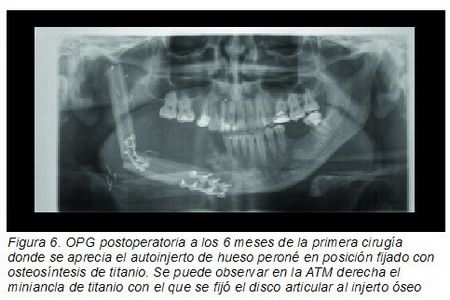 |
Para ello, se abordó la articulación a través de una incisión preauricular de Al-Kajat. Se instauró un protocolo de anticoagulación y se derivó a la UCI.
La evolución fue satisfactoria y en los sucesivos controles clínicos y radiológicos no se evidenció recidiva de la lesión. El análisis histopatológico fue de mixoma mandibular gigante. La apertura oral era de 40 mm sin laterodesviación hacia el lado intervenido. Dieciocho meses después y viendo la sorprendente remodelación y adaptación del peroné a su nueva función mandibular (Figura 7), se decidió colocar implantes dentales, lo cual se hizo mediante anestesia general, insertando 4 implantes dentales MG-Osseous (Mozo Grau, S.L.)
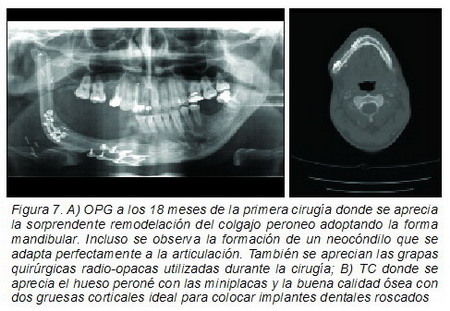 |
autorroscantes de titanio puro con superficie tratada RBM con hexágono externo de 4,25 x 11,5 mm los tres distales colocados bicorticales en el peroné y uno de 4,25 x 13 mm el proximal en el muñón mandibular, todos con una plataforma de 4,1 mm (Figuras 8 a 11).
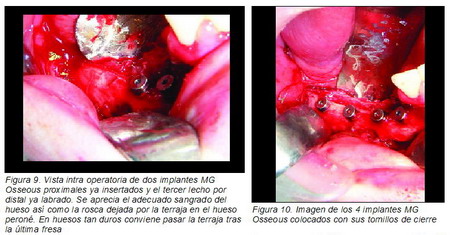 |
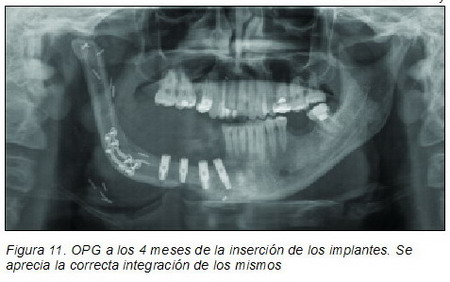 |
La técnica de fresado debe ser meticulosa, empleando fresas nuevas con abundante irrigación externa con suero frío, debido a la gran dureza y a la bicorticalidad que tiene el peroné. Empleamos fresa de bola para marcaje, fresa piloto lanceolada para iniciado y fresas de 2 mm de 3 mm, de 3,3 mm y 3,8 mm a 900 r.p.m. y antes de la inserción pasamos una terraja con llave carraca; la inserción del implante con irrigación se hace a 15 r.p.m. y 45 Nw de torque. También se aprovechó la misma intervención para retirar algunas miniplacas y tornillos y para desepitelizar y desgrasar la isla de piel cutánea peronea que estaba colocada en la boca. Seis meses después y bajo anestesia local se realizó la segunda fase quirúrgica de los implantes colocando los 4 tornillos de cicatrización (Mozo Grau, S.L.) de 6 mm de longitud tras comprobar la correcta integración de los mismos (Figuras 12 y 13).
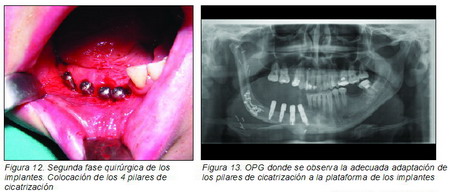 |
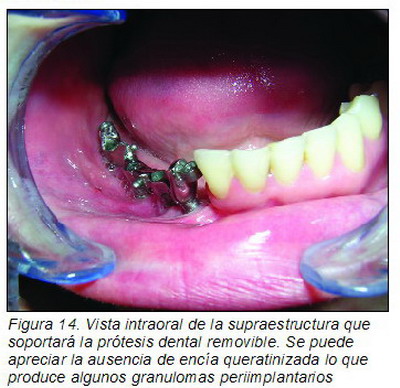
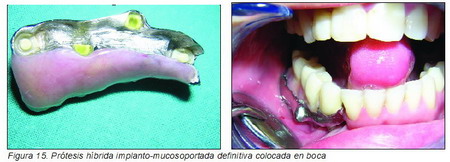
A los 21 días se cambiaron por los postes de impresión y se tomaron modelos para fabricar la prótesis dental. Se decidió que la mejor opción sería una prótesis removible implanto-mucosoportada sobre una supraestructura en una pieza de titanio (Figuras 14 a 16).
 |
 |
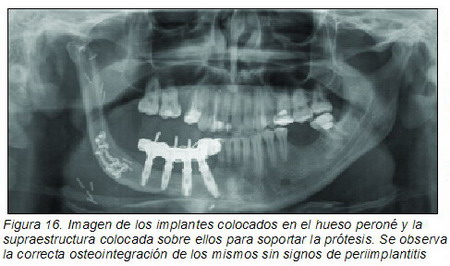 |
La prótesis se fija mediante atachés (Figura 14), tiene un correcto funcionamiento y tan sólo se han detectado algunos granulomas en la unión de los implantes a la supraestructura debido a la falta de encía queratinizada, aunque no se ha observado reabsorción ósea ni signos de periimplantitis. El paciente actualmente se encuentra libre de enfermedad (Figura 17).
 |
Discusión
A la hora de abordar la reconstrucción de grandes defectos maxilares o mandibulares, ya sean secundarios a traumatismos, neoplasias malignas, tumores odontogénicos agresivos, etc., el aporte de hueso autólogo va a representar por lo general, y salvo contraindicación, la mejor alternativa 1-4.
El principal inconveniente de utilizar hueso libre, no vascularizado, en estos casos es la elevada tasa de complicaciones que presentan, sobre todo si es necesario administrar RT o QT posterior: infecciones, exposiciones del injerto, movilidad del mismo, reabsorción, etc. Además, se va a ver incrementada la duración del proceso reparativo óseo pues el injerto actúa en realidad como osteoconductor reabsorbiéndose de manera impredecible a medida que va creciendo nuevo hueso. Por el contrario, el hueso vascularizado puede cicatrizar de forma primaria mediante osteogénesis, ya que se mantiene el aporte sanguíneo a los osteoblastos del injerto 2,4. Así, mientras que el hueso libre, no vascularizado, puede perder hasta la mitad de su volumen, en los injertos vascularizados, la reabsorción va a ser mucho menor 5. Incluso estos injertos vascularizados poseen la capacidad de remodelarse y adaptarse al nuevo lugar y a la nueva función que van a desempeñar, tal y como se constata en el presente caso (Figuras 6 y 7); eso nunca ocurriría en un injerto óseo libre 6.
Por otro lado, en el momento de plantear la reconstrucción de un defecto extenso en el territorio maxilofacial, el cirujano siempre debe valorar e intentar satisfacer los siguientes objetivos:
1. Obliteración del defecto.
2. Restauración de la función, fundamentalmente fonatoria y masticatoria.
3. Garantizar el soporte de las estructuras faciales, tanto a nivel estético como funcional.
Por ello no hay que olvidar que estos grandes defectos suelen requerir un aporte tanto de hueso como de tejidos blandos para una correcta reconstrucción tridimensional y rehabilitación funcional. Además, y concretamente en la boca, necesitamos aislar la cavidad oral del cuello para evitar fístulas. Los colgajos libres osteofasciocutáneos tienen la ventaja de permitir este doble aporte en un solo tiempo quirúrgico y realizar reconstrucciones primarias (reconstruir en la misma intervención que se reseca). Los avances producidos en los últimos años en el campo de la microcirugía han ido incrementando progresivamente la predictibilidad de los resultados en el empleo de este tipo de colgajos microvascularizados, lo que ha derivado en que sean considerados en la actualidad como el método de elección en una gran mayoría de reconstrucciones maxilares complejas 6.
Se han descrito diferentes lugares donantes para la obtención de autoinjertos microquirúrgicos de hueso autólogo. Probablemente, los más empleados han sido el peroné, la cresta ilíaca, la escápula y el radio. Cordeiro y cols. 7, emplearon en el año 1998 un injerto osteofasciocutáneo microvascularizado de hueso radial para la reconstrucción de un defecto maxilar superior subtotal. No obstante, la limitación en cuanto a la cantidad de hueso que puede obtenerse, lo inapropiado de este hueso a la hora de soportar implantes dentarios, así como la evidente morbilidad en el área donante hacen que este colgajo prácticamente no sea utilizado en la actualidad para este tipo de defectos óseos.
La cresta ilíaca puede proporcionar, por lo general, suficiente hueso para una reconstrucción compleja, siendo el mejor para la inserción posterior de implantes osteointegrados 8. En este sentido, Frodel y cols. 9 realizan un estudio comparativo sobre la idoneidad de la cresta ilíaca, peroné, radio y escápula, para la colocación de implantes y estiman que tanto la cresta como el peroné cumplen unas características óseas adecuadas para ello. Sin embargo, en ocasiones, el colgajo osteocutáneo de cresta tiene algunas desventajas como un pedículo demasiado corto, excesivo abultamiento de la isla cutánea, dificultad para su modelado o la posibilidad de eventración o cojera en la zona donante 10,11.
El colgajo osteofasciocutáneo escapular es otra buena opción, más utilizada en el maxilar superior 12. Provee una mayor versatilidad de hueso que otros colgajos osteocutáneos, además la isla de piel es delgada y sin pelo, óptima para su uso intra y extraoral 10. Sin embargo, también tiene algunas desventajas: las características del hueso hacen que no siempre sea posible la colocación ulterior de implantes osteointegrados debido a su escasa anchura, el pedículo es relativamente corto y es necesario el cambio de posición del paciente durante la cirugía, lo que, además, imposibilita el trabajo a dos campos prolongando excesivamente el tiempo operatorio 10,13.
El injerto de osteofasciocutáneo de peroné es el injerto libre microvascularizado óseo más comúnmente utilizado en cirugía reconstructiva oral y maxilofacial 14,15, sobre todo cuando hay que reconstruir defectos mandibulares 16. La opinión más prevalente en la literatura actual es que el peroné es superior a otros huesos donantes en términos de características óseas 17. Su longitud le permite cubrir cualquier defecto mandibular (puede llegar a obtenerse hasta 25 cm de hueso), es fácil de modelar, es decir, soporta múltiples osteotomías y su pedículo es largo y de suficiente calibre para permitir realizar la microanastomosis con seguridad 18-20. Además al ser un hueso de carga, está preparado para soportarlas; tanto en la pierna como en la mandíbula, tiene dos gruesas corticales (Figura 7B) que permiten una adecuada inserción de implantes roscados de manera bicortical lo que les confiere una gran estabilidad primaria que, incluso, permitiría la carga inmediata 21. La morbilidad de la zona donante es escasa y sólo es necesario preservar durante su obtención al menos 6 cm de hueso cercano a las articulaciones 15. Anthony 19, en una serie de 30 pacientes, encuentra alguna forma de morbilidad funcional en el postoperatorio inmediato en 5 de ellos, no siendo necesarias medidas quirúrgicas adicionales. El peroné posee mayor cantidad de hueso cortical que la cresta o la escápula, tiene una sección triangular y 22, aunque normalmente no es necesario, se puede colocar el injerto en “doble barra” obviando un posible problema de altura ósea insuficiente a nivel sinfisario 14. Debido a que la parte central del peroné está más desprovista de hueso, se hace necesaria la estabilización bicortical del implante; incluso se recomienda, a la hora de lograr una buena estabilidad primaria, buscar el máximo contacto entre toda la longitud del implante y la cortical lateral del hueso 3. Estudios radiológicos mediante OPG muestran cierta remodelación del hueso bicortical fibular hacia una estructura algo más esponjosa aunque sin perder altura ni estabilidad implantaria 18.
La rehabilitación dental con prótesis sobre hueso injertado es, a menudo, inviable, debido, entre otros factores, a las características de la remodelación postquirúrgica (y, en ocasiones, postradioterapia) de los tejidos duros y blandos 23. La rehabilitación sobre implantes osteointegrados en estos pacientes ha ido ganando aceptabilidad en los últimos años a medida que iban apareciendo en la literatura resultados funcionales satisfactorios publicados por distintos autores 4,21,23-25. Dattilo y cols. 26, estudian por vez primera a nivel histológico la integración de implantes revestidos de hidroxiapatita sobre injerto óseo microvascularizado humano (cresta ilíaca). Sumi y cols. en el año 2001 3, demuestran la osteointegración a nivel microscópico de los implantes de titanio sobre el peroné microvascularizado. De su análisis se deduce que cabe esperar la misma respuesta reparadora del hueso microvascularizado que de la mandíbula natural ante la colocación de implantes de titanio. Por el contrario, otros autores como Rohner y cols. en el 2002 18, encuentran escasos signos de integración en implantes sobre peroné vascularizado aunque en el estudio se reconoce que este hecho podría atribuirse a no haber esperado el tiempo suficiente desde la colocación de los implantes hasta la realización del estudio histológico. Además, según el mismo autor, la estabilidad primaria es adecuada en todo momento.
Aunque algunos autores insertan los implantes sobre el injerto en la primera cirugía, esto complica enormemente el procedimiento y lo hace mucho menos predecible 27. En el presente caso, decidimos esperar un tiempo mínimo de un año tras la cirugía para valorar la colocación de implantes; con ello, comprobamos la ausencia de recidivas y valoramos la remodelación ósea. Nosotros en este caso cumplimos un periodo de espera hasta la segunda fase de 6 meses, aunque posiblemente se hubieran podido cargar antes. En estos casos el trabajo protésico es crucial; solemos optar por prótesis híbridas removibles sobre todo debido a la dificultad de crear una adecuada encía queratinizada. Con la removible facilitamos la limpieza de la prótesis y la exploración de la rehabilitación.
Conclusiones
A la hora de plantear la reconstrucción de grandes defectos óseos mandibulares, es inexcusable realizar una estricta planificación quirúrgica con el fin de obtener el mejor resultado, tanto estético como funcional. A este respecto, la transferencia de tejido libre vascularizado constituye, por lo general, la mejor alternativa hoy en día si el equipo cuenta con la suficiente experiencia en procedimientos microquirúrgicos.
Es prioritario realizar una selección cuidadosa del área donante, en base a criterios como morbilidad postquirúrgica, estado previo del paciente, cantidad de hueso y tejido blando obtenido, etc.
En nuestra experiencia, el colgajo microvascularizado de peroné aporta, en la mayoría de los casos, suficiente cantidad de hueso, incluso para una eventual reconstrucción completa mandibular. Las características óseas son excelentes y la morbilidad mínima, tanto en zona donante como receptora. Este injerto permite, además, el aporte simultáneo de tejido blando y la colocación de implantes a fin de conseguir una adecuada rehabilitación protésica, lo que redunda en la optimización del resultado final estético y funcional del paciente a largo plazo.
Bibliografía
1. Peled M, El-Naaj IA, Lipin Y, Ardekian L. The use of free fibular flap for functional mandibular reconstruction. J Oral Maxillofac Surg 2005; 63: 220-4.
2. Xin P, Chi M, Guang-yan Y, Chuan-bin G, Min-xiang H, Yi Z. Maxillary reconstruction with the free fibula flap. Plast Reconstruct Surg 2005; 115 (6): 1562-9.
3. Sumi Y, Hasegawa T, Miyaishi O, Ueda M. Interface analysis of titanium implants in a human vascularized fibula bone graft. J Oral Maxillofac Surg 2001; 59: 213-6.
4. Martín-Granizo R, Domínguez L. Rehabilitación oral con prótesis sobre implantes colocados en autoinjerto microquirúrgico de peroné. Maxillaris 2003; 57: 60-5.
5. Pogrel MA, Podles S, Anthony JP, y cols. A comparison of vascu larized and nonvascularized bone grafts for
reconstruction of mandibular continuity defects. J Oral Maxillofac Surg 1997; 55: 1200-11.
6. Taylor GI, Miller GD, Ham FJ. The free vascularized bone graft. A clinical extension of microvascular techniques. Plast Reconstr Surg 1975; 55: 533-44.
7. Cordeiro PG, Bacilious N, Schantz S, Spiro R. The radial forearm osteocutaneous “sandwich” free flap for reconstruction of the bilateral subtotal maxillectomy defect. Ann Plast Surg 1998; 40: 397-405.
8. Genden EM, Wallace D, Buchbinder D, Okay D, Urken ML. Iliac crest internal oblique osteomusculocutaneous free flap reconstruction of the postablative palatomaxillary defect. Arch Otolaryngol Head Neck Surg 2001; 127: 854.
9. Frodel JF, Funk GF, Capper DT. Osseointegrated implants: a
comparative study of bone thickness in four vascularized bone flaps. Plast Reconstr Surg 1993; 92: 449.
10. Cordeiro PG, Santamaria E. A classification system and algorithm for reconstruction of maxillectomy and midfacial defects. Plast Reconstr Surg 2000; 105: 2331.
11. Schusterman MA, Reece GP, Miller MJ. Osseous free flaps for orbit and midface reconstruction. Am J Surg 1993; 166: 341.
12. Urken ML, Bridger AG, Zur KB, Genden EM. The scapular osteofasciocutaneous flap: a 12-year experience. Arch Otolaryngol Head Neck Surg 2001; 127: 862.
13. Uglesic V, Virag M, Varga S, Knezevic P, Milenovic A. Reconstruction following radical maxillectomy with flaps supplied by the subscapular artery. J Craniomaxillofac Surg 2000; 28: 153-62.
14. Chen ZW, Yan W. The study and clinical application of the osteocutaneous flap of fibula. Microsurgery 1983; 4: 11-6.
15. Muñoz Guerra MF, Naval L, Rodríguez Campo FJ, y cols. Vascularized free fibular flap for mandibular reconstruction: a report of 26 cases. J Oral Maxillofac Surg 2001; 59: 140.
16. Disa GJ, Cordeiro PG. Mandible reconstruction with microvascular surgery. Semin Surg Oncol 2000; 19: 226-33.
17. Haugher BH, Fredrickson JM, Lerrick AJ, y cols. Fibular and iliac crest osteomuscular free flap reconstruction of the oral cavity. Laryngoscope 1994; 104: 1305.
18. Rohner D, Bucher P, Kunz C, Hammer B, Schenk RK, Prein J. Treatment of severe atrophy of the maxilla with the prefabricated free vascularized fibula flap. Clin Oral Impl Res 2002; 13: 44-52.
19. Anthony JP, Foster RD, Pogrel MA. The free fibula bone graft for salvaging failed mandibular reconstruction. J Oral Maxillofac Surg 1997; 55: 1417.
20. León BR, Carrillo FJ, González HM, y cols. Mandibular reconstruction with the free vascularized fibular flap: utility of three-dimensional computerized tomography. Reconstr Microsurg 1999; 15: 91-9.
21. Kramer FJ, Dempf R, Bremer B. Efficacy of dental implants placed into fibula-free flaps for orofacial reconstruction. Clin Oral Impl Res 2005; 16: 80-8.
22. Moscoso JF, Keller J, Genden E, y cols. Vascularized bone flaps in oromandibular reconstruction. A comparative anatomic study of bone stock from various donor sites to assess suitability for endosseous dental implants. Arch Otolaryngol Head Neck Surg 1994; 120: 36.
23. Schliephake H, Schmelzeisen R, Husstedt H, Scmidt-Wondra LU. Comparison of the late results of mandibular reconstruction using nonvascularized or vascularized grafts and dental implants. J Oral Maxillofac Surg 1999; 57: 944-50.
24. Roumanas ED, Markowitz BL, Lorant JA, y cols. Reconstructed mandibular defects: fibula free flaps and osseointegrated implants. Plast Reconstr Surg 1997; 99: 356.
25. Chiapasco M, Abati S, Ramundo G, y cols. Behaviour of implants in bone grafts or free flaps after tumor restion. Clin Oral Impl Res 2000; 11: 66-75.
26. Dattilo DJ, Misch CM, Arena S. Interface analysis of hydroxyapatite-coated implants in a human vascularized iliac bone grafts. Int J Oral Maxilllofac Implants 1995; 10: 405.
27. Chang Y-M, Coskunfirat OK, Wei F-C, Tsai C-Y, Lin H-N. Maxillary reconstruction with a fibula osteoseptocutaneous free flap and simultaneous insertion of osseointegrated dental implants. Plast Reconstruct Surg 2004; 113: 1140-5.
Agradecimientos
Al doctor J. J. Sánchez Gutiérrez y a Emilio Cuadrón por el excelente trabajo protésico realizado.
Correspondencia
Dr. Rafael Martín-Granizo López
Servicio de Cirugía Oral y Maxilofacial
Hospital Clínico San Carlos
C/ Profesor Martín Lagos, s/n.
28040 Madrid
email:
rmartin.hcsc@salud.madrid.org
Teléfono: 629 22 37 63





