Presentamos en este trabajo un protocolo para determinar el momento óptimo de colocación de la prótesis una vez transcurrido el periodo de osteointegración por medio de la monitorización de unos parámetros diagnósticos de los tejidos periimplantarios.
Material y métodos
Se realizó una revisión de la bibliografía publicada en los últimos siete años con respecto a los parámetros clínicos, radiográficos y otros , utilizados para monitorizar el estado de los tejidos periimplantarios.
Con el fin de establecer un protocolo para evaluar las osteointegración, se valoraron dichos parámetros en 20 pacientes tratados en el departamento de Prótesis Bucofacial de la UCM.
Resultados
Tras revisar la literatura se obtuvieron hasta once parámetros diferentes para evaluar la osteointegración los cuales fueron analizados cuidadosamente. Entre ellos, el torque de inserción del implante, la profundidad de sondaje o el análisis de la frecuencia de resonancia.
Discusión
Basándonos en el análisis de la evidencia encontrada en la literatura y en la experiencia clínica proponemos un protocolo simplificado para el odontólogo general que permite evaluar la osteointegración antes de rehabilitar los implantes.
Introducción
La rehabilitación oral sobre implantes en pacientes desdentados ha mostrado altas tasas de éxito en las últimas décadas cuando se dan unas condiciones previas determinadas (1). Por esta razón son muchos los profesionales que introducen los procedimientos implantoprotésicos de forma habitual en el tratamiento de los pacientes parcial y totalmente desdentados considerándolo como el de elección dentro de las posibles limitaciones anatómicas, fisiológicas o económicas.
Para el éxito de este tipo de tratamiento es requisito indispensable la perfecta osteointegración de implantes, así como un correcto diagnóstico y una buena planificación y realización del tratamiento.
La osteointegración fue definida por Bränemark en 1977 como “la unión directa, tanto funcional como estructural, entre el hueso y la superficie del implante sometido a carga”(2).
Esta osteointegración puede verse inhibida por varios factores como son la contaminación del implante o un excesivo micromovimiento. De acuerdo con Meredith y cols., el fallo de un implante se puede caracterizar por la movilidad clínica, una pérdida ósea severa alrededor del implante, o una fractura del mismo (3).
 |
El protocolo quirúrgico original propuesto por Bränemark y Adell consideraba un tiempo de osteointegración de 3 a 6 meses libre de carga. Durante los últimos años los avances en biomateriales han permitido reducir los tiempos de osteointegración de forma considerable. Hoy día no existe un protocolo establecido para determinar el momento de carga del implante. De hecho, la tendencia se mueve claramente de un protocolo estático hacia un protocolo dinámico con un tratamiento más individualizado (1).
En el presente artículo pretendemos sintetizar de la manera más racional posible los diferentes métodos y parámetros que podemos utilizar para evaluar y monitorizar la osteointegración de los implantes. Desde la evidencia científica, con una mentalidad eminentemente práctica y analizando los diferentes métodos, proponemos un protocolo orientativo dirigido al dentista restaurador.
Material y métodos
Se llevó a cabo una revisión bibliográfica de los últimos 7 años con respecto a los parámetros clínicos y radiográficos utilizados para evaluar la osteointegración y monitorizar el estado de los tejidos periimplantarios. La búsqueda se realizó mediante las bases de datos convencionales PUBMED, MEDLINE y COMPLUDOC, y se limitó a estudios publicados en lengua castellana e inglesa. Se introdujeron los siguientes términos para la búsqueda: osteointegración, implantes, percusión, mucosa queratinizada, sondaje, estabilidad primaria, movilidad, periimplantitis, radiovisiografía, análisis de la frecuencia de resonancia, Ostell; osseointegration, percussion, implant mobility, primary stability, diagnosis, clinical parameters, peri-implantitis.
El criterio de selección incluyó todos los niveles de evidencia disponibles: revisiones sistemáticas, ensayos clínicos controlados, estudios de cohortes, prospectivos y retrospectivos. Se revisaron todos los títulos y resúmenes de la búsqueda. Por último, se obtuvieron los textos completos de las publicaciones con mayor relevancia científica.
A partir de esta revisión, se analizaron los diversos métodos y parámetros encontrados para evaluar la osteointegración y se estableció, con un enfoque práctico, un protocolo preliminar para evaluar la osteointegración. Con la finalidad de afinar este protocolo, se aplicó a una muestra de 20 pacientes en el departamento de Prótesis Bucofacial de la Universidad Complutense de Madrid. En los criterios de inclusión se consideraron todos los pacientes con implantes no cargados de las casas comerciales Nobel/Replace, ITI y 3i, en el momento de proceder a su rehabilitación según los protocolos convencionales utilizados por este departamento. Para ello, nos ayudamos de las historias clínicas de los pacientes, instrumentos de exploración, sonda periodontal tipo Michigan, aparato de radiología intraoral de cono largo, placas radiográficas Kodak ultraspeed®, radiovisiografía Trophy, regla milimetrada y el Ostell® mentor (Straumann).
Resultados
Tras analizar la evidencia encontrada en la literatura encontramos hasta once diferentes métodos o parámetros utilizados para evaluar la osteointegración; desde los propiamente quirúrgicos como el torque de inserción del implante, parámetros clásicos periodontales como son la movilidad y el sondaje, hasta otros métodos más actuales como es el análisis de la frecuencia de resonancia. A continuación, se hace una breve síntesis de cada uno de ellos.
Torque de inserción del implante
La estabilidad primaria de un implante depende de múltiples factores. De acuerdo con Meredith, deben tenerse en cuenta factores como la técnica quirúrgica, la geometría del implante, su longitud, diámetro y superficie, sin olvidar la cantidad de hueso y densidad ósea en la zona (4). La mayoría de los autores coinciden en la importancia de la estabilidad primaria para el éxito a largo plazo de los implantes osteointegrados, siendo considerada ésta como requisito previo fundamental para el desarrollo de la osteointegración (5). La estabilidad primaria tiene lugar en el momento que se coloca el implante y se refiere a la cantidad de contacto primario del hueso (Figura 1) (6).
 |
El torque de inserción del implante es un método no invasivo y fiable para determinar la estabilidad primaria del implante. Debe registrarse en la fase quirúrgica (Figura 2). Chiapasco (2004) considera un torque de inserción óptimo entre 35 y 50 N, sin embargo hay que tener precaución con valores inferiores a 35 N (5, 7).
Dolor
El dolor o la molestia en la zona del implante puede estar asociado con un aumento de movilidad del mismo y podría considerarse uno de los primeros signos clínicos que indica un fracaso implantológico. De hecho, una molestia persistente puede alertar del problema mucho antes de que cualquier cambio radiológico sea evidente. Es un síntoma que el paciente puede referir de manera espontánea, o puede aparecer al percutir el implante o al aplicar el test de torque. A pesar de la estrecha relación existente entre el fracaso del implante y el dolor, no se debe descartar el posible fracaso asintomático, por lo que es recomendable realizar más pruebas en caso de una respuesta negativa (8).
Percusión
La estabilidad primaria y secundaria de un implante viene siendo comprobada desde hace años percutiendo el implante lateralmente con el mango de un espejo de exploración. Aunque esta técnica clínica está enormemente extendida, existe muy poca evidencia en la literatura que sugiera la validez de este método. (6). La interpretación de este parámetro clínico se reduce a la calidad auditiva del clínico lo que lo convierte en un parámetro muy subjetivo (9). Sin embargo, aunque no se trata de un método diagnóstico cuantificable, la experiencia clínica nos dice que puede ser de gran ayuda en casos avanzados de pérdida de osteointegración.
Movilidad (Test de torque)
La movilidad implantaria es un indicador claro de pérdida de osteointegración. Es un parámetro muy específico pero poco sensible es decir, en ocasiones se hace evidente en etapas muy avanzadas de pérdida de osteointegración ya que a veces un mínimo contacto directo entre el impante y el hueso puede evitar la movilidad del implante (8).
Hay estudios que sugieren, que parámetros clínicos típicamente periodontales como la movilidad, son de limitado valor clínico en la evaluación y la predicción de una futura pérdida de osteointegración (10).
El test de torque es el método más común para evaluar la movilidad del implante. Nunca debe realizarse en etapas tempranas de osteointegración, ya que la presencia de hueso inmaduro alrededor del implante puede dar un falso positivo además de alterar los mecanismos de osteointegración. Se recomienda no aplicar fuerzas superiores a los 20N. Indistintamente, se podrán utilizar llaves dinamométricas manuales o instrumentos rotatorios adecuados a este fin (Figuras 3 y 4) (11).
 |
Índices de placa / Indices gingivales
Varios autores proponen parámetros diagnósticos periodontales como marcadores de salud o enfermedad periimplantaria, por lo que los índices de placa pueden ser utilizados para evaluar la higiene oral y el grado de inflamación de la mucosa (12).
Otros estudios ponen de manifiesto el limitado valor clínico de estos parámetros en correlación con la pérdida ósea periimplantaria (10).
Según lo establecido en “The First European Workshoon Periodontology”, Switzerland, 1993, la enfermedad periimplantaria es un término colectivo para los procesos inflamatorios que se producen en los tejidos que rodean al implante. La mucositis periimplantaria se define como un proceso inflamatorio reversible de los tejidos blandos que rodean al implante funcional, mientras que la periimplantitis se caracteriza por la pérdida ósea alrededor del implante y su irreversibilidad.
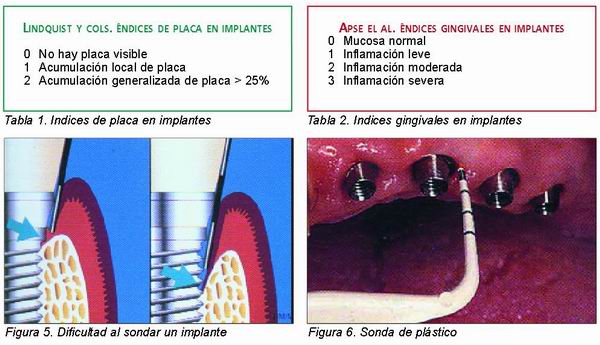
La mayoría de los autores coinciden en que existe una correlación muy significativa entre la higiene oral y la reabsorción ósea periimplantaria, por lo que resulta muy útil monitorizar los hábitos de higiene del paciente portador de implantes cuantificando el acúmulo de placa existente. Autores como Lindquist, Mombelli y Apse proponen índices de placa modificados para este fin (Tabla 1) (13, 14). A su vez, se proponen los índices gingivales para evaluar el estado de los tejidos blandos periimplantarios, sin embargo hay que tener en cuenta que existen dificultades a la hora de tomar estos registros ya que varían dependiendo de parámetros como es la presencia de encía no queratinizada (Tabla 2). De hecho, en estudios longitudinales realizados se presenta muy poca correlación entre los registros de índices gingivales y cambios en el nivel de hueso crestal (8). Por eso, a la hora de monitorizar el estado de los tejidos blandos periimplantarios se da preferencia al uso de parámetros más fidedignos como es el sangrado al sondaje, el cual citaremos más adelante.
Mucosa queratinizada
Diversos estudios clínicos y experimentales han fracasado a la hora de establecer la anchura de encía óptima para el mantenimiento de la salud periodontal (15). Existen diversos estudios con implantes en animales, los cuales no contemplan ninguna diferencia significativa entre aquellos implantes rodeados de encía queratinizada y aquellos que no lo están, en relación a la recesión y la pérdida ósea tras ser expuestos a un acúmulo de placa importante (16). Sin embargo Warrer y cols, en un estudio sobre monos apreciaron diferencias significativas entre la presencia o no de encía queratinizada (17).
Existe gran controversia sobre la importancia de la presencia de mucosa queratinizada alrededor del implante y sobre la justificación de realizar técnicas quirúrgicas destinadas a ganar encía queratinizada en esas zonas. La literatura nos sugiere que la ausencia de encía puede aumentar la susceptibilidad de los tejidos perrimplantarios a destruirse cuando existe un acúmulo de placa (18).
Sondaje
Cuando se sonda un diente o un implante, el grado de penetración de la sonda está condicionado por muchos factores como son la fuerza, la angulación, el diámetro de la punta de la sonda, la rugosidad del implante o de la raíz dentaria, el estado inflamatorio de la encía y la firmeza de los tejidos marginales (Figura 5). Las diferencias con respecto a la composición, organización y unión de los tejidos blandos al implante o al diente hacen que las condiciones en el sondaje de un diente o de un implante sean comparables. Por ejemplo, uno de los factores que influyen en la mayor o menor penetración de la sonda es la disposición paralela al eje del implante de las fibras colágenas en el tejido conectivo supracrestal. En consecuencia la sonda penetrará más profundamente al sondar implantes que en el sondaje de dientes naturales. Un implante totalmente sano permite una profundidad de sondaje de hasta 4 mm. Además debe tenerse en cuenta que los implantes son más sensibles a las variaciones de la fuerza en el sondaje (8, 19).
 |
El contexto quirúrgico del implante puede condicionar el sondaje. Concretamente en la zona anterior donde los requerimientos estéticos exigen una colocación del implante de forma yuxta e incluso infracrestal.
Algunos autores son contrarios al sondaje sistemático de los implantes ya que existe la posibilidad de introducir bacterias en los tejidos periimplantarios y dañar la superficie del implante con la consiguiente colonización de patógenos. Es por ello que se recomienda el uso de sondas de plástico (Figura 6) (20, 21, 22) .
Uno de los argumentos esgrimidos por los autores contrarios al sondaje, es la separación que se produce entre el epitelio de unión y la superficie implantaria. Esta separación no obstante, lejos de ser irreversible, se recupera en un plazo de 5 días como han demostrado Etter y cols. en un estudio sobre perros (19).
Pese a que algunos autores sugieren que este parámetro clínico tiene un valor clínico limitado para la evaluación y predicción de la pérdida ósea periimplantaria (10,*), en el útlimo “Consensus Report” sobre los procedimientos clínicos relativos a la supervivencia implantaria, se postuló que el sondaje debe ser considerado como un parámetro clínico importante para monitorizar en el tiempo las condiciones de los tejidos periimplantarios (18).
Por tanto, una manera fiable de monitorizar la salud periimplantaria consisten en tomar mediciones iniciales registrando las referencias necesarias en cada caso para así luego poder comparar si ha existido o no un aumento de la profundidad de sondaje. Debe aplicarse una fuerza constante y reproducible de 0,20-0,25N (10, 18, 23).
El sangrado al sondaje como factor predictivo de riesgo de periimplantitis ha sido considerado los últimos años un parámetro de valor cuestionable debido a la frecuencia de falsos positivos derivados de un epitelio de unión más sensible. Sin embargo, estudios más recientes proponen este parámetro para monitorizar los tejidos periimplantarios siempre que se respete la fuerza de sondaje recomendada, siendo además mayor el valor diagnóstico del sondaje en implantes que en dientes. La ausencia de sangrado posiblemente se corresponda con una estabilidad de los tejidos periimplantarios (24).
Radiología
La literatura desplaza cualquier duda sobre la gran utilidad que supone la radiología en la evaluación de la osteointegración, sin embargo, no se debe hacer un uso innecesario de esta técnica durante la fase de mantenimiento (18, 27, 28). Son dos aspectos biológicos diferentes los que nos permiten observar la radiología: la continuidad hueso-implante, y la pérdida ósea vertical (Figura 7).
George Zarb y Alberkson, 1998, en el “Consesus Report” establecen como criterio de éxito de los implantes la evidencia radiológica de osteointegración la cual se acepta como la ausencia de cualquier tipo de radiolucidez en la interfase del implante con el hueso (25, 26). Por otro lado, se establece para un buen pronóstico que la pérdida ósea vertical no deberá ser mayor a 1,5 mm antes de la carga protésica.
Las radiografías de las medidas de la pérdida ósea deben ser estudiadas siempre con radiografías periapicales, con referencias específicas de puntos y angulaciones (Figura 8).
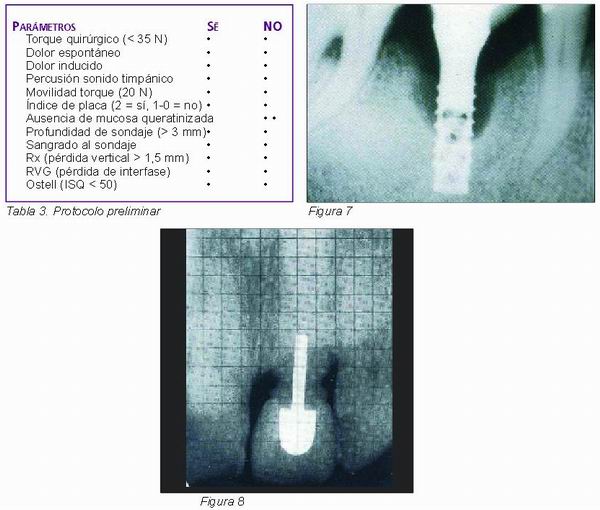 |
La radiografía convencional presenta inconvenientes en la determinación de la osteointegración, ya que son difícil de cuantificar objetivamente (26). Autores como Sewerin, concluyeron que pequeñas desviaciones del cono largo con respecto al eje axial del implante compromete la fidelidad de la medición (29). Por este motivo, hay que resaltar la importancia de estandarizar la técnica radiológica lo máximo posible.
Comparándola a la radiografía convencional, la radiovisiografía es un método que nos permite objetivizar y cuantificar con mayor precisión, además nos permite realizar estudios densitométricos y valorar más claramente la interfase implante-hueso (Figura 9) (30).
Análisis de la frecuencia de resonancia (Ostell Mentor®)
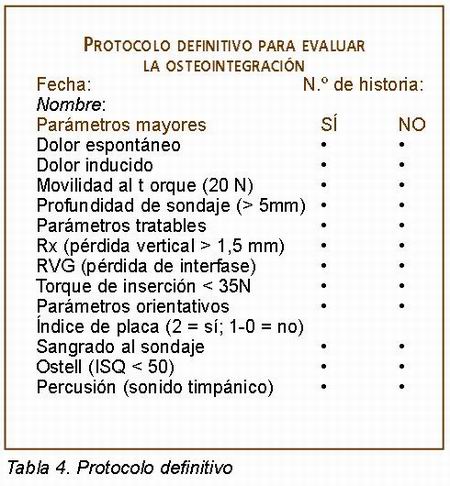
Meredith y cols. introdujeron esta técnica como un método diagnóstico no invasivo para valorar y monitorizar la estabilidad de la interfase hueso-implante midiendo in vivo la frecuencia de resonancia mediante un pequeño transductor unido al implante (Figura 10) (25). El implante responde a un rango de frecuencias de sonido mediante valores ISQ (coeficiente de estabilidad implantaria). Hoy por hoy, estos valores ISQ tienen la siguiente interpretación:
— ISQ < 40, corresponde a una alta tasa de fracasos;
— ISQ < 49 son implantes de éxito dudoso;
— ISQ > 49 alta tasa de éxito;
— y valores ISQ 60-65 correspende a implantes aptos para carga inmediata (31).
 |
Son dos las variables principales que condicionan los valores ISQ (Alleyne y cols., 1996): la pérdida ósea vertical y el tipo de hueso (32, 33). Mientras mayor es la pérdida ósea vertical menor es el valor ISQ sin tener por que corresponder a una pérdida de osteointegración del implante. Respecto al tipo de hueso, se obtienen valores ISQ mayores en mandibula que en maxilar aunque estudios han comprobado que a las 5 semanas de cicatrización estos valores se igualan en cualquier tipo óseo (34).
Dentro de la literatura, hemos encontrado muchos defensores de esta técnica pero también algún detractor. Friberg y cols., 1999, demuestran que la técnica RFA es más sensible a la hora de detectar cambios en la estabilidad implantaria que los métodos clínicos convencionales y el examen radiográfico. Varios autores, definen recientemente la RFA como un método muy útil para monitorizar la osteointegración antes de cargar el implante (35, 36). Se ha demostrado que hay una buena correlación entre los valores del análisis de la frecuencia de resonancia y diferentes parámetros histomorfométricos (37). Por otro lado hay estudios que nos dicen que no existe correlación entre el torque de inserción del implante y los valores del análisis de frecuencia de resonancia (5). Las mediciones de la RFA son repetibles de forma fiable pero no es segura para identificar implantes con movilidad (38). Aún no se ha definido de forma clara la relación de las mediciones con el grado de osteointegración (39).
Otros métodos
Existen otras técnicas para valorar la osteointegración que bien no han sido suficientemente estudiadas, o bien han caído en el desuso. Entre éstas nos encontramos la técnica del “Synchrotron Radiation imaging” (Jung, 2003), alternativa a los rayos X convencionales con la que se consiguen imágenes de muy alta resolución en la escala micrométrica pero que no es cuantificable ni hay estudios serios que la respalden (40). El “Implantest”, método altamente desarrollado para el análisis de la estructura, utilizado en la ingeniería aeronaútica, en el que unos aceleradores se unen a la estructura a analizar y se conectan a su vez a un aparato que mide la aceleración en función del tiempo obteniéndose una gráfica que evalúa la rigidez estructural (9). El “Periotest”, utilizado en gran número de estudios, es un aparato que mide en msg el tiempo de contacto por impacto de una varilla metálica y el implante. Nos da una escala de valores periotest (PTVS) que cuanto más negativo es implica una menor capacidad del implante para absorber el impacto, lo que indica contacto con una interfase dura (por ejemplo, osteointegración), mientras que valores positivos indica que el implante está rodeado de tejidos blandos. Se ha abandonado su uso por la evidente variabilidad de los resultados según el punto desde donde es tomada la medición. Además, son muchos los estudios que han comparado este método con la RFA resultando esta última más fiable en lo que se refiere a la obtención de datos relativos a la estabilidad implantaria.
Discusión
Analizados todos los parámetros encontrados en la literatura, se diseñó un protocolo preliminar. Para objetivizar el protocolo de la manera más sencilla posible, se aunaron aquellos parámetros cuantificables, de los cuales se derivaba una respuesta positiva o negativa (Tabla 3).
Con el fin de establecer una jerarquía en la relevancia clínica de los parámetros, y en función de la evidencia científica encontrada, se aplicó este protocolo a un grupo de 20 pacientes en el Departamento de Prótesis Bucofacial de la UCM, sobre implantes no cargados de las casas comerciales Nobel Replace, Straumann y 3i.
Una vez aplicado el protocolo en pacientes hemos clasificado de forma preliminar los parámetros utilizados en mayores, “tratables” y orientativos.
— Parámetros mayores: si aparece respuesta afirmativa hay un alto riesgo de pérdida de osteointegración:
• Dolor espontáneo.
• Dolor inducido.
• Movilidad con Test de Torque a 20 N.
• Profundidad de sondaje > 5mm.
— Parámetros “tratables”: si aparece respuesta afirmativa se podrá mejorar el pronóstico del implante adoptando las medidas adecuadas en cada caso :
• Torque quirúrgico < 35 N, se recomienda un mayor tiempo de osteointegración antes de cargar el implante.
• La ausencia de encía queratinizada, siempre se podrá solucionar con técnicas específicas de cirugía periodontal si se cree necesario.
• La pérdida ósea vertical > 1,5 mm o la pérdida de la interfase hueso-implante observadas en la radiografía periapical, nos llevará a estudiar la posible etiología y tratarla. Si se tratara de una alteración metabólica o endocrina relacionada con el metabolismo del calcio se administrarán los fármacos necesarios. Por otro lado, si el origen fuese infeccioso (periimplantitis) se tratará con las técnicas periodontales existentes (por ejemplo, curetas de teflón). También será recomendable realizar un diseño protésico más cuidadoso para no sobrecargar ese implante.
— Parámetros orientativos: no nos van a condicionar nuestro tratamiento:
• Índice de placa gingival (generalizado = 2), nos informa sobre el grado de higiene del paciente.
• Sangrado al sondaje.
• Mediciones ISQ del Ostell® mentor < 50.
• Sonido timpánico a la percusión, junto al parámetro anterior nos puede “alertar” a observar más cuidadosamente los parámetros mayores.
 |
Aunque son todavía muchas las líneas de investigación abiertas sobre esta materia, pueden sintetizarse a la luz de la evidencia científica, diversos factores y parámetros utilizados para monitorizar las condiciones periimplantarias. A modo de protocolo clínico con carácter práctico para el dentista restaurador, creemos que el protocolo que proponemos puede ser de gran utilidad en el momento de decidir si un implante se encuentra correctamente osteointegrado y preparado para recibir la carga protésica (Tabla 4).
Correspondencia
Dr. Jaime Del Río Highsmith
Universidad Complutense de Madrid
Facultad de Odontología
Departamento de Estomatología I
Plaza Ramón y Cajal, s/n
28040 Madrid
Telf: 913941922
Fax: 913942029
Email: jrh@odon.ucm.es
Departamento de Prótesis Bucofacial. UCM
Curso de especialista en Implantoprótesis. 2004/05
Bibliografía
1. Esposito M, Hirsch JM, Leckholm U, Thomsen P. Biological factors contributing to failures of osseointegrated oral implants. I. Success criteria and epidemiology. Eur J Oral Sci 1998; 106: 721-764.
2. Branemark PL. Tissue integrated prostheses. 1985. Chicago. Quintessence Books.
3. Meredith N, Alleyne D, Cawley P. Quantitative determination of the stability of the implant-tissue interface using resonance frequency analysis. Clin Oral Impl Res 1996: 7: 261-267.
4. Meredith N, Friberg B, Sennerby L, Aparicio C. Relationship between contact time measurements and PTV values when using the periotest to measure implant stability. Int J Prosthodont 1998; 2: 269-275.
5. Cunha HA, Francischone CE, Filho HN, Gomes de Oliveira RC. A comparison between cutting torque and resonance frequency in the assesment of primary stability and final torque capacity of standard and tiunite single-tooth implants under immediate loading. Int J Oral Maxillofac Implants 2004; 19: 578-585.
6. Barewal RM, Oates TW, Meredith N, Cochran DL. Resonance frecuency measurement of implant stability in vivo on implants with a sandblasted and acid-etched surface. . Int J Oral Maxillofac Implants 2004;19:641-651.
7. Chiapasco M. Early and immediate restoration and loading of implants in completely edentulous patients. Int J Oral Maxillofac Implants 2004, 19: Suppl: 76-91.
8. Salvi EG, Lang NP. Diagnostic parameters for monitoring peri-implant conditions. Int J Oral Maxillofac Implants 2004; 19 suppl: 116-127.
9. Lawrence DJ, Cucchiaro PJ, Deluzio AJ. Electronic monitoring of dental implant osseointegration. JADA 2002, 133: 483-490.
10. Weber HP, Crohin CC, Fiorellini JP. A 5-year prospective clinical and radiographic study of non-submerged dental implants. Clin Oral Impl Res 2000: 11: 144-153.
11. Ramp L, Jefcoat L. Dynamic behaviour of implants as a measure of osseointegration. JOMI. vol. 16, num. 5, 2001.
12. Fourmousis I, Bragger U, Burgin W, Tonetti M, Lang NP. Digital image processing. I. Evaluation of gray level correction methods in vitro. Clin Oral Implants Res. 1994 Mar; 5(1): 37-47.
13. Mombelli A, Van Oosten MAC, SchŸrch E, Lang NP. The microbiota associated with successful or failing osseointegrated titanium implants. Oral Microbiol Inmunol 1987; 2: 145-151.
14. Lindquist LW, Rocker B, Carlsson GE. Bone resorption around fixtures in edentulous pacients treated with mandibular fixted tissue-integrated prostheses. J Prosthet Dent 1988; 59: 59-63.
15. Lang NP, Loe H. The relationship between the widht of keratinized gingiva and gingival health. J Periodontal 1972; 43: 623-627.
16. Strub JR, GaberthŸel TW, Grunder U. The role of attached gingiva in the health of periimplant tissue in dogs. Clinical Findings. Int J Periodontics Restorative Dent 1991; 11: 317-333.
17. Warrer K, Buser D, Lang NP, Karring T. Plaque induced periimplantitis in the presence or absence of keratinized mucosa. An experimental study in monkeys. Clin Oral Implants Res 1995; 6: 131-138.
18. Lang NP, Berglundh T, Heitz-Mayfield LJ, Pjetursson BE, Salvi GE, Sanz M. Consesus statements and recommended clinical procedures regarding implant survival and complications. Int J Oral Maxillofac Implants 2004; 19 Suppl:150-154.
19. Etter TH, HŒkanson I, Lang NP, Trejo PM, Caffesse RG. Healing after standardized clinical probing of the periimplant soft tissue sea. A histomorphometric study in dogs. Clin Oral Impl Res 2002; 13: 571-580.
20. Hunter F. Periodontal probes and proving. Int Dent J 1994; 44: 577-583.
21. Schou S, Holmstrup P, Stšltze K, Hj¿rting-Hansen E, Fiehn NE, Skovgaard LT. Probing around implants and teeth with healthy or inflamed peri-implant mucosa/gingival. A histologic comparison in cynomolgus monkeys. Clin Oral Impl Res 2002; 13: 113-126.
22. Ericsson I, Lindhe J. Probing deep at implants and teeth. An experimental study in the dog. J Clin Periodontol 1993; 20: 623-627.
23. McGlumphy EA, Peterson LJ, Larsen PE, Jeffcoat MK. Prospective study of 429 Hydroxyapatite-coated cylindric omniloc implants placed in 121 pacients. Int J Oral Maxillofac Implant 2003; 18(1): 82-92.
24. Luterbacher S, Mayfield L, BrŠgger, Lang NP. Diagnostic characteristics of clinical and microbiological tests for monitoring periodontal and peri-implant mucosal tissue conditions during supportive periodontal therapy (SPT). Clin Oral Impl Res 2000; 11: 521-529.
25. Mu–oz Martinez R, Mesa Aguado FL, Noguerol Rodriguez B. Efectos del tabaco en la osteointegración. Periodoncia y osteointegración. 2004, vol 14, num. 4, Oct-Dic.(259).
26. Martinez V‡zquez de Parga JA, Ca–ada L, Del Rio Hisghmith J. Sistema de comprobación de la osteointegración mediante la radiovisiografía. Rev. Europ. Odont-Estomato. 2000. Vol. XII, num. 6. Nov-Dic.: 297-304.
27. Lang NP, Wilson TG, Corbet EF. BIological complications with dental implants: their prevention, diagnosis and treatment. Clin Oral Implant Res.2000,II(supp): 146-155
28. Shou S, Holmstrup P, Hj¿rting-Hansen E, Lang NP. Plaque-induced marginal tissue reactions of osseointegrated oral implants: a reviuw of the literature. Clin. Oral. implant. Res. 1992 (3): 149-161.
29. Swerin IP. Errors in radiographic assessment of marginal bone height around osseointegrated implants.Scand.J. Dent. Res-1990; 98: 428-433.
30. Suarez Cunqueiro MM, Suarez Quintanilla JM, Suarez Quintanilla J. Estudio de la densidad ósea radiológica periimplantaria. Rev.Vasca de Odontoloestomatología. 1999; Vol. 9. núm 2: 10-16.
31. Sennerby L, Meredith N. Renonance frecuency análisis. Current knowledge and clinical implications.Osstell Mentor.Scientific referentes.”Analisi della Frequenza di risonanza(RFA)”Osteointegrazione e carico immediate.2002; A. 32.
32. Meredith N, Alleyne D, Cawley P. Quantitative determination of the stability of the implant.tissue interface using resonance frecuency analysis.Clin Oral Impl Res 1996: 7: 261-267
33. Bischof M, Nedir R, Szmukler-Moncler S, Bernard JP, Samson J. Implant stability measurement of delayed and immediately loaded implants during healing. A clinical resonance.frecuency analysis study with sandblasted and etched ITI implants.Clin Oral Impl Res.2004. 15: 529-539
34. Barewall R, Oates T, Meredith N, Cochran D. Resonance frecuency measurement of implant dtability in vivo implants with a sandblasted and acid-etched surface. Int.J Oral Maxillofac Implants 2003; 18: 641-651.
35. Friberg B, Sennerby L,Linden B, Gršndahl K, Lekholm U. Stability measurements of one-stage Brånemark implants during helaing in mandibles. A clinical resonance frecuency analysis study.Int. J. Oral Maxillofac. Surg. 1999; 28: 266-272.
36. Huang et al. Early detection of implant healing process using resonance frecuency analysis.Clin. Oral Impl. Res. 14, 2003/ 437-443.
37. Nkenke E, Hahn M, Weinzierl K, Radespiel-Tršger, Neukam F, Engelke K. Implant stability and histomorphometry: a correlation study in human cadavers using stepped cylinder implants. Clin. Oral Impl. Res. 14, 2003/ 601-609.
38. Nedir R,Bischof, Szmukler-Moncler S, Bernard JP, Samson J. Predicting osseointegration by means of implant primary stability. A resonance –frecuency analysis study delayed and immediately loaded ITI SLA implants. Clin.Oral Impl. Res. 15, 2004/520-528
39. Pattijn V, Van Lierde C, Van der Perre G, Naert I, Vander Floten J. The resonante frecuencias and mode shapes of dental implants: Rigid body behaviour versus bending behaviour. A numerical approach. Journal of Biomechanics. 2005. 01. 035.
40. Jung et al. Osseointegration assessment of dental implants. Using a Synchrotron Radiation Imaging Technique: A preliminary study. JOMI. vol. 18, num.1, 2003.





