Dra. María Lobato Carreño Odontóloga.
Dr. Aurelio Criado Pascual, Médico Estomatólogo, Salamanca
Justificación
Introducción
Una de las finalidades de la terapia periodontal es la regeneración de los tejidos periodontales. Estos procesos son mediados por la acción de los factores de crecimiento (FC) que regulan la proliferación, diferenciación, quimiotaxia y síntesis de la matriz extracelular.
Estas propiedades, han llevado a proponer que tales factores desempeñan un papel importante en la regeneración de nuevo hueso y la aceleración del periodo de cicatrización quirúrgico.
Realizaremos una puesta al día de los conocimientos actuales sobre los mecanismos bioquímicos y fisiológicos de la regeneración ósea, resaltando de manera especial el papel del plasma rico en plaquetas (PRP).
Material y métodos
Se revisa literatura reciente mediante diferentes bases de datos informáticas (Medline, Pub-Med y Science Direct). Se cruzaron las palabras claves: defectos óseos; factores de crecimiento óseo; plasma rico en plaquetas y regeneración.
Conclusión
El hueso es el único tejido del organismo capaz de regenerarse, permitiendo la restitutio ad integrum tras el trauma. El uso de plasma rico en plaquetas es un protocolo válido para la regeneración ósea.
Palabras clave
Defectos óseos; factores de crecimiento óseo; plasma rico en plaquetas; regeneración.
Introducción
El tratamiento diario de las distintas patologías bucodentales muchas veces exige al profesional llevar a cabo procesos de resección de mayor o menor complejidad, con su consecuente pérdida de dientes y de soporte óseo, añadiendo así dificultades al tratamiento con implantes osteointegrados (1). Dichas condiciones han llevado a la investigación de nuevas técnicas de regeneración ósea y a la utilización de diversos métodos de reconstrucción con injertos.
El conocimiento de la existencia de unas proteínas plasmáticas denominadas Factores de Crecimiento (FC) y el uso de las mismas, es realmente reciente. Se han llevado a cabo innumerables experimentos para optimizar la forma de concentrar estas proteínas partiendo de pequeñas cantidades de sangre y buscando una técnica sencilla, económica y repetible; pasando de buscar un precipitado plaquetario, a obtener una suspensión plaquetaria en proteínas plasmáticas (2).
Estas investigaciones se inician con Marshall Urist en 1965, quien demostró cómo el hueso liofilizado e implantado en lugares ectópicos, inducía la formación de hueso (3). Se responsabilizó de este hecho a un grupo de proteínas a las que denominó BMP. Mientras que Tayapongsak (1994) concentró su atención en los mecanismos intrínsecos de la respuesta celular, estudiando la fibrina adhesiva autóloga (AFA). Paralelamente, en los años 90, otro grupo de investigadores, dirigidos por Marx (1998), estudian el comportamiento del elemento de la sangre responsable de la reparación celular, “las plaquetas”, encontrando tres FC, y posteriormente, en el 2004, este mismo autor reporta siete (4, 5).
En España la investigación sobre los factores plaquetarios contenidos en las plaquetas y su posible aplicación clínica ha sido desarrollada por los cirujanos maxilofaciales. En concreto Eduardo Anitua (1999), mediante sus investigaciones, sentó las bases y desarrolló los principios de los PRP. Anitua propone utilizar el Plasma Rico en Factores de Crecimiento (PRFC) ya que las plaquetas contienen algunos FC como (TGF-B1), (VEGF) y (IGF-I), con diferentes propiedades claves en los procesos de reparación y regeneración (2, 6, 7).
Desde entonces las aplicaciones del Plasma Rico en Plaquetas (PRP) en reconstrucción ósea maxilofacial se han incrementado notablemente: defectos de continuidad ósea mandibular, aumentos de reborde oclusal maxilar y mandibular, elevaciones de seno para colocación futura de implantes, alveolos postextracción, relleno de quistes maxilares, perimplantitis, reparación de tejidos blandos, e incluso en la cobertura de zonas biopsiadas mediante punch (4, 8-10).
Nuestro objetivo será explorar el potencial de aplicación del PRP en la clínica odontológica diaria para mejorar el proceso de cicatrización y la regeneración ósea.
Conceptos generales
Se han estudiado y aplicado numerosos sustitutos óseos en implantología oral, considerando sus ventajas y aplicaciones específicas en la búsqueda de un material bioactivo con capacidad de diferenciación osteoblástica que favorezca la regeneración. Se dice que el sustituto óseo ideal debe ser osteogénico, osteoinductivo y osteoconductivo (1):
— Osteogénesis: Es la creación de hueso nuevo a cargo de los osteoblastos, cuya fuente son los injertos óseos antólogos (1, 5).
— Osteoinducción: Proceso de estimulación de la osteogénesis. Para que un injerto sea osteoinductivo es preciso que sea capaz de formar hueso en áreas donde no se forma normalmente. Consiste en la producción de señales reguladoras del metabolismo óseo. Dentro de esta vertiente englobamos a las proteínas morfogenéticas óseas (BMP), que actúan directamente sobre las células precursoras promoviendo la formación de hueso nuevo en cantidades ilimitadas; y los FC, que modifican la proporción de hueso preexistente, aumentan las mitosis y la secreción de proteínas de las células presentes, confiriendo a las células óseas una limitada capacidad de regeneración (1, 5).
— Osteoconducción: Capacidad de ciertos materiales de formar una matriz a través de la cual se puede depositar nuevo hueso. Los injertos osteoconductivos permiten la proliferación del tejido óseo desde las zonas anatómicas óseas preexistentes, aislando así el defecto, e impidiendo el crecimiento de tejido conjuntivo hacia el interior del mismo (1, 5, 11).
En este contexto se empezó a investigar y utilizar el PRP con la intención de ir más allá de la reparación de las heridas quirúrgicas y conseguir regeneración de los tejidos perdidos.
Hablamos de reparación de un tejido cuando hay restauración de dicho tejido sin que éste conserve su arquitectura original ni tampoco su función. Cuando dicho tejido no recupera su estado original, se produce una cicatrización. Por otra parte, se entiende por regeneración cuando la restauración de dicho tejido posee propiedades indistinguibles del tejido original. El problema con el tejido de cicatrización (reparación) es que no recupera todas las propiedades mecánicas ni la función fisiológica del tejido u órgano original que ha sido dañado, por lo que el interés en el PRP radica en regenerar, reconstruir la forma y restaurar la función.
Por tanto, la táctica terapéutica del PRP se fundamentaría en la modulación y aceleración de los procesos cicatriciales a través de los factores de crecimiento presentes en las plaquetas, iniciadores universales de casi todo proceso de regeneración (12).
Factores de crecimiento presentes en el PRP
Bioquímicamente, el PRP se compone de suero, leucocitos, plaquetas y factores de crecimiento, pero aunque la presencia conjunta de todos estos elementos favorece la acción del PRP, los elementos fundamentales son los factores de crecimiento (13, 14).
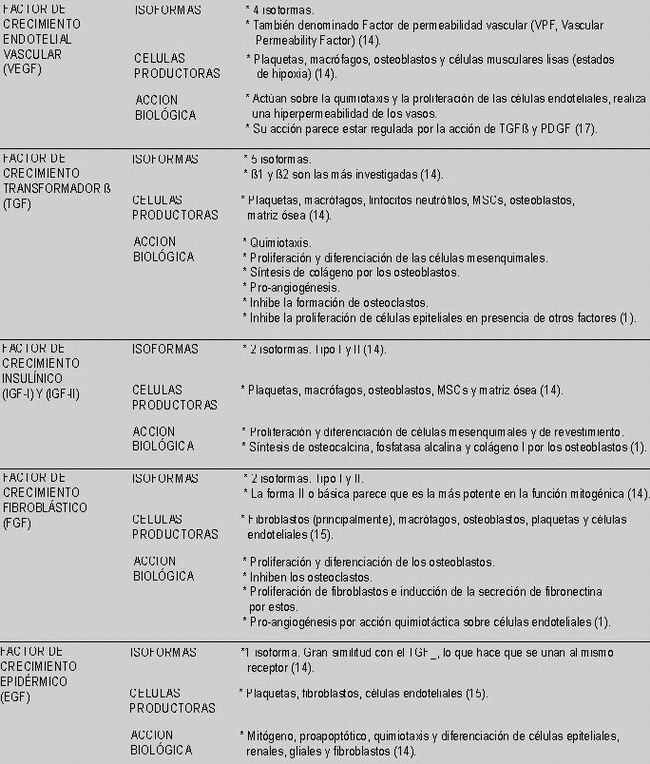
Estas moléculas polipeptídicas liberadas por células en la zona inflamada, ejercen la función de regeneración del lecho donante y, en líneas generales, son: el factor de crecimiento de origen plaquetario (PDGF), el factor de crecimiento de transformación-beta (TGF-beta), el factor de crecimiento fibroblástico (FGF), el factor de crecimiento insulínico (IGF), el factor de crecimiento endotelial vascular (VEGF) y el factor de crecimiento epidérmico (EGF) (13).
Los diferentes tipos de factores de crecimiento descritos en las plaquetas están expuestos en la Tabla 1. Su mecanismo de acción sobre las células es bastante similar, aunque pueden llegar a producir efectos biológicos opuestos en la misma (por ejemplo, PDGF y TGFß).
En el torrente circulatorio, la matriz extracelular se une a proteínas específicas (Binding-Proteins), que impiden su rápida degradación. De manera general los factores de crecimiento actúan a nivel de la membrana celular a través de receptores específicos; estos receptores se activan iniciando en el citoplasma una actividad de fosforilación de tipo tirosina-quinasa o serina treoninaquinasa, que activan rutas específicas de transducción de señal que se introducen posteriormente en el núcleo, para la expresión de genes específicos. El efecto final producido es multifuncional y va a depender de la célula diana y del estado fisiológico de la misma, de su relación con otras células, de la matriz extracelular y de la presencia de otros FC (14).
 |
 |
Plasma rico en plaquetas (PRP)
El estudio de los factores de crecimiento junto con el descubrimiento de su liberación por parte de las plaquetas, ha conducido al desarrollo de un concentrado de plaquetas autólogo, ideal para mejorar el proceso de cicatrización del tejido conectivo (15, 18,19). En 1997, Whitman (20) propuso algunas posibles aplicaciones del PRP como reconstrucciones mandibulares, procedimientos de elevación de seno, fisuras palatinas y procedimientos relacionados con la colocación de implantes. En 1998, Marx y cols. (21) refirieron la existencia de un incremento del número de plaquetas en este concentrado de un 338% con respecto a los niveles basales plaquetarios, mostrando la presencia de al menos tres factores de crecimiento PDGF, TGF-ß1 y ß2, refiriendo la existencia de receptores en el hueso para dichos FC. La utilización de este preparado junto con injerto óseo autógeno en reconstrucciones mandibulares demostró que producía una aceleración y aumento en la densidad del hueso formado a los 6 meses respecto del grupo control, valorado mediante radiografías panorámicas. La activación del PRP la realizaron mediante la adición al preparado de trombina bovina. En 1999, Anítua (6) refirió la utilización del PRGF en pacientes que presentaban enfermedad periodontal, susceptibles de tratamiento implantológico y en pacientes con fracturas verticales en dientes que se sustuirían mediante implantes unitarios, con resultados significativamente mejores, desde el punto de vista de la regeneración y maduración ósea con respecto al grupo control y además, estaría exento de riesgos para el paciente.
El PRP se define, por tanto, como el contenido en plaquetas en forma de sobrenadante tras la centrifugación de sangre anticoagulada (22). Se obtiene mediante plasmaféresis minutos antes de la intervención. Al ser un volumen de plasma extraído del propio paciente, no es tóxico ni inmunorreactivo para el mismo. Contiene una cantidad de plaquetas (1.000.000 plaq/mL en 5 mL) cinco veces mayor que la que se encuentra en la sangre normal (150.000 plaq/mL en 5 mL) (23).
Las plaquetas o trombocitos desempeñan un papel muy importante dentro del PRP, ya que constituyen la principal fuente de actividad mitógena en el plasma sanguíneo y van a funcionar como vehículo portador de FC y de otras proteínas que desempeñan un papel importante en la biología ósea, como son la fibronectina y otras proteínas adhesivas (15, 24). Se ha descrito que al iniciarse el proceso de cicatrización, cuando se forma el coágulo y las plaquetas se degranulan, éstas y otros FC son liberados. Es decir, que a mayor número de plaquetas en el foco de lesión, mayor liberación de estos factores (23).
Mecanismo de acción del PRP
La comprensión de las fases de regeneración tisular en el modelo cicatricial es esencial para entender los mecanismos de reparación ósea y de los beneficios que pueda tener el PRP en este proceso.
1. Momento de colocación: Al instante de producirse una herida, tienen lugar la adhesión y agregación plaquetaria. La activación de las plaquetas se realiza por la adhesión de las mismas al colágeno y otros componentes del subendotelio, o por la presencia de trombina. Se liberan en el proceso tromboxano A2 (Tx A2), adenosindifosfato (ADP) y serotonina que estimulan el reclutamiento y activación de las plaquetas circundantes, además de la expulsión de los gránulos, entre ellos, los gránulos a (14, 15). Por tanto, se produce una revascularización de la zona, la migración de células pluripotenciales, de células osteocomponentes y la mitogénesis de células osteoprogenitoras y fibroblastos. La cicatrización ósea comenzará por la liberación de FC en el injerto inmediatamente después de darse la ruptura de los gránulos plaquetarios. Los factores liberados son, principalmente, PDGF, TGF-ß e IGF (13, 25).
2. Primera semana: La acción iniciada por los FC liberados por las plaquetas será continuada a partir del tercer o cuarto día por los FC liberados por los macrófagos (15). Durante este tiempo comienza la angiogénesis a nivel de los capilares mediante la inducción de mitosis en las células endoteliales (1). La continua secreción de TGF-ß favorece la formación de matriz ósea y colágena formada por fibroblastos y osteoblastos respectivamente. El IGF, a su vez, actúa sobre los osteoblastos endoóseos, limitando así las trabéculas del hueso esponjoso injertado (15). Entre el quinto y el séptimo día, el PDGF atrae los macrófagos hacia el injerto (quimiotaxis). A partir de aquí, los procesos regenerativos serán estimulados por los FC derivados de los macrófagos (1).
3. Segunda y tercera semana: La actuación directa de los FC permite la mitogénesis de las células del canal medular y la angiogénesis capilar. Alrededor de los días 14 y 17, se puede ver la completa permeabilidad capilar del injerto. Estos capilares responden al gradiente de oxígeno con lo que, posteriormente a su difusión en el injerto, se establece un mecanismo inhibidor para prevenir una superangiogénesis.1 Se relaciona este momento con la fase I de la regeneración ósea, es decir, la aparición de tejido óseo trabeculado desorganizado, sin sistemas harvesianos (1, 26).
4. Cuarta a sexta semana: Revascularización del injerto y regeneración ósea casi completa. Desaparecerán los macrófagos y se iniciará el proceso de reabsorción y reposición. Se produce en este punto la liberación de BMP y IGF, proteínas que llevarán a cabo secreción de matriz ósea (1, 25). Este proceso definirá una arquitectura ósea madura con sistema Harvesiano característico del hueso de fase II, autosustentado (1, 26).
Protocolo para la obtención del PRP
El PRP es obtenido de la sangre autógena a través de un proceso que utiliza el principio de la separación celular por centrifugación diferencial, en el cual se extrae sangre del donante, se separan las distintas fases y se obtienen aquellas de mayor interés según el caso (1, 27). Los avances tecnológicos han permitido reducir la extracción sanguínea a una cantidad mucho más manejable (13). Así conseguiremos de 6 a 12 ml de PRP desechando la sangre no utilizada, ya que es innecesaria la reinfusión y está contraindicada su reutilización en el gabinete dental (26).
 |
 |
Actualmente hay varios aparatos para la obtención de PRP en la clínica dental, siendo el Smart PRP y el 3i Platelet Concentrate Collection System los únicos aceptados por la FDA para la producción de PRP (28, 29).
De manera sistemática el método de obtención de PRGF propuesto por el doctor Anitua es el siguiente (15):
Punción venosa: Se realiza la extracción de sangre al paciente de la región antecubital, unos minutos antes de comenzar la cirugía (30).
Obtención de la sangre: Se utilizan tubos estériles con citrato sódico a 13,8 % como anticoagulante (4 tubos de 5 cc de sangre = 20 cc de sangre).
Separación celular: La fase de centrifugación debe ser realizada por un profesional para permitir la obtención de la máxima concentración de las plaquetas por unidad de volumen, sin la rotura de las mismas. Se centrifuga el plasma con un equipo digital que nos va a garantizar que los parámetros de tiempos y velocidad son los adecuados (8 minutos, a una velocidad de centrifugación de 1.700 r.p.m. a temperatura ambiente o bien 1.200 r.p.m. durante 10 minutos) (12, 14). La separación de los elementos de la sangre después del proceso de centrifugación se da en función de la densidad, de mayor a menor (15).
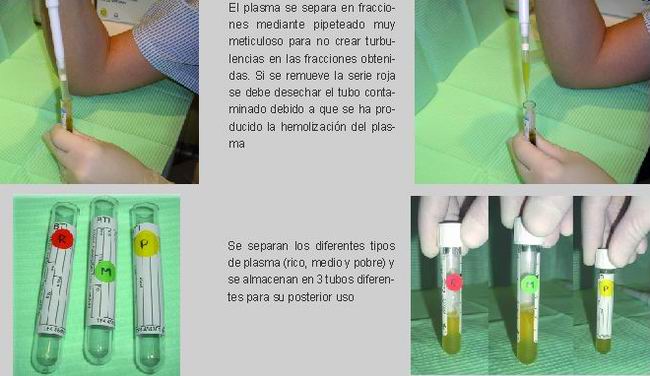
Pipeteado: El plasma se separa en fracciones mediante pipeteado muy meticuloso para no crear turbulencias en las fracciones obtenidas. Si se remueve la serie roja se debe desechar el tubo contaminado debido a la hemolización del plasma. Los primeros 0,5 cc corresponden a un plasma pobre en plaquetas y por tanto pobre en FC (fundamentalmente para formar membranas o mallas de fibrina). Los siguientes 0,5 cc corresponderán a un plasma con un número de plaquetas similar al que tiene la sangre periférica. La fracción de plasma rico en plaquetas son los 0,5 cc inmediatamente encima de la serie roja (15)
Formación del coágulo: Una vez que tenemos la fracción de PRP, para provocar la formación del coágulo añadimos 0,05 cc de cloruro cálcico al 10% por cada cc de PRP y entre 5 y 8 minutos se nos formará el coágulo (15). Si cogemos las dos primeras fracciones y las añadimos también cloruro cálcico obtenemos fibrina autóloga que se puede utilizar como membrana o tapón hemostático, dado su alto poder cicatrizante (11).
Fase quirúrgica: Una vez obtenido el PRP, éste ya puede aplicarse al lecho mezclado con un material de injerto o bien utilizarse sin mezclar, y se puede aplicar en el lecho activándolo o no previamente (27). La fase de fibrina sobrante en el tubo de ensayo puede emplearse para la obtención, una vez coagulada la fibrina, de una auténtica membrana reabsorbible que se puede aposicionar a modo de barrera entre el material injertado y los tejidos blandos, pero su estabilidad es variable y se reabsorbe muy rápidamente (1,15).
Utilización del PRP en la clínica dental
En la literatura podemos encontrar numerosos trabajos en los que los resultados obtenidos son beneficiosos (31):
Aplicaciones en cirugía dentoalveolar
Un estudio español presentado por Anitua en 1999 muestra su experiencia con la curación alveolar mediante PRP y sin él. Evaluando la epitelización con sonda periodontal y con fotografías y valorando la curación ósea con biopsia a las 4 semanas se demostró que las características óseas eran mejores en el grupo PRP que en el control (6, 7).
Mancuso y cols. (32) analizaron el PRP como prevención de la alveolitis seca después de la exodoncia de terceros molares. Observaron una mejor hemostasia, un mejor aspecto del colgajo, menor dolor según escala análogo-visual, y una menor incidencia de alveolitis seca.
Della Valle y cols. (33) aplicaron gel de PRP en 40 pacientes sometidos a cirugía oral y anticoagulados por presentar valvulopatía de base: 5% presentaron complicaciones hemorrágicas y el 40% sangrado leve que se trató con medidas hemostáticas locales.
Aplicaciones en periodoncia
Okuda y Kawase (34, 35) demuestran la elevada concentración de PDGF y TGF-beta en el PRP, observando un estímulo en la síntesis de ADN en los fibroblastos gingivales y en células del ligamento periodontal, así como su capacidad reguladora de la síntesis de colágeno en la matriz extracelular.
De Obarrio y cols. (36) incorporan el PRP a un aloinjerto de hueso combinado con técnicas de regeneración tisular guiada (RTG) para tratar defectos intraóseos, observando una ganancia significativa en la inserción clínica y en el relleno óseo en los controles a los 2 años.
Otros estudios han utilizado el PRP o el gel de fibrina en el manejo de defectos de recesión gingival (37, 38) aisladamente o en combinación con diferentes técnicas de regeneración ósea guiada y distintos biomateriales como terapias combinadas.
Aplicaciones en implantología
Kim y cols. (39) realizaron un experimento para observar las diferencias en cuanto a la reparación de defectos óseos alrededor de los implantes de titanio con el uso de hueso liofilizado en un grupo de perros, hueso liofilizado + PRP en un segundo grupo y un tercer grupo control. Los resultados obtenidos fueron la aparición de hueso nuevo alrededor de los implantes tanto en el primer como en el segundo grupo y un mayor porcentaje de contacto hueso-implante en el grupo tratado con hueso liofilizado y PRP respecto a los otros dos grupos.
Posteriormente, en un estudio realizado por Werner y cols. (40), se investiga la influencia del PRP en la cicatrización temprana, al ser aplicado durante la inserción de los implantes dentales obteniendo como resultado que el PRP presenta un efecto dependiente del tiempo y del lugar de colocación en la cicatrización alrededor del implante, ya que el mayor contacto implante-hueso se obtuvo durante las primeras semanas y en la zona de directa aplicación del concentrado plaquetario.
Anitua (6) usó el PRP en la preparación de lechos alveolares para futuros implantes. En los alveolos a los que añadió PRP observó una mayor anchura ósea bucolingual/palatina, una mayor densidad ósea y una cobertura tisular más rápida que en los controles.
Kassolis y cols. (41, 42) han publicado los resultados de 14 injertos sinusales y 3 aumentos del reborde maxilar previos a la colocación de implantes, utilizando PRP con aloinjertos de hueso liofilizado, apreciando en los cortes histológicos numerosas zonas de formación osteoide y hueso alrededor de las partículas de aloinjerto de hueso liofilizado, sin indicios de infiltrado celular inflamatorio.
Gabor y cols. (43) trataron de determinar los efectos de los FC liberados del PRP en relación al aumento de contacto implante-hueso, concluyendo que el PRP puede aumentar la anchura del hueso cortical alrededor del implante.
Aunque existen múltiples estudios que han demostrado un efecto beneficioso en la utilización del Plasma Rico en Plaquetas, otros muestran unos resultados menos alentadores (42, 44, 45).
Aplicaciones en la elevación de seno
Estas aplicaciones derivan de su efecto adhesivo sobre el material injertado. No se ha podido demostrar que posea un efecto osteoinductor intrínseco sobre los biomateriales síntéticos (31).
En las elevaciones de seno con hueso autogéno y PRP, Jakse y cols. (46) observaron una mejora del 3-4% en la formación de hueso en un estudio sobre 12 ovejas.
También existen varios estudios de elevaciones de hueso con biomateriales en humanos. Forum (42), efectuó un estudio en 3 pacientes efectuando una elevación de seno bilateral (hueso bovino desmineralizado versus hueso bovino desmineralizadon + PRP). Las muestras biópsicas no observaron diferencias significativas entre ambos lados. Un año después, Wiltfang (47) efectuó un estudio con TCP sólo, o TCP+PRP, afirmando una neoformación ósea un 10% superior en el grupo con adición de PRP.
Rodríguez y cols. (48) llevaron a cabo elevaciones sinusales con la utilización de Bio-Oss y Plasma Rico en Plaquetas junto con la inserción de implantes dentales. Los resultados obtenidos fueron muy positivos.
Aplicaciones como adhesivo tisular
Tiene la capacidad de sellado tisular, hemostasia y promoción de la curación tisular (20). Se ha utilizado para cohesionar injertos óseos o biomateriales particulados, como membrana biólogica o en forma de spray para aumentar la adhesividad de colgajos cutáneos o mucosos al lecho receptor (24).
Aplicaciones en cirugía de los tejidos blandos
Ha sido utilizado en cirugía estética (ritidectomías, blefaroplastias y en otras cirugías de colgajo) como adhesivo tisular para favorecer y modular la curación en los colgajos cutáneos repuestos. Los autores hablan de una mejor curación de las heridas, de la eliminación de espacios muertos, obviando así la necesidad de utilizar drenajes aspirativos, o de emplear suturas cutáneas (25, 49). Las líneas de incisión presentan menos eritema e inflamación y una curación más rápida que los controles.
Riesgos con el uso de PRP
Los concentrados de PRP han sido ampliamente utilizados en la última década como complemento en las técnicas de regeneración de tejidos. No existe riesgo alguno de infección ni transmisión de enfermedades. Sin embargo, se ha relacionado la sobreexpresión de factores de crecimiento y sus receptores en tejidos tumorales y displásicos, lo cual hace pensar en dos posibles peligros: la carcinogénesis y la posibilidad de favorecer la metástasis (13, 14).
Carcinogénesis
Los FC juegan un papel fundamental en la estimulación y regulación de la curación de heridas, y parecen regular diversos procesos celulares, como son la mitogénesis, quimiotaxis, diferenciación y el metabolismo celular (1). A pesar de los buenos resultados del PRP, la evidencia científica muestra también de forma experimental que los factores de crecimiento encontrados en las plaquetas (PGFs) aparecen sobreexpresados en los tejidos tumorales. Este incremento se debe a alteraciones de genes codificadores de los receptores y no como consecuencia de la sobreproducción de GFs (14). Los concentrados terapéuticos de GFs como el PRP podrían actuar, más que como iniciadores, como promotores en la carcinogénesis, pero este fenómeno necesitaría de dosis mayores y más continuadas en el tiempo que las que se aplican en la terapéutica convencional (50). Se debe tener en cuenta que los GFs extracelulares se degradan a los 7-10 días (14).
Metástasis
Las plaquetas recubren las células tumorales, facilitando su supervivencia y adhesión a las paredes vasculares y favoreciendo su permeabilidad vascular, lo que permite la penetración tumoral en el tejido perivascular, mediado principalmente por el VEGF (Vascular Epidermal Growth Factor). Además, las células tumorales facilitan la agregación plaquetaria liberando el VEGF de las plaquetas que necesitan para su invasión tisular. Este fenómeno es necesario tenerlo en cuenta en el caso de que se aplicara el PRP en las vecindades de un tumor con capacidad metastatizante (14).
En cualquier caso, la revisión de la literatura no ha permitido aportar evidencias científicas que relacionen la aplicación terapéutica de PRP con la transformación carcinomatosa de tejidos normales o displásicos. Se proponen una serie de medidas de prevención de los posibles riesgos:
— Realizar técnicas de obtención de PRP de una sola centrifugación, para obtener la mínima dosis efectiva (13).
— Evitar la utilización de PRP en pacientes con condiciones precancerosas orales (leucoplasia oral, eritroplasia o queilosis solar) ni en su proximidad (13).
— Evitar la aplicación de PRP en el “campo de cancerificación” de pacientes con exposición previa a carcinógenos o antecedentes de COCE (Carcinoma Oral de Células Escamosas) primario (13).
— Poco recomendable utilizar el PRP en pacientes fumadores y/o bebedores, puesto que están expuestos a potentes agentes mutágenos y tienen por ello una mayor probabilidad de que existan células iniciadas en el proceso de la carcinogénesis (14).
Discusión
El PRP ha sido ampliamente utilizado en la última década como complemento en las técnicas de regeneración de tejidos. Desde los comienzos de la investigación con dicho producto, se han publicado numerosos trabajos con óptimos resultados en la aplicación del mismo, pero también hay otros que indican que el empleo de PRP puede no ser tan efectivo. En lo que sí parecen concordar es en la mejora visible de la cicatrización de los tejidos blandos y una mayor cohesividad en los injertos particulados, que facilita su manipulación.
Estudios a favor del PRP
Como hemos visto anteriormente, son numerosos los estudios en los que diversos autores defienden el PRP en cirugía dentoalveolar, periodoncia, implantología, en elevaciones de seno, como adhesivo tisular… Destacando sus cualidades como la capacidad reguladora de la síntesis de colágeno en la matriz extracelular (34, 35), en el manejo de defectos de recesión gingival (37, 38), reparación de defectos óseos alrededor de implantes (39) al igual que una mejora en la cicatrización (40).
Anitua y cols. (6) emplearon PRP en el tratamiento de defectos óseos postextracción con el objetivo del emplazamiento de futuros implantes, observando una mayor densidad ósea y una cobertura tisular más amplia en los casos en los que se había utilizad PRP. Al tener en cuenta la posibilidad de asociarlo a injertos de hueso tanto autólogo como heterólogo, la literatura arroja datos bastante optimistas.
Kassolis y cols. (51) publicaron un estudio en el que llevaron a cabo un aumento del reborde alveolar y elevaciones sinusales utilizando PRP y hueso liofilizado aloplástico llegando a la conclusión de que la utilización de hueso liofilizado junto al PRP es una alternativa terapéutica viable si se quiere utilizar como futuro emplazamiento de implantes.
En un trabajo publicado por Freymiller y cols. (52) en el que se hace una revisión de toda la literatura sobre el PRP que hay hasta el año 2004, analizando todas las posibles combinaciones de PRP (con hueso autólogo, con hueso mineral anorgánico y con hueso mineral orgánico e incluso solo), concluye que la literatura en este campo está en un periodo prematuro, y conflictivo y todavía hay áreas desconocidas en las que se deberá seguir investigando al respecto.
Estudios en contra del PRP
Aunque los resultados de los estudios en los que se han utilizado hueso autólogo para combinar el PRP parecen muy prometedores, otros indican que el empleo de PRP puede no ser tan efectivo. Estas discrepancias en los distintos estudios pueden explicarse por la posibilidad de aparición de grandes diferencias en la concentración de los FC según el método de obtención del producto empleado (1).
Choi y cols. (53) vieron, in vitro, cómo concentraciones progresivas de FC mermaban la capacidad regenerativa de los autoinjertos. Parece ser que, en concentraciones progresivas de un 1 a un 5%, el efecto del PRP radica en un incremento de la viabilidad y proliferación celular. En porcentajes superiores, el efecto se invierte y llega a inhibir el potencial regenerativo del injerto autólogo. Parece ser que sólo en concentraciones de hasta un 5% el PRP tendría su valor como inductor de la regeneración tisular.
Arpornmaeklong y cols. (54), por otro lado, estudian la aparente relación que existe entre la presencia del PRP y la regulación ósea efectuada por la fosfatasa alcalina, viendo como el PRP inhibe la acción de la fosfatasa alcalina de forma dosis-dependiente: a mayor concentración del PRP, se inhibiría pues la diferenciación osteoblástica y aumentaría la proliferación de células preosteoblásticas, pero a bajas concentraciones no se ve un marcado efecto en la proliferación o diferenciación celular, con lo que el PRP tendría un comportamiento bimodal en función de la concentración.
Butterfield y cols. (46), en un estudio en el que utilizaron PRP e injerto de hueso autógeno para elevaciones sinusales en 12 conejos vieron que no había incremento significativo en la regeneración ósea, en su histología o en la densidad. En todos ellos se aplicaron injertos de cresta ilíaca para realizar elevaciones sinusales bilaterales que se combinaron con PRP obtenido a partir de 21 cc de sangre autóloga. Los resultados no mostraron diferencias estadísticamente significativas entre los casos y los controles, e incluso se observaron resultados más deficientes en los controles.
Mark y cols. (55) refieren falta de eficacia en asociación con injertos óseos. En un artículo publicado sobre qué es PRP y qué no es PRP pone en entredicho que el PRP pueda estimular la regeneración ósea cuando este se combina con sustitutos óseos o materiales no celulares ya que el papel fundamental del PRP es mitogénico, es decir, estimular las células involucradas en la reparación de las heridas.
Conclusiones
Una revisión crítica de la literatura existente sobre el PRP y sus aplicaciones clínicas permite extraer una serie de conclusiones que se pueden resumir de la siguiente forma:
— Eficacia del PRP en una serie de aspectos que facilitan la cirugía como son la disminución del sangrado intra y postoperatorio, una cicatrización más rápida de los tejidos blandos con una menor reacción inflamatoria, y una mejor estabilidad inicial del tejido injertado en el área receptora debido a sus propiedades de adhesivo tisular.
— Al ser un volumen de plasma extraído del propio paciente, no es tóxico ni inmunoreactivo para el mismo.
— Sus indicaciones son variadas: aplicaciones en cirugía dentoalveolar, periodoncia, implantología, elevación de seno, como adhesivo tisular, en cirugía de tejidos blandos, traumatología y ortopedia…
— Necesario realizar técnicas de obtención de PRP de una sola centrifugación para así obtener la mínima dosis efectiva. A su vez, el PRP debe emplearse en un periodo de tiempo corto para que los FC no pierdan su función.
— Debemos evitar la utilización de PRP en pacientes con condiciones precancerosas orales y en fumadores y/o bebedores debido a la exposición frente a potentes agentes mutágenos y una mayor probabilidad de que existan células iniciadas en el proceso de la carcinogénesis.
Bibliografía
1. Beca T, Hernández G, Morante S, Bascones A. Plasma rico en plaquetas. Una revisión bibliográfica. Avances en Periodoncia Vol.19, n.º 1. Madrid, abril 2007.
2. Anitua E. Factores de crecimiento plasmático. Una revolución terapéutica. Ideas y Trabajos Odontoestomatológicos. 2001; 2: 90-4.
3. Anitua E. Implant Surgery and prosthesis: A new perspective. Vitoria: Puesta al día publicaciones. 1998.
4. Soffer E, Ouhayoun JP, Anagnostou F. Fibrin sealants and plateled preparations in boneand periodontal healing. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2003; 95: 521-8.
5. Bowen A. y cols. Técnicas quirúrgicas avanzadas para la regeneración ósea en implantología. Gaceta dental. 2002; 128: 36-60.
6. Anitua E. Plasma rich in growth factors: Preliminary results of use in the preparation of future sites for implants. Int J Oral Maxillofac Implants. 1999; 14: 529-35.
7. Anitua E. The use of plasma-rich growth factors (PRGF) in oral surgery. Pract Proced Aesthet Dent. 2001; 13: 487-93.
8. Valbonesi M, Giannini G, Migliori F, Dalla Costa R, Galli A. The role of autologous fibrin-platelet glue in plastic surgery: A preliminary report. Int J Artif Organs. 2002; 25: 334-8.
9. Bhanot S, Alex JC. Current applications of platelet gels in facial plastic surgery. Facial Plast Surg. 2002; 18: 27-33.
10. Sonnleitner D, Huemer P, Sullivan DY. A simplified technique for producing platelet-rich plasma and platelet concentrate for intraoral bone grafting techniques: A technical note. Int J Oral Maxillofac Implants. 2000; 15: 879-82.
11. Velilla M. y cols. Recuerdo y actualización de las técnicas en Regeneración ósea para el práctico general. A propósito de dos casos. Gaceta Dental. 2002; 127: 52-63.
12. Gonshor A. Técnicas para producir plasma rico en plaquetas y concentrado plaquetario: Antecedentes y proceso. Revista Internacional de Odontología Restauradora y Conservadora. 2002; 6: 583-93.
13. García García V, Corral I, Bascones Martínez A. Plasma rico en plaquetas y su utilización en implantología dental. Av Periodon Implantol. 2004; 16: 81-92.
14. Martínez JM, Cano J, Gonzalo JC, Campo J, Esperanza GC, Seoane JM. ¿Existen riesgos al utilizar los concentrados de plasma rico en plaquetas (PRP) de uso ambulatorio? Medicina Oral. 2002; 7: 375-90.
15. Anitua E. Un nuevo enfoque en la regeneración ósea. Plasma rico en factores de crecimiento (P.R.G.F). Editorial: Puesta al día publicaciones, S.L. 2000 Vitoria-España.
16. Martín Villa L. Técnicas de injerto en el seno maxilar y su aplicación en impantología. 1ª Ed. Barceona: MASSON. 2006.
17. Lakey LA, Akella R, Ranieri JP. Angiogenesis: implications for tissue repair. In: Davies JE (eds.) Bone engineering. Toronto: Em squared Editores 2000.
18. Papli R, Chen S. Surgical treatment of infraorbitary defects with autologous plateled concentrete or bioabsobable barrier membrana: A prospective case series. J Periodontol. 2007; 78: 185-93.
19. Romo-Simón L. y cols. Plasma rico en factores de crecimiento óseo en quistes maxilares y sobre implantes. Resultados preliminares. RCOE. 2001; 6: 48.
20. Whitman DH, Berry R, Green D. Platelet gel: An autologous alternative to fibrin glue with applications in oral and maxillofacial surgery. J Oral Maxillofac Surg. 1997; 55: 1294-9
21. Marx R, Carlson E, et al. Platelet-rich plasma. Growth factors enhancement for bone grafts. Oral Surg Oral Med Oral Pathol. 1998; 85: 638-46.
22. Dugrillon A y cols. Autologous concentrated platelet-rich plasma (cPRP) for local application in bone regeneration. Int. J. Oral Maxillofac.Surg. 2002; 31: 615-9.
23. Gómez Martín B, Becerro de Bengoa R, Losa M, Sánchez Gómez R. Plasma rico en factores de crecimiento (PRGF). Revista Internacional de Ciencias Podológicas. 2007; 1: 7-10.
24. García De La Fuente A, Cundin E, Aguire J. Actualización sobre el uso de factores de crecimiento y proteínas en el tratamiento regenerativo periodontal. Periodoncia y Osteointegración. 2000; 10: 27-36.
25. Marx RE. Platelet rich plasma: Evidence to support its use. J Oral Maxillofac Surg. 2004; 62: 489-96.
26. Peñarrocha M, Sanchis JM., Martinez JM. Factores de crecimiento y proteínas que influyen en el crecimiento óseo: Aplicaciones en implantología oral. Periodoncia. 2001; 11: 205-16.
27. Marx RE. Platelet-Rich Plasma: A source of multiple autologous growth factors for bone grafts. Tissue Engeneering: Aplicationns in Maxillofacial Surgery and Periodontics. Editorial: Quintessense Books.1999, Illinois -Estados Unidos.
28. Sánchez A. y cols. Is platelet-rich Plasma the Perfect Enhacement Factor? A current Review. Int J Oral Maxillofac Implants. 2003; 18: 93-103.
29. Meraw S. y cols. Treatment of Peri-Implant Defects With Combination Growth Factor Cement. J Periodontol. 2000; 71: 8-12.
30. Petrungaro P. Treatment of the infected Implant Site Using Platelet-Rich Plasma. Compendium. 2002; 23: 363-76.
31. González Lagunas J. Plasma rico en plaquetas. Rev Esp Cirug Oral y Maxilofac. 2006; 2: 28.
32. Mancuso, Bennion, Hull. Platelet rich plasma: A preliminary report in routine impacted third molar surgery and the prevention of alveolar osteitis. J Oral Maxillofac Surg. 2003; 61: 36.
33. Della Valle A, Sammartino G, Marenzi G, Tia M, Espedito A, Ferrari F, Lo Muzio L. Prevention of postoperative bleeding in anticoagulated patients undergoing oral surgery: use of platelet rich plasma. J Oral Maxillofac Surg. 2003; 61: 1275-8.
34. Okuda K, Kawase T, Momose M, Murata M, Saito Y, Suzuki H, Wollf LF. Platelet rich plasma contains high levels of platelet derived growth factors and transforming growth factor beta and modulates the proliferation of periodontal related cells in vitro. J Periodontal. 2003; 74: 849-57.
35. Kawase T, Okuda K, Wolff LF, Yoshie H. Platelet rich plasma derived fibrin clot formation stimulates collagen synthesis in periodontal ligament and osteoblastic cells in vitro. J Periodontol. 2003; 74: 858-64.
36. De Obarrio JJ, Aruz Dutari JI, Chamberlain TM, Croston A. The use of autologous growth factors in periodontal surgical therapy: Platelet gel biotechnology case reports. Int J Periodontics Restorative Dent. 2005; 20: 487-97.
37. Petrungaro PS. Using platelet rich plasma to accelerate soft tissue maturation in esthetic periodontal surgery. Compend Contin Educ Dent. 2001; 22: 729-36.
38. Camargo PM, Lekovic V, Weinlander M, Vasilic N, Madzarevic M, Kenney EB. Platelet rich plasma and bovine porous bone mineral combined with guided tissue regeneration in the treatment of bony defects in humans. J Periodontol Res. 2002; 37: 300-6.
39. Kim S. y cols. Use of Particulate Dentin-Plaster of Paris Combination with/without Platelet-Rich Plasma in the treatment of bone defects around implants. Int J Oral Maxillofac Implants, 2002; 17: 86-94.
40. Zechner W. y cols. Influence of Platelet-rich Plasma on Osseous Healing of Dental Implants: A histologic and Histomoorphometric Study in minipigs. Int J Oral Maxillofac Implants, 2003; 18: 15-22.
41. Nathan E., Rober B. Platelet-rich plasma. Clinical aplications in dentistry. JADA. 2002; 133: 1383-6.
42. Froum S. y cols. Efecto del plasma rico en plaquetas sobre el crecimiento óseo y la osteointegración en injertos de seno maxilar en seres humanos: Tres informes de casos bilaterales. Int J Periodontics Restorative Dent, 2002; 22: 45-53.
43. Fuerst G. y cols. Enhanced Bone-to- Implant Contact by Plateled-released Growth Factors in Mandibular Cortical Bone: A histomorphometric Study in minipigs. Int J Oral Maxillofac Implants. 2003; 18: 685-90.
44. Fuerst G. y cols. Sinus grafting with autogenous platelet-rich plasma and bovine hydroxyapatite: A histomorphometric study in minipigs. Clin. Oral Impl. Res. 2003; 14: 500-8.
45. Shanaman R. y cols. Aumento localizado de la cresta utilizando ROG y plasma rico en plaquetas: Casos clínicos. Int J Periodontics Restorative Dent. 2001; 21: 345-55.
46. Butterfield KJ, Bennet J, Gronowitz G. Effect of platelet rich plasma with autogenous bone grafts for sinus augmentation in a rabbit model. J Oral Maxillofac Surg. 2005; 63: 370-6.
47. Wiltfang J, Schlegel KA, Schultze-Mosgau S, Nkenke E, Zimmerman R, Kessler P. Sinus floor augmentation with beta-tricalciumphosphate: Does platelet rich plasma promote its osseous integration and degradation? Clin Oral Implants Res. 2003; 14: 213-8.
48. Rodríguez A. y cols. Maxillary Sinus Augmentation with Deproteinated Bovine Bone and Platelet Rich Plasma with simultaneous insertion of endosseous implants. J Oral Maxillofac Surg. 2003; 61: 157-63.
49. Hom DH, Manivel JC. Promoting healing with recombinant human platelet derived growth factors-BB in a previously irradiated problem wound. Laryngoscope. 2002; 113: 1566-71.
50. Reddel RR. The role of senescence and immortalization in carcinogenesis. Carcinogenesis 2000; 21: 477-84.
51. Kassolis JD, Rosen PS, Reynolds MA. Alveolar ridge aumentation utilizing platelet-rich plasma in combination with freeze-dried bone allograft: Case series. J Periodontol. 2000; 71: 1654-61.
52. Freymiller EG, Aghaloo TL. Platelet rich plasma: Ready or not? J Oral Maxillofac Surg. 2004; 62: 484-8.
53. B-H Choi, S-J Zhu, B-Y Kim, J-Y Huh, S-H Lee, J-H Jung. Effect of platelet-rich plasma (PRP) concentration on the viability and proliferation of alveolar bone cells: An in vitro study. Int J Oral Maxillofac. Surg 2005; 34: 420-4.
54. Arpornmaeklong P, Kochel M, Depprich R, Kübler NR, Würzler KK. Influence of platelet-rich plasma (PRP) on osteogenic differentation of rat bone marrow stromal cells. An in vitro study. Int. J. Oral Maxillofac Surg 2004; 33: 60-70.
55. Marx RE. Platelet rich plasma (PRP): What is PRP and what is not PRP? Implant Dent. 2001; 10: 225-8.




