En cirugía implantológica nos enfrentamos cada vez más al tratamiento de defectos óseos; si el defecto óseo es extenso debemos usar una técnica osteoinductiva. Todas las técnicas regenerativas salvo el injerto autógeno carecen de la capacidad de cicatrización y de ofrecer un resultado predecible y es, ademas, la única inmunológicamente y biológicamente superior.
Para obtener los injertos usamos medios manuales, rotatorios, oscilovibrantes y recientemente medios ultrasónicos.
La técnica ultrasónica reduce el riesgo de usar instrumental rotatorio, mejora la visión del campo quirúrgico y produce un corte más conservador y predecible.
Se trata de una técnica atraumática, no daña los tejidos blandos vecinos y conlleva una gran visibilidad, hemostasia y buen postoperatorio.
Muchos de los instrumentos usados en la actualidad son modificaciones de instrumentos quirúrgicos muy antiguos, como sierras, cinceles y escoplos.
Hoy en día debemos disponer de instrumentos diseñados específicamente para la cirugía ósea, teniendo en cuenta las especiales condiciones del campo oral, pequeño, a veces con acceso complicado.
Cirugía piezoeléctrica
La cirugía piezoeléctrica es una técnica novedosa en el campo de la cirugia ósea, desarrollada en los años ochenta.
Derivada del concepto básico de piezoelectricidad descubierto por jacques y Pierre Curie a finales del siglo XIX. Horton ya publicó en 1975 la posibilidad de cortar hueso con ultrasonidos.
El efecto piezoeléctrico clásico se debe a una diferencia de potencial superficial sobre una superficie cristalina, anisotrópica por aplicación directa de una compresión mecánica (efecto piezoeléctrico directo).
El efecto piezoeléctrico recíproco usado por estos aparatos provocan deformaciones en estos materiales de micrómetros, al exponerse a un campo eléctrico intenso, transmitiendo esas deformaciones a una punta cortante, que vibra en amplitudes de 300 µm.
La técnica quirúrgica es asistida por una frecuencia ultrasónica modulada que produce un corte preciso y seguro del hueso. La punta corta selectivamente los tejidos mineralizados sin lesionar el tejido blando. Por tanto disminuye mucho el riesgo de lesionar vasos o nervios durante el tallado del hueso.
La punta trabaja entre un flujo continuo e intenso de suero salino lo que, además de disminuir la temperatura, limpia constantemente el lecho quirúrgico mejorando la visión del campo operatorio. Por tanto ofrece confort, seguridad.
Precisa de entrenamiento para manejar la presión que hay que hacer con el instrumento y la vibración de la punta.
 |
La cirugía ultrasónica se basa en tres principios:
1. Corte preciso debido a la amplitud de movimiento de la punta, tan sólo de 60 a 200 µm horizontalmente y de 20 a 60 µm verticalmente. La eficiencia de corte es de 0,31mm por segundo.
2. Corte selectivo ya que la frecuencia de vibración de 22 a 30 khz corta sólo tejido mineralizado.
3. Campo libre de sangre debido al efecto de cavitación que produce la punta en el lecho quirúrgico.
Consideraciones de tratamiento y utilización
El aumento de temperatura en el lecho quirúrgico está fuera del rango de lesión ósea clínica. El grado de lesión ósea por la temperatura es directamente proporcional a la temperatura en el sitio quirúrgico y el tiempo durante el que la temperatura ha aumentado.
En diversos estudios se ha comprobado que a 41º C. se produce una hiperemia, cesando la perfusión sanguínea a 47º C. Eriksson observó una necrosis ósea a 0,5 mm de un aumento de temperatura a 47 C durante un minuto. Por tanto se deben evitar aumentos de más de 7 grados durante más de un minuto.
Los aparatos de cirugía ultrasónica aumentan como máximo 3 grados ºC, medido in vitro, a una profundidad de 3 mm en hueso cortical.
Esto in vivo puede ser diferente debido a que en función del sitio operatorio o la profundidad del corte, el liquido salino puede llegar menos y aumentar más la temperatura.
El diseño de la punta de trabajo influye totalmente en los resultados. A mejor calidad de la punta, más eficiencia de corte y menor lesión ósea. La mayoría de las puntas de trabajo están recubiertas de nitruro de titanio para aumentar su eficiencia.
En la unidad que nosotros usamos existe una modificación técnica consistente en un modo a ráfagas en el que se produce un efecto martillo, mejorando el corte en el hueso más cortical, reduciendo el tiempo de trabajo.
Igualmente la función de sintonización automática se ajusta a la frecuencia de vibración más adecuada al detectar el tipo de punta, la vibración y el estatus de carga al cortar.
Existen tres tipos de uso, cirugía periodontal, endodóntica y ósea.
Nuestra unidad cuenta con iluminación en la pieza de mano, produciendo una iluminación uniforme en la zona de tratamiento muy útil en zonas de complicado acceso.
La frecuencia de trabajo es de 28-32 KHz.
El flujo de la bomba de suero es muy alto, de 10 a 85 ml por minuto, lo que hace que, usado a la mayor capacidad de flujo, sea necesario cambiar frecuentemente la botella de suero. Tenemos que estar atentos a este hecho ya que al acabarse el suero se puede producir una elevación importante de la temperatura y al mismo tiempo disminuye la eficiencia de corte.
Existen distintos diseños de punta para la cirugía ósea. Algunos de ellos se muestran en esta imagen. Son muy útiles los de corte acodado, a derechas e izquierdas para simplificar el acceso. Igualmente presentan marcas para la profundidad de corte.
Biología de los injertos
Como casi todo en ciencias de la salud, una comprensión profunda de los hechos biológicos es la mejor garantía de resultados.
Para ello haremos un breve resumen del proceso reparativo óseo.
Mientras casi todos los tejidos muestran una limitada capacidad de regeneración (formación de cicatrices), el hueso está en un constante estado de regeneración y reemplazamiemto. Cuando se produce una lesión ósea o realizamos un transplante (injerto ) óseo, utiliza este proceso para reconstituirse.
Dependiendo de su origen embriológico existen dos tipos de hueso:
1. Membranoso (las células osteoprogenitoras,COP se diferencian en osteoblastos directamente, luego a osteocitos; por ejemplo la mayoría de los huesos del cráneo). En este caso las MSC (células mesenquimales) de la membrana son las que se diferencian directamente en osteoblastos y forman material osteoide y hueso compacto ( tiene poca medular).
2. Endocondral (las COP se diferencian en condroblastos y siguiendo un modelo cartilaginoso en condroblastos, condrocitos, osteoblastos, osteocitos; la mayoría de los huesos largos). En este último caso la matriz cartilaginosa se calcifica a través de un proceso de invasión vascular que aporta células mesenquimales indiferenciadas que se transforman en osteoblastos, produciendo material osteoide, mineralizándose en forma de trabéculas, estas se organizan en hueso compacto.
La secuencia de hechos que tienen lugar después del injerto varía en función del tipo de hueso, el grado de vascularización y el estado del lecho receptor.
En primer lugar se forma un hematoma. En los injertos no vascularizados se produce una necrosis y comienza una reacción inflamatoria. Probablemente la mayoría de los osteocitos mueren (sólo serán viables aquellos situados a menos de 100 micras de un vaso, siendo la distancia crítica de 300 micras). Los osteoblastos endostales y las MSC sobreviven por circulación plasmática en los primeros 3-5 días. El hematoma se organiza en un estroma fibrovascular y el tejido conectivo del lecho envía vasos al interior del injerto, a través de los canales de Havers y Wolksmann aportando células mesenquimales a partir del quinto día.
Se produce una colonización por osteoclastos que aumentan la porosidad, disminuyen la masa del injerto y por tanto, ojo, su capacidad de resistir fuerzas. A su vez esto permite que entren más osteocitos que fabriquen material osteoide, compensando la pérdida.
La incorporación de los injertos corticales consiste parcialmente en la producción de hueso nuevo y en la persistencia de zonas necróticas, parcialmente reabsorbidas que, aunque no son viables, forman parte definitivamente del injerto remodelado (pensar a nivel microscópico).
Los injertos esponjosos se vascularizan más y más precozmente como resultado de anastomosis termino-terminales con vasos del lecho receptor y por invasión de yemas capilares.
De una manera resumida los tres procesos por los que se lleva acabo la reconstitución ósea son:
1. El proceso de invasión de tejido vascular en el injerto, llevando MSC, que se transforman en osteoblastos y modulado por los osteoclastos se ha llamado creeping substitution es el equivalente a la osteoconducción. (existe un armazón que se coloniza).
2. Osteogénesis, producción de hueso a partir de los afortunados osteocitos supervivientes.
3. Osteoinducción, la capacidad de porciones de hueso de actuar como inductores locales de formación de osteoblastos, a través de la liberación de factores tales como las BMP que estimularán células en el lecho receptor que invaden el injerto y que desarrollan su actividad osteogénica.
El concepto correcto para definir el injerto óseo sería por tanto el de transplante de osteogénesis ya que lo que transferimos es todo un proceso biológico sobre una matriz orgánica y mineral.
El futuro terapéutico es controlar todos y cada uno de estos procesos biológicos. Existen moléculas reguladoras del proceso de regeneración y reparación:PDGF, TGFbeta, Insulin-like GF, BFGF, EGF, De especial importancia son las TGFbeta 2-8 responsables de la osteoinducción que inducen la diferenciación de células pluripotenciales a fenotipos de osteoblastos. Son las BMP que pueden ser obtenidas por clonación a partir de técnicas de DNA recombinante.
Debemos tener el concepto de que la incorporación de un injerto no es un proceso estático sino dinámico y que el hueso se forma no por la incorporación del bloque transferido sino por los fenómenos dinámicos de regeneración celular, la producción de osteoide y su mineralización.
Consideraciones biológico-quirúrgicas
Como decíamos al principio, conocer el proceso de reparación ósea permite y nos obliga a modificar nuestra técnica para obtener el mejor resultado. A modo de resumen nuestras modificaciones son:
1. Usamos el injerto autógeno por su facilidad de obtención, escasa morbilidad y cantidad casi ilimitada para el tipo de reconstrucción que nos planteemos. En el caso de hueso extraoral, sabemos que se trata de un bloque córtico esponjoso y que el hueso de origen endocondral con su amplia estructura esponjosa es más susceptible a la reabsorción. Por ello siempre injertamos más cantidad y lo cubrimos con particulado de hueso, médula ósea y Bio-OSS. Esta técnica disminuye dramáticamente la reabsorción de los injertos óseos y parece dar una, si cabe, mayor rigidez estructural a la reparación.
2. El lecho receptor debe ser idealmente perfecto, esperamos después de la limpieza quirúrgica a que la zona esté estable y sea susceptible de un abordaje predecible. Nunca sobre lechos contaminados o con materiales de intentos de reconstrucción previos. Modificamos el lecho receptor durante la cirugía, realizando perforaciones en la cortical para estimular la neoformación vascular y la invasión precoz del injerto .
3. Sólo en ocasiones se colocan membranas reabsorbibles sobre los injertos. El periostio sano es la mejor cobertura. Separar el periostio de nuestros injertos con una membrana no nos parece la mejor idea desde el punto de vista de la reparación ósea.
4. Sabemos que gran parte de la vascularización de nuestro injerto ya incorporado proviene del periostio. Por tanto en el momento de colocar los implantes no despegamos más que lo necesario el colgajo vestibular, a fin de no interrumpir esas conexiones vasculares. El problema se plantea con los tornillos de osteosíntesis que fijan los bloques y que pueden estorbar al colocar los implantes, por tanto, ya desde la cirugía de injertos intentaremos ser cuidadosos a la hora de elegir su colocación, dejando espacios para los implantes o colocándolos de tal modo que sean accesibles desde el vestíbulo bucal y puedan ser retirados a través de pequeñas incisiones vestibulares sobre los mismos, sin necesidad de levantar el colgajo vestibular. Es siempre más práctico retirar estos tornillos en esa cirugía o en un momento anterior, ya que, en ocasiones, se crea tejido fibroso en el peritornillo que puede afectar a la viabilidad de un implante.
5. Debemos identificar posibles zonas de hueso avascular, normalmente mediante el TAC, y evitarlas o eliminarlas cuando colocamos los implantes. Estas zonas crean procesos inflamatorios que son los responsables de reabsorciones secundarias.
6. Los injertos esponjosos se vascularizan más y más precozmente, por tanto siempre se coloca la esponjosa del injerto sobre el maxilar receptor. El hueso esponjoso recibe vasos en 2-3 días mientras que el cortical tarda más de seis días en recibir capilares.
7. Sabemos que el hueso está en constante proceso de remodelación durante estos meses, existiendo una fase inicial de incorporación y una tardía. Por ello siempre, durante los meses de incorporación del injerto, estamos atentos a cualquier cambio que se pueda producir.
8. Sabemos que se producirán los tres procesos de reparación ósea, osteoinducción, osteogénesis y osteoconducción. Intentamos potenciar todos ellos desde el principio, preservando nuestro injerto en las mejores condiciones durante la intervención (suero salino, temperatura ambiente). Aportar factores de crecimiento de la familia TGF beta con nuestro PRP. Proporcionar el mejor lecho receptor. Evitar la movilidad del injerto y la compresión con la prótesis durante los meses de cicatrización que puede interferir con fuerzas de cizallamiento en el lecho vascular.
9. Controlamos los factores del paciente, suspendiendo hábitos como el de fumar, controlando su dieta postoperatoria y sus patologías de base. En algunas ocasiones en lechos especialmente adversos o irradiados se usa el tratamiento con cámara hiperbárica, previo a la cirugía y posterior a la misma (100% oxígeno a 20 ATA, 20 sesiones de 90 minutos preoperatorias y 10 postoperatorias) para aumentar la angiogénesis.
10. La edad es un factor importante. Sabemos que la presencia de células mesenquimales disminuye dramáticamente con la edad y que esto, lógicamente, influye en los procesos de reparación ósea. En un recién nacido encontramos una MSC en médula ósea por cada 10.000 células, a los 35 años, 1 MSC de cada 250.000 células y a los 80 años una de cada 2.000.000 de células. El segmento de población tratado se verá influido por este hecho.
En el futuro seremos capaces de aislar estas células, separarlas en laboratorio, cultivarlas, polarizarlas y llevarlas al lecho receptor con carriers quirúrgicos para obtener la mejor reparación .
11. Limitamos el uso de antiinflamatorios no esteroideos a lo mínimo necesario por su posible interferencia con los procesos de remodelación y cicatrización óseos.
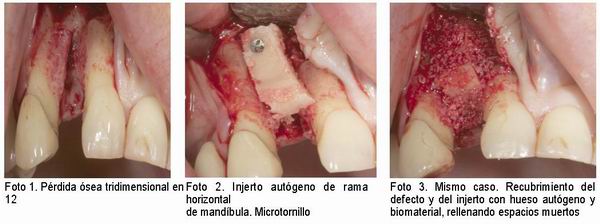
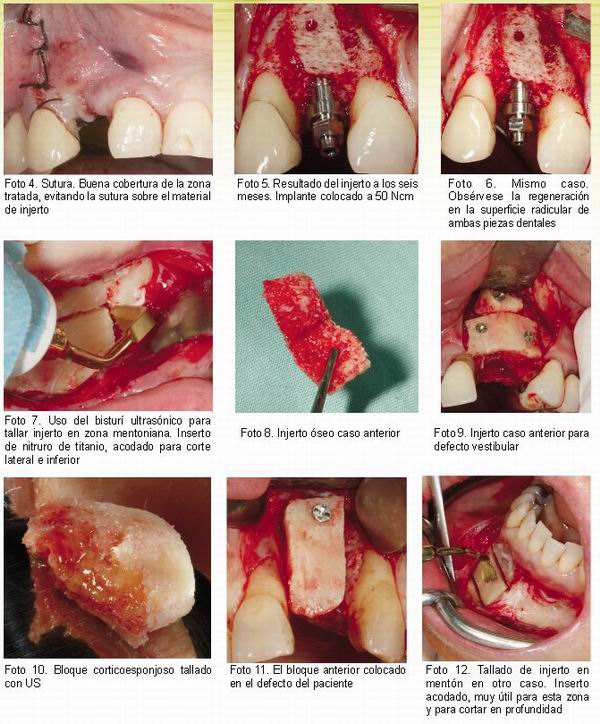
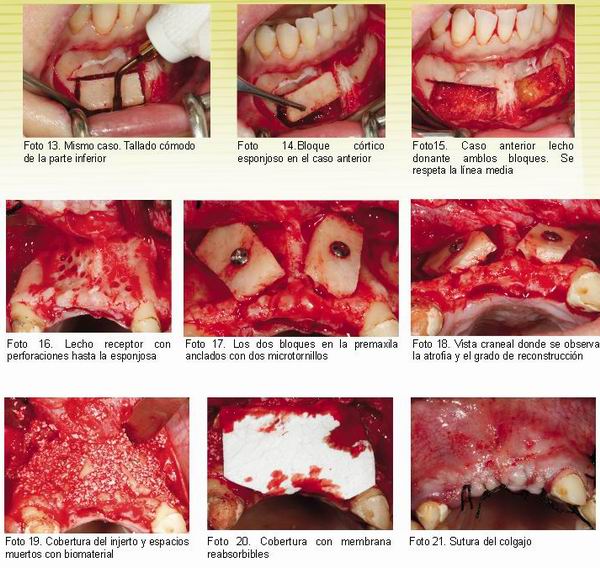
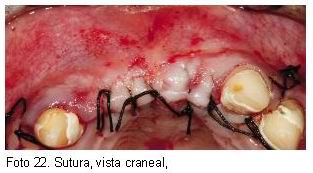
A continuación presentamos algunas imágenes de casos tratados usando la técnica ultrasónica para su obtención.
 |
 |
 |
 |
Patrocinado por:
Centro i2 Implantología
C/ Diego de León, 11. Madrid
www.i2-implantología.com




