Dra. Cristina Pérez Sánchez. Odontóloga / Dra. Ana María Martínez Rodríguez. Odontóloga. Facultad de Medicina y Odontología de la Universidad de Murcia
Objetivo: Evaluar el porcentaje de contacto hueso-implante (BIC) y la formación ósea crestal alrededor de implantes de plataforma expandida no sumergidos con superficie DCD (depósito discreto de calcio) comparados con implantes de plataforma expandida de cuello pulido en conejos de Nueva Zelanda.
Material y métodos: Los implantes fueron colocados en 20 conejos y evaluados desde los 15 días hasta los 4 meses. Las secciones histológicas fueron preparadas y analizadas histomorfométricamente.
Resultados: Los implantes de plataforma expandida de superficie DCD alcanzaron mayores niveles de contacto óseo y mayor formación ósea crestal.
Conclusión: La exposición de las plataformas expandidas de los implantes en el borde de la cresta ósea, con la superficie DCD, permite al hueso una mejor respuesta para cubrir la superficie tratada con hueso neoformado de calidad D2 a las 16 semanas. Además mejora el contacto implante-hueso, acelerando la integración del mismo en cualquier tipo de densidad ósea.
Introducción
El uso de implantes dentales intraóseos para reemplazar un diente se ha convertido en un tratamiento de rutina en la clínica. Un importante prerrequisito para asegurar una posición directa en la interfase hueso-implante es una adecuada estabilización primaria de implante durante la primera cicatrización. En hueso denso de adecuado volumen esta condición es frecuente y fácilmente alcanzable usando implantes largos y roscados con modificaciones en la superficie (1, 2). Sin embargo, los implantes colocados en hueso de baja densidad tienen mayor riesgo y pueden producirse micromovimientos que causen fracaso en la osteointegración y la pérdida del implante (3, 4).
Numerosas modificaciones de la superficie de los implantes dentales se han llevado a cabo para mejorar la unión al hueso, dando lugar a mejores resultados clínicos. Desde hace más de una década investigadores han estudiado la superficie de los implantes que tienen la propiedad de mejorar el contacto hueso-implante. Este contacto y su tasa de concurrencia puede ser la llave para la función del implante y la duración clínica. Las superficies macrorrugosas, tales como las de hidroxiapatita y plasma spray de titanio, se han asociado, por otro lado, con una rápida y severa destrucción ósea al exponerse a la cavidad oral. Además, se mostraron tasas de supervivencia de los implantes de hidroxiapatita de 77,8% frente al 92,7% para los implantes TPS a los 8 años (5).
Las propiedades químicas de la superficie de los implantes son también importantes (6-9). Se ha desarrollado un gran número de técnicas como la deposición de vapor física (10), la inmersión simple (11, 12), métodos de doble grabado ácido más fosfato cálcico (13), cubiertas de derivados de sol-gel, oxidación electroquímica (14, 15) y superficie ionizada (16).
Wennenberg y asociados compararon las superficies de titanio tratadas con arenado de partículas de 25 a 75 µm y encontraron mayor resistencia a las fuerzas de tracción y mayor contacto hueso implante en las superficies de 75 µm (17).
La textura específica resultante de varios tratamientos puede repercutir fuertemente en el contacto óseo y en la fuerza mecánica de la interfase. Park y Davies mostraron una mejora en la aglomeración de células rojas sanguíneas y agregación plaquetaria en una superficie de doble grabado ácido comparada con una superficie de titanio pulido. Al tratar una superficie de doble grabado de titanio pulido resultó un incremento de 3,5 veces más resistencia a las fuerzas mecánicas de tracción comparadas con los implantes controles de titanio pulido (18).
Block y colaboradores mostraron un mayor contacto hueso-implante en los implantes cubiertos de hidroxiapatita que en los implantes de titanio de superficie de arenado (19).
Lazzara y colaboradores evaluaron la diferencia entre los implantes de titanio y las superficies Osseotite en cada lado del mismo implante en humanos. Demostraron grandes diferencias, la superficie DE muestra un incrementado de contacto óseo con respecto a la superficie de titanio pulido en un periodo de 6 meses en humanos (20).
La superficie ideal del implante debe de exhibir un mejorado contacto óseo combinado con la resistencia a largo plazo de los implantes de titanio pulido. Con esto se pensó que el proceso de doble grabado mejoraría el contacto óseo para los implantes de titanio. En el objetivo de este estudio fue evaluado el análisis histológico e histomorfométrico comparado con la diferente cantidad de formación ósea alrededor de la superficie doble grabado ácido en combinación con los implantes de plataformas expandidas durante 16 semanas.
Material y métodos
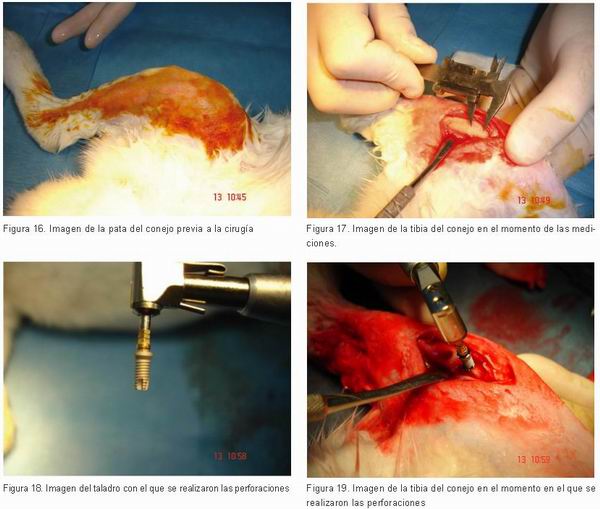
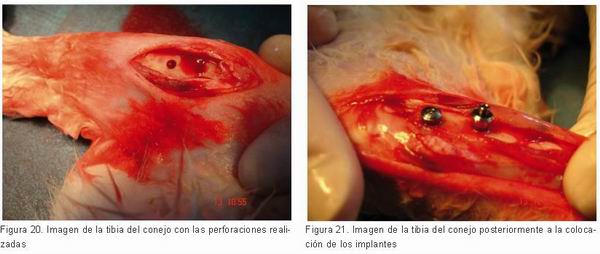
Veinte conejos de Nueva Zelanda fueron usados en este estudio. En la parte media de las tibias derecha e izquierda se colocaron dos implantes: uno de plataforma expandida con superficie nanotite de 4 mm de diámetro x 8,5 mm de longitud Certain Prevail (Biomet 3i, Implants Innovations Inc, Palm Beach Gradens, FL, USA) y otro de plataforma expandida con cuello pulido de 4 mm de diámetro x 8,5 mm de longitud con superficie tratada con óxido de alúmina (Profile One, Orvit, Parma italy).
El test de inserción del torque (IST) actuó en todos los implantes colocados usando un dispositivo de torque de inserción (Biomet 3i, Implants Innovations Inc, Palm Beach Gradens, FL, USA).
Los colgajos fueron suturados por capas separadas con una única sutura reabsorbible (Vicryl®4-0, Ethicon, Norderstedt, Germany), mientras las suturas no reabsorbibles (Prolene® 5–0, Ethicon) fueron usadas en la zona cutánea. Después de la operación se les dio antibiósticos a los animales durante tres días (1,5 ml/día Streptocillin i.m., Boehringer Ingelheim, Copenhagen, Denmark A/S) y analgésicos durante un día (0,5 ml/day Temgesic i.m. 0,3 mg/ml, Schering-Plough Europa, Bruselas, Bélgica).
Un animal fue sacrificado en cada intervalo a 15 días, 1, 2, 3 y 4 meses. Los segmentos de hueso fueron recuperados, seccionados e inmediatamente fijados en una solución amortiguadora de formalina.
 |
 |
Resultados
Durante este periodo, los animales experimentales permanecieron en buen estado de salud. Al sacrificarlos no aparecieron signos clínicos de inflamación ni reacciones adversas tisulares. Todos los implantes estaban en su lugar en el momento del sacrificio.
Análisis histológico y histomorfométrico
Los especímenes recuperados fueron deshidratados en etanol y luego infiltrados en una resina de metacrilato. Después de la polimerización los cortes fueron cortados y fijados con azul de toluidina y fucsina básica. El análisis histomorfométrico fue realizado con una cámara de vídeo (JVC TK C1380; Victor, Yokohama, Japan). Las imágenes digitalizadas se analizaron utilizando un programa de análisis de imagen (IAS 2000, Delta Sistemi, Roma, Italia) para evaluar el volumen de hueso y el contacto hueso-implante (BIC).
Evaluación histológica
En la evaluación histológica de los implantes a las 4 semans observamos una completa osteointegración significativamente estadística (p < 0,05).
Los implantes de plataforma expandida exhibieron un recubrimiento completo por hueso cortical sobre la superficie doble grabada al ácido con depósito de calcio sin tejido inflamatorio. Se observaron trabéculas óseas orientadas hacia la superficie del implante.
A los dos meses observamos hueso maduro continuo con algunas zonas recubiertas por tejido conectivo sano.
Además, a los tres meses la formación de hueso cortical penetró dentro de la conexión del implante, expulsando la tapa de cierre. La formación de estrechos espacios medulares de hueso denso con osteocitos estaba todavía presente.
A los cuatro meses el implante parecía estar cubierto con hueso denso en toda su superficie.
 |
Análisis histomorfométrico
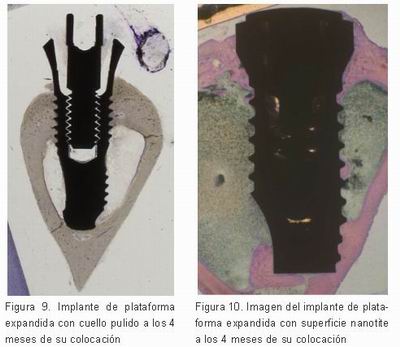
Los implantes de plataforma expandida de superficie DCD alcanzaron mayores niveles de contacto óseo y mayor formación ósea crestal. El BIC de los implantes de plataforma expandida con DCD fue de 34,6% a 15 días, 39,26% a 1 mes, el 42,46% a 2 meses, 41,2% a 3 meses y 41,4% a los 4 meses. Los implantes de plataforma expandida de cuello pulido obtuvieron un BIC de 32,4% a 15 días, 36.72% a 1 mes, el 37,32% a 2 meses, 38,61% a 3 meses y 38,12 %a los 4 meses (Figuras 1-10) (Tabla 1).
La formación de hueso crestal en implantes de plataforma expandida con DCD, fue de 2,3 mm a 15 días, 3,13 mm a 1 mes, 3,16 mm a 2 meses, 3,17 mm a 3 meses y 3,89 mm a 4 meses. Sin embargo, en los implantes de plataforma expandida de cuello pulido se produjo una reabsorción ósea crestal de 2,12 mm a 15 días, 2,89 mm a 1 mes, 3,34 mm a 2 meses, 3,41 mm a 3 meses y 3,76 mm a 4 meses. Ningún implante fracasó durante el estudio (Tabla 2).
 |
Discusión
El objetivo de este estudio fue evaluar el porcentaje de contacto hueso-implante (BIC) y la formación ósea crestal alrededor de implantes de plataforma expandida no sumergidos con superficie DCD (depósito discreto de calcio) comparados con implantes de plataforma expandida de cuello pulido en conejos de Nueva Zelanda a 4 meses.
Durante el primer año después de la carga del implante es frecuente una pérdida temprana de hueso crestal de aproximadamente 1,5 mm seguida de una pérdida de hueso de 0,2 mm en los siguientes años. Entre los factores etiológicos implicados en esta pérdida inicial de hueso se encuentran trauma quirúrgico, sobrecarga, periimplantitis, presencia de microgap, diseño del implante y formación de las distancias biológicas (21).
Los cambios en la altura del hueso crestal observados durante la cicatrización y el primer año de función no afectan al éxito a largo plazo del implante (22).
El hueso crestal peri-implantario debe ser estable para permitir una presencia continua de la papila (23-30). La resorción periurbanas crestal hueso-implante, se ha observado con frecuencia durante el primer año después de la restauración protésica (24, 28, 31, 32), aproximadamente 1,5 a 2 mm por debajo de la unión implante-pilar (UIP) (33-37), y puede provocar una recesión gingival de los márgenes, especialmente en las personas con biotipo delgado (24). La preservación de la pérdida de hueso peri-implante parece ser de especial importancia en zonas estéticas y en zonas con poco hueso (25). El microgap entre implante y pilar y su contaminación bacteriana parece jugar, al menos, un papel parcial en la anteriormente descrita remodelación ósea (24-26, 28-31, 33-40). La resorción crestal ósea está ausente cuando el implante sigue sumergido y se hace presente después de la exposición de los implantes orales al medio ambiente oral (28-30). Parece que hay relación causa/efecto entre el grado de inflamación peri-implante y el grado de hueso alveolar (31). Cuando la UIP se coloca en el hueso de profundidad, hay un aumento en la pérdida de hueso crestal (25, 38).
 |
Numerosos estudios han mostrado un incremento en la afinidad de los osteoblastos y más rápida formación de contacto directo de hueso a las superficies con un grado moderado de rugosidad, en comparación con superficies más lisas (41-43). La forma de osteointegración es diferente para los implantes de superficie lisa que para los implantes de topografía rugosa. Se sabe que la formación de hueso ocurre directamente en los implantes de superficie rugosa oxidada, mientras que en los implantes de titanio puro son osteointegrados debido al crecimiento de hueso desde los tejidos adyacentes (44).
Superficies de titanio microrrugosas tienen significativamente mayor porcentaje de BIC comparado con superficies de titanio pulidas a los 5 años de seguimiento demostrando resultados favorables, con tasas de supervivencia y éxito alrededor del 99% (45-49).
En el estudio de Del Fabbro y colaboradores (50), se consiguió una tasa de supervivencia de un 85,64% de implantes de superficie pulida de titanio situados en un injerto de seno maxilar. Los implantes de superficie rugosa exhibieron una tasa de supervivencia mayor (95,98%). Resultados similares fueron hallados en un estudio clínico (51) que comparaba implantes de superficie pulida de titanio con implantes de superficie tratada con arenado y grabado ácido, siendo la tasa de supervivencia de un 81% y de un 97,5% respectivamente.
Esposito y colaboradores evaluaron 16.935 implantes en un meta-análisis de 73 artículos y encontraron una mayor tasa de fracasos tardíos debido a la progresiva pérdida de hueso en superficies de plasma spray de titanio TPS comparados con los implantes de titanio pulido de 2 fases (3-4). Sin embargo, Buser y colaboradores afirmaron que con los implantes de superficie de plasma spray se crea un alto porcentaje de contacto hueso-implante en comparación con los implantes de titanio de superficie lisa demostrando así que estos últimos tienen peores propiedades que los de plasma spray (52). La técnica plasma spray también ha sido utilizada para tratar implantes de titanio previamente tratados con hidroxiapatita cristalina. Esto es atractivo porque varios estudios confirman una rápida osteointegración, un alto porcentaje de contacto hueso-implante y una máxima resistencia a las fuerzas de cizallamiento al comparar este tipo de implantes con los implantes no tratados o con aquellos tratados con chorro de arena (53-55).
 |
 |
Varios estudios experimentales en animales (52, 56, 57) han demostrado que en las superficies de titanio tratadas con arenado y grabado ácido se produce una mejora en el contacto implante-hueso en comparación con las superficies de titanio tratadas con plasma spray o implantes de titanio comercialmente puro. Además, estudios in vitro (58-62) han mostrado que los osteoblastos en las superficies tratadas con arenado y grabado ácido presentan características celulares de células de hueso diferenciadas, sugiriendo una propiedad osteoconductora de esta configuración de la superficie. Los resultados de estos estudios apoyan el concepto de una acelerada deposición ósea en las superficies de titanio tratadas con grabado ácido y con arena.
London y colaboradores encontraron que la superficie de doble grabado parecía tener una ventaja en el porcentaje de contacto óseo, particularmente en la temprana cicatrización en la tibia de conejo a las 8 semanas siguientes (63). Los resultados concuerdan con los obtenidos en nuestro estudio a las 16 semanas.
Tache y colaboradores demostraron que la modificación química de poros en la superficie del implante pueden acelerar el proceso de osteointegración. Sin embargo, es importante señalar que la película sol-gel de fosfato cálcico usada introdujo una textura adicional similar a la piel de naranja la cual puede que contribuyese a acelerar la respuesta de cicatrización (64).
Wolke y colaboradores sugirieron que 1 µm de grosor rugosidad tratada con hidroxiapatita sobre la superficie de titanio parecían ser de suficiente grosor para mostrar propiedades bioactivas bajo condiciones in vivo en conejos (65).
Otros estudios sugieren que los implantes cuya superficie ha sido tratada con hidroxiapatita parecen actuar como osteoconductores facilitando la formación de hueso en la periferia del implante (66-68). Además, diversos estudios (19, 66, 69) concluyen que la mayoría de implantes tratados con hidroxiapatita tienen una tasa de pérdida muy baja durante el periodo de duración del estudio. Gessink y colaboradores (70) afirmaron que la razón principal por la que la hidroxiapatita se utiliza como material de revestimiento de los implantes es que forma una fijación química al hueso con una fuerza comparable a la que se forma entre el hueso y su propia cortical.
Hayakawa y asociados demostraron que cubiertas de calcio producidas por el método precursor molecular mostró mayor contacto hueso-implante durante la fase de cicatrización comparada con superficie no tratadas controles (10).
Cordioli y colaboradores demostraron que los implantes de doble grabado de superficie produjeron mayor contacto hueso-implante que los de superficie tratada con arenado (71).
Park y Davis ilustraron un mayor número de plaquetas en doble grabado que los discos de titanio pulido in vitro (18).
Park y colaboradores mostraron mayor expresión de P-selectina y formación de micropartículas plaquetarias con superficies tratadas y de doble grabado que con superficies pulidas de titanio o barnizadas en titanio (72).
 |
Fijando el coágulo a la superficie y favoreciendo los factores de crecimiento de hueso, la superficie de doble grabado pareció tener un incremento sinérgico en osteoconducción a lo largo de su superficie. El conejo está limitado en que la tibia proximal está desprovista de una trabeculación gruesa similar al hueso D1, sólo el conejo tiene una densidad baja de tipo D3-D4 de la Clasificación de Misch. La mayoría del contacto óseo parecía migrar apicalmente desde la cresta hasta el ápice del implante.
El plano de sección proximal-distal, y un porcentaje de la superficie total, impidieron que la influencia de las paredes óseas cercanas afectara a los resultados.
Conclusiones
La superficie Nanotite alcanzó mayores niveles de contacto óseo en implantes de plataforma expandida después de 16 semanas en comparación con los implantes de plataforma expandida de cuello pulido. Esta mejora en los niveles de contacto fue vista en todos los intervalos de tiempo hasta los cuatro meses de cicatrización. Los implantes de plataforma expandida de superficie DCD alcanzaron mayores niveles de contacto óseo y mayor formación ósea crestal.
La superficie de nanotite que recubre hasta el cuello del implante parece estar relacionada con el nuevo diseño del implante (implante de plataforma expandida), mejorando el porcentaje de contacto óseo y reduciendo la pérdida ósea crestal.
BIBLIOGRAFÍA
1. Testori T, Wiseman L, Woolfe S, Porter SS. A prospective multicenter clinical study of the Osseotite implant. Four year interim report. Int J Oral Maxillofac Implants 2001; 16: 193-200.
2. Palmer RM, Palmer P, Smith B. A 5-year prospective study of Astra single tooth implants. Clin Oral Implant Res 2000; 11: 179-82.
3. Esposito M, Hirsch JM, Lekholm U, Thomsen P. Biological factors contributing to failures of osseointegrated oral implants (I).Success criteria and epidemiology. Eur J Oral Sci 1998; 106: 527-51.
4. Esposito M, Hirsch JM, Lekholm U, Thomsen P. Biological factors contributing to failures of osseointegrated oral implants (II). Etiopathogenesis. Eur J Oral Sci 1998; 106: 721-64.
5. Wheeler SL. Eight-year clinical retrospective study of titanium plasma-sprayed and hydroxyapatite-coated cylinder implants. Int J Oral Maxillofac Implants 1996; 11(3): 340-50.
6. Wong M, Eulenberger J, Schenk R, Hunziker E. Effect of surface topology on the osseointegration of implant materials in trabecular bone. J Biomed Mater Res 1995; 29: 1567-75.
7. Brunette DM, Chehroudi B. The effects of the surface topography of micromachined titanium substrata on cell behavior in vitro and in vivo. J Biomech Eng-T Asme 1999; 121: 49-57.
8. Sul YT, Johansson CB, Jeong Y, Roser K, Wennerberg A, Albrektsson T. Oxidized implants and their influence on the bone response. J Mater Sci Mater Med 2001; 12: 1025-31.
9. Fujibayashi S, Nakamura T, Nishiguchi S, et al. Bioactive titanium: Effect of sodium removal on the bone-bonding ability of bioactive titanium prepared by alkali and heat treatment. J Biomed Mater Res 2001; 56: 562-70.
10. Hayakawa T, Takahashi K, Yoshinari M, Okada H, Yamamoto H, Sato M, Nemoto K. Trabecular bone response to titanium implants with a thin carbonate-coating applied using the molecular precursor method. Int J Oral Maxillofac Implants 2006; 21: 851-8.
11. Ellingsen JE. A study on the mechanism of protein adsorption to TiO2. Biomaterials 1991; 12: 593-6.
12. Shirkhanzadeh M. Nanoporous alkoxy-derived titanium oxide coating: A reactive overlayer for functionalizing titanium surface. J Mater Sci Mater Med 1998;9: 355-62.
13. Lo WJ, Grant DM, Ball MD, et al. Physical, chemical and biological characterization of pulsed laser deposited and plasma sputtered hydroxyapatite thin films on titanium alloy. J Biomed Mater Res 2000; 50: 536-45.
14. Sul YT, Johansson CB, Jeong Y, Albrektsson T. The electrochemical oxide growth behaviour on titanium in acid and alkaline electrolytes. Med Eng Phys 2001; 23: 32-46.
15. Sul YT, Johansson CB, Jeong Y, Albrektsson T. Oxidized titanium screws coated with calcium ions and their performance in rabbit bone Int J Oral Maxillofac Implants 2002; 17: 625-34.
16. Thorwarth G, Mandl S, Rauschenbach B. Plasma immersion ion implantation using titanium and oxygen ions. Surf Coat Tech 2000; 128-129: 116–20.
17. Wennerberg A, Albrektsson T, Lausmaa J. Torque and histo-morphometric evaluation of c.p. titanium screws blasted with 25- and 75-micron-sized particles of Al20). Biomed Mater Res 1996; 30(2): 251-60.
18. Park JY, Davies JE. Red blood cell and platelet interactions with titanium implant surfaces. Clin Oral Implants Res 2000; 11(6): 530-9.
19. Block MS, Finger IM, Fontenot MG, Kent JN. Loaded hydroxylapatite-coated and grit-blasted titanium implants in dogs. Int J Oral Maxillofac Implants 1989; 4(3): 219-25.
20. Lazzara R, Testori T, Trisi P, Porter SS, Weinstein RL. A human histologic analysis of Osseotite and machined sur-faces using implants with 2 opposing surfaces. Int J Peri-odont Rest Dent 1999; 19(2): 117-29.
21. Oh TJ, Yoon J, Misch CE, Wang HL. The causes of early implant bone loss: myth or science? J Periodontol 2002; 73: 322–33.
22. Lazzara RJ, Porter SS. Platform switching: a new concept in implant dentistry for controlling postoperative crestal bone levels. Int J Periodontics Restorative Dent 2006; 26: 9-17.
23. Massaro C, Rotolo P, Riccardis F, Milella E, Napoli A, Wieland M, Spencer ND, Brunette DM. Comparative investigation of the surface properties of comercial titanium dental implants, J Mater Sci 2002; 13: 535-48.
24. Schropp L, Wenzel A, Kostopoulos L, Karring T. Bone healing and soft tissue contour changes following single- tooth extraction: a clinical and radiographic 12-month prospective study. Int J Periodont Rest Dent 2003; 23: 313-23.
25. Araujo MG, Lindhe J. Dimensional ridge alterations following tooth extraction. An experimental study in the dog. J Clin Periodontol 2005; 32: 212-8.
26. Araujo MG, Sukekava F, Wennstrom JL, Lindhe J. Ridge alterations following implant placement in fresh extraction sockets: an experimental study in the dog. J Clin Periodontol 2005; 32: 645-52.
27. Guirado JL, Saez Yuguero MR, Pardo Zamora G, Muñoz Barrio E. Immediate provisionalization on a new implant design for esthetic restoration and preserving crestal bone. Implant Dent 2007; 16: 155-64.
28. Hermann F, Lerner H, Palti A. Factors influencing the preservation of the periimplant marginal bone. Implant Dent 2007; 16: 165- 75.
29. Chou CT, Morris HF, Ochi S, Walker L, DesRosiers D. AICRG, Part II: crestal bone loss associated with the Ankylos implant – loading to 36 months. J Oral Implantol 2004; 30: 134-43.
30. Hurzeler M, Fickl S, Zuhr O, Wachtel HC. Peri-implant bone level around implants with platform-switched abutments: preliminary data from a prospective study. J Oral Maxillofac Surg 2007; 65 (Suppl.): 33-9.
31. Hermann JS, Buser D, Schenk RK, Cochran DL. Crestal bone changes around titanium implants. A histometric evaluation of unloaded non-submerged and submerged implants in the canine mandible. J Periodontol 2000; 71: 1412- 24.
32. Carlsson GE, Bergman B, Hedegard B. Changes in contour of the maxillary alveolar process under immediate dentures. A longitudinal clinical and x-ray cephalometric study covering 5 years. Acta Odontol Scand 1967; 25: 45-75.
33. Lazzara RJ, Por ter SS. Platform switching: a new concept in implant dentistry for controlling postrestorative crestal bone levels. Int J Periodontics Restorative Dent 2006; 26: 9-17.
34. Cochran DL, Hermann JS, Schenk RK, Higginbottom FL, Buser D. Biologic width around titanium implants. A histometric analysis of the implanto-gingival junction around unloaded and loaded nonsubmerged implants in the canine mandible. J Periodontol 1997; 68: 186-98.
35. Hermann JS, Buser D, Schenk RK, Higginbottom FL, Cochran DL. Biological width around titanium implants. A physiologically formed and stable dimension over time. Clin Oral Impl Res 2000; 11: 1-11.
36. Hermann JS, Cochran DL, Nummikoski PV, Buser D. Crestal bone changes around titanium implants: a radiographic evaluation of unloaded nonsubmerged and submerged implants in the canine mandible. J Periodontol 1997; 68: 1117-30.
37. Hermann JS, Schofield JD, Schenk RK, Buser D, Cochran DL. Influence of the size of the microgap on crestal bone changes around titanium implants. A histometric evaluation of unloaded non-submerged implants in the canine mandible. J Periodontol 2001; 72: 1372-83.
38. Piattelli A, Vrespa G, Petrone G, Iezzi G, Annibali S, Scarano A. Role of the microgap between implant and abutment: a retrospective histologic evaluation in monkeys. J Periodontol 2003; 74: 346-52.
39. Broggini N, McManus CM, Hermann JS, Medina R, Schenk RK, Buser D, Cochral DL. Peri-implant inflammation defined by the implant-abutment interface. J Dent Res 2006; 85: 473-8.
40. Piattelli A, Scarano A, Paolantonio M, Assenza B, Leghissa GC, Di Bonaventura G, Catamo G, Piccolomini R. Fluids and microbial penetration in the internal par t of cement-retained versus screw-retained implant- abutment connections. J Periodontol 2001; 72: 1146-50.
41. Wennerberg A, Albrektsson T, Lausmaa J. Torque and histomorphometric evaluation of c.p. titanium screws blasted with 25- and 75-microns-sized particles of Al2O3. J Biomed Mater Res 1996; 30: 251-60.
42. Ivanoff CJ,Widmark G, Johansson C, Wennerberg A. Histologic evaluation of bone response to oxidized and turned titaniummicro-implants in human jawbone. Int J Oral Maxillofac Implants 2003; 18: 341-8.
43. Ivanoff CJ, Hallgren C, Widmark G, Sennerby L, Wennerberg A. Histologic evaluation of the bone integration of TiO(2) blasted and turned titanium microimplants in humans. Clin Oral Implants Res 2001; 12: 128-34.
44. Miranda Burgos P, Rasmusson L, Meirelles L, Sennerby L. Early bone tissue responses to turned and oxidized implants in the rabbit tibia. Clin Implant Dent Relat Res 2008; 10(3): 181-90.
45. Roccuzzo M, Bunino M, Prioglio F, Bianchi SD. Early loading of sandblasted and acid-etched (SLA) implants: a prospective split-mouth comparative study. Clin Oral Implants Res 2001; 12: 572-8.
46. Bornstein MM, Lussi A, Schmid B, Belser UC, Buser D. Early loading of nonsubmerged titanium implants with a sandblasted and acid-etched (SLA) surface: 3-year results of a prospective study in partially edentulous patients. Int J Oral Maxillofac Implants 2003; 18: 659-66.
47. Bornstein MM, Schmid B, Belser UC, Lussi A, Buser D. Early loading of nonsubmerged titanium implants with a sandblasted and acid-etched surface. 5-year results of a prospective study in partially edentulous patients. Clin Oral Implants Res 2005; 16: 631-8.
48. Bornstein MM, Valderrama P, Jones AA, Wilson TG, Seibl R, Cochran DL. Bone apposition around two different sandblasted and acid-etched titanium implant surfaces: a histomorphometric study in canine mandibles. Clin Oral Implants Res 2008; 19: 233-41.
49. Cochran DL, Buser D, ten Bruggenkate CM, Weingart D, Taylor TM, Bernard JP, Peters F, Simpson JP. The use of reduced healing times on ITI implants with a sandblasted and acid-etched (SLA) surface: early results from clinical trials on ITI SLA implants. Clin Oral Implants Res 2002; 13: 144-53.
50. Del Fabbro, M., Testori, T., Francetti, L. & Weinstein. R. Systematic review of survival rates for implants placed in the grafted maxillary sinus. Int J Periodont Rest Dent 2004; 24: 565-77.
51. Pinholt, EM. Branemark and ITI dental implants in the human bone-grafted maxilla: a comparative evaluation. Clin Oral Implants Res 2003; 14: 584–92.
52. Buser D, Schenk RK, Steinemann S, Fiorellini JP, Fox CH, Stich H. Influence of surface characteristics on bone integration of titanium implants. A histomorphometric study in miniature pigs. J Biomed Mater Res 1991; 25: 889-902.
53. Block MS, Finger IM, Fontenot MG, Kent JN. Loaded hydroxylapatite coated and grit blasted titanium implants in dogs. Intern J Oral Maxillo Imp 1989; 4: 219-25.
54. De Groot K, Geesink R, Klein C, Serekian P. Plasma sprayed coatings of hydroxyapatite. J Biomed Mater Res 1987; 21: 1375-81.
55. Thomas KA, Kay JF, Cook SD, Jarcho M. The effect of surface macrotexture and hydroxylapatite coating on the mechanical strengths and histologic profiles of titanium implant materials. J Biomed Mater Res 1987; 21: 1395-414.
56. Cochran DL, Schenk RK, Lussi A, Higgibottom, FL, Buser D. Bone response to unloaded titanium implants with a sandblasted and acid etched surface: a histometric study in the canine mandible. J Biomed Mater Res 1998; 40: 1-11.
57. Wilke HJ, Claes L, Steinemann S. The influence of various titanium surfaces on the interface shear strength between implants and bone. Advances in Biomaterials 1990; 9: 309-11.
58. Martin et al. Effect of titanium surface roughness on proliferation, differentiation and protein synthesis of human osteoblast-like cells. J Biomed Mater Res 1995; 29: 389-401.
59. Boyan BD, Hummert TW, Dean DD, Schwartz Z. Role of material surfaces in regulating bone and cartilage cell response. Biomaterials 1996; 17: 137-46.
60. Boyan BD et al. Titanium surface roughness alters responsiveness of MG63 osteoblast-like cells to 1 alpha, 25-(OH)2D3. J Biomed Mater Res 1998; 39: 77-85.
61. Cooper LF, Masuda T, Whitson SW, Yliheikkila P, Felton DA. Formation of mineralizing osteoblast cultures on machined, titanium oxide grit-blasted and plasma-sprayed titanium surfaces. Int J Oral Maxillofac Implants 1999;14: 37-47.
62. Kieswetter K et al. Surface roughnessmodulates the local production of growth factors and cytokines by osteoblast-like MG63 cells. J Biomed Mater Res 1996; 32: 55-63.
63. London RM, Roberts F, Baker DA, Roher MD, O´Neal RB. Histologic comparison of thermal dual-etched implat surface to machined , TPS and HA surfaces: Bone contact in vivo rabbits. Int J Oral Maxillofac Implants 2002; 17: 369-76.
64. Tache A, Gan L, Deporter D, Pilliar RM. Effect of surface chemistry on the rate of osseointegrated of sintered porous surfaced Ti-6AL-4V implants. Int J Oral Maxillofac Implants 2004; 19: 19-29.
65. Wolke JGC, Van der Waerden JPCM, Schaeken HG, Janse JA. In vivo dissolution behaviour of various RF magnetron-sputtered Ca-P coatings on roughened titanium implants. Biomaterials 2003; 24: 2623-9.
66. Quiñones CR, Hürzeler MB, Schüpbach P, Arnold DR, Strub JR, Caffesse RG. Maxillary sinus augmentation using different grafting materials and dental implants in monkeys. Part IV. Evaluation of hydroxyapatite-coated implants. Clin Oral Impl Res 1997; 8: 497-505.
67. Knox R, Caudill R, Meffert R. Histologic evaluation of dental endosseous implants placed in surgically created extraction defects. Int J Periodontics Restorative Dent 1991; 11: 364-75.
68. Zablotsky M, Meffert R, Caudill R, Evans G. Histological and clinical comparison of guided tissue regeration on dehisced hydroxylapatite-coated and titanium endosseous implant surfaces: a pilot study. Int J Oral Maxillofac Implants 1991; 6: 294-303.
69. Tidwell JK, Blijorp PA, Stoelinga PJW, Brouns JB, Hinderks F. Composite grafting of the maxillary sinus for placement for endosteal implants. A preliminary report of 48 patients. Int J Oral Maxillofac Implants 1992; 7: 491-6.
70. Geesink RGT, de Groot KDK, Klein CPAT. Bonding of bone to apatite-coated implants. J Bone Joint Surg 1988; 70-B:17-22.
71. Cordioli G, Majzoub Z, Piattelli A, Scarano A. Removal torque and histomorphometric investigation of 4 different titanium surfaces: An experimental study in the rabbit tibia. Int J Oral Maxillofac Implants 2000; 15(5): 668-674.
72. Park JY, Gemmell CH, Davies JE. Platelet interactions with titanium: Modulation of platelet activity by surface topogra-phy. Biomaterials 2001; 22(19): 2671-2682.




