Los productos comerciales actuales, destinados al blanqueamiento dental en la consulta o en el domicilio del paciente, utilizan básicamente el peróxido de hidrógeno o su derivado en forma de peróxido de carbamida (1) para provocar la oxidación de los componentes responsables de la tinción de los tejidos dentarios (2). El mecanismo mediante el cual el peróxido de hidrógeno oxida estos componentes, transcurre por la vía de generación de radicales libres, como por ejemplo el radical hidroxilo, los complejos oxiferrilos o el ión superóxido (figura 1), muy reactivos debido básicamente a su rápida transformación o reacción (3).
En la actualidad y desde hace ya dos décadas, se ha venido imponiendo el tratamiento domiciliario con peróxido de hidrógeno o derivados en concentraciones más diluidas que no implican la necesidad de una aplicación por el especialista (4), logrando un aclaramiento significativo del color dentario sin provocar alteraciones sobre los tejidos duros del diente que contraindiquen su uso (5, 6). No obstante, su aplicación conlleva algunos efectos secundarios durante el periodo de tratamiento, poco importantes en gravedad pero sí incómodos, como la hipersensibilidad dentaria, la irritación de los tejidos blandos en contacto con el producto blanqueador y la disminución temporal de adhesión de los composites y derivados (7). La magnitud de estos efectos secundarios presenta una cierta variación en función del tipo de paciente y pauta de aplicación, cobrando una especial importancia el tiempo y la concentración de peróxido de hidrógeno o de carbamida (8).
La remineralización de los tejidos dentarios sometidos al efecto de los productos blanqueadores (9), el control de la afectación de la pulpa dentaria (10) y la protección de los tejidos blandos de la cavidad oral (11), pueden ser insuficientes ante el dramático aumento de tratamientos blanqueadores a que son sometidos los pacientes hoy en día (12). La difusión de los radicales hidroxilo a través de las membranas celulares y, por tanto, la afectación del genoma humano, puede desencadenar una carcinogénesis de los tejidos vivos expuestos al peróxido de hidrógeno y derivados, con la alarmante gravedad que ello conlleva (13).
Los estudios actuales sobre blanqueamiento dental deben orientarse hacia la protección concomitante de los tejidos vivos expuestos de la cavidad oral, la utilización de bajas concentraciones de principios activos blanqueadores y catalizadores que optimicen el efecto, siempre con el obligado consentimiento informado del paciente (14). Las ventajas que ofrecen los catalizadores actuales en cuanto a la consecución de más blanqueamiento dental, cuando los asociamos a peróxido de hidrógeno y sus derivados, no son significativamente mejores cuando aplicamos calor, luz o láser en la mayoría de los casos (15). Asimismo, el uso de enzimas ha mejorado la eficacia de los peróxidos como blanqueantes dentales, debido a las características de la acción enzimática como su especificidad de substrato y de reacción, sus condiciones de reacción suaves, su alto poder catalítico, las concentraciones de substrato bajas, su naturaleza proteica y su posibilidad de inmovilización (figura 2).
 |
Las investigaciones sobre el uso de enzimas, como la catalasa o la peroxidada, durante o inmediatamente después del tratamiento blanqueador con peróxido de hidrógeno y derivados, pueden prevenir potenciales efectos nocivos sobre los tejidos blandos de la cavidad oral y la pulpa dentaria (16, 17). Muchos estudios sobre la protección de tejidos vivos mediante la utilización de la catalasa o la peroxidada frente a los efectos nocivos de radicales libres como el radical hidroxilo, entre otros, son significativamente concluyentes ante cultivos de fibroblastos (18), células epiteliales (19), células tiroideas (20), oligodendrocitos (21), etc. Además, la peroxidasa puede optimizar el efecto blanqueador del peróxido de hidrógeno y derivados, al realizar su función catalizadora específicamente, consiguiendo así un doble efecto; por un lado permitiendo la disminución de la concentración utilizada habitualmente de peróxido de hidrógeno y derivados y, por otra, la protección de los tejidos vivos expuestos de la cavidad oral, optimizando estas acciones debido al bajo consumo de energía libre y traduciéndose en reacciones suaves (figura 3). La realización de estudios clínicos controlados sobre pacientes utilizando espectrofotómetros y colorímetros, han contribuido en la objetivación de los resultados obtenidos con los productos blanqueadores (22).
Desarrollo
El peróxido de hidrógeno es un líquido con un potencial de oxidoreducción adecuado para actuar sobre un elevado número de moléculas orgánicas, incluidos lípidos, proteínas, vitaminas y carbohidratos. Sus posibles efectos tóxicos derivan de estas reacciones directas con las células como precursor de radicales libres. Esta inespecificidad de acción del peróxido de hidrógeno da lugar a que este agente blanqueador pueda provocar multitud de reacciones una vez está actuando en la boca. La acción de una enzima específica como la peroxidasa, el sustrato del cual es el peróxido de hidrógeno, permitirá canalizar todo el potencial blanqueador hacia la substancia teñida, disminuyendo o anulando la influencia de las reacciones secundarias. Esta focalización de la acción del peróxido de hidrógeno sobre el agente pigmentato del diente mediatizada por la presencia de la enzima peroxidasa, permite la utilización de menores cantidades de peróxido, y con igual cantidad, hacerlo más eficaz (23).
El peróxido de carbamida es un sólido derivado de la urea y del peróxido de hidrógeno que suele utilizarse para la preparación extemporánea de disoluciones de peróxido de hidrógeno. El peróxido de carbamida presenta propiedades blanqueadoras per se, no derivadas de su capacidad de ser precursor del peróxido de hidrógeno y, algo muy importante, la peroxidasa acelera el blanqueamiento producido por el peróxido de carbamida superando la capacidad blanqueadora del peróxido de hidrógeno. El sistema de blanqueamiento dental que produce la mayor decoloración es el constituido por la pareja peróxido de carbamida/peroxidasa, con un porcentaje de pérdida de color del 63,5%, muy superior al 35,7% de decoloración producido por la pareja peróxido de hidrógeno/peroxidasa (24).
Conclusiones
Esto es así porque las enzimas son catalizadores de naturaleza proteica que producen una disminución de la energía de activación necesaria para que los sustratos den lugar a los productos de la reacción. Las enzimas presentan un elevado poder catalítico, mucho más elevado que cualquier catalizador químico. Por otro lado, presentan generalmente un elevado grado de selectividad de reacción y de sustrato, que los capacita para poder dirigir la transformación selectiva de las substancias hacia determinados productos (25).
 |
Las peroxidasas pueden extraerse de diferentes fuentes animales o vegetales, como por ejemplo rábano, piña, patata, legumbres, tabaco, levaduras, leche y bacterias, y está presente también en la saliva.
Existen por lo tanto diferentes isoformas enzimáticas de las peroxidases y las características de las reacciones catalizadas las facultan para ser utilizadas como blanqueantes de diferentes tipos de productos. Así se introducen en los procedimientos de blanqueo de pinturas, alimentos, detergentes, etc. (26).
La idea de utilizar peroxidasa en los tratamientos de blanqueamiento dental tiene gran interés porque permite disminuir el tiempo necesario de contacto del agente blanqueador con el diente y los tejidos blandos de la cavidad oral, así como utilizar concentraciones más diluidas del agente blanqueador. La decoloración del diente se produce cuando entran en contacto el agente blanqueador con la substancia causante de la pigmentación de los dientes (figura 4). Como consecuencia se produce una reacción en la cual los sustratos pigmentados se transforman en productos incoloros (27).
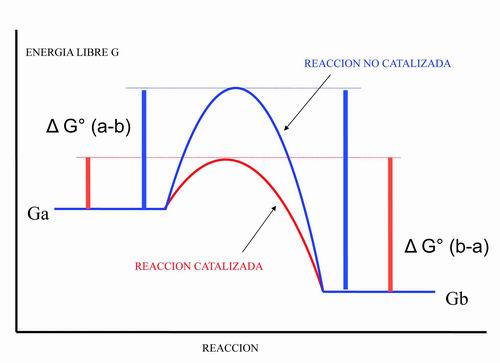 |
| Figura 3. La acción enzimática proporciona un bajo consumo de energía libre y unas reacciones suaves, traduciéndose en un mayor blanqueamiento dental con una menor concentración de principio activo y en un menor tiempo. |
En presencia de peroxidasa la reacción de decoloración se acelera, generándose los productos incoloros en un tiempo menor, proporcionando asimismo una mayor predictibilidad de los tratamientos blanqueantes (figura 5). La inespecificidad de la peroxidasa la capacita para poder catalizar la reacción de un mismo agente blanqueador o aceptor, el peróxido, con una diversidad de substancias teñidas donadoras, entre ellas las tetraciclinas, una de las principales causas de pigmentación dental de difícil eliminación (28).
Galería de imágenes
Correspondencia:
Pere Riutord Sbert
C/ Rosa Canals, 25-A. 07120 Palma de Mallorca
E-mail: pereriutord@ramib.org
Artículo elaborado por:
Dr. Pere Riutord Sbert
Doctor en Medicina y Cirugía. Médico Estomatólogo. Profesor Asociado UIB. Director del Máster en Odontología Estética UIB
Dr. Jaime Boyeras Castelló
Licenciado en Medicina y Cirugía. Licenciado en Odontología. Profesor Asociado UIB. Coordinador del Máster en Odontología Estética UIB
Dr. Andrés Martínez-Jover
Licenciado en Medicina y Cirugía. Médico Estomatólogo. Profesor Asociado UIB. Asesor de Dirección del Máster en Odontología Estética UIB
Dr. Leopoldo Forner Navarro
Doctor en Medicina y Cirugía Doctor en Odontología. Profesor Titular de Patología y Terapéutica Dental UV. Director del Diploma en Blanqueamiento Dental UV
Dr. José Amengual Lorenzo
Doctor en Odontología. Licenciado en Medicina y Cirugía. Presidente de la Sociedad Universitaria Valenciana de Blanqueamiento Dental. Profesor del Diploma
en Blanqueamiento Dental UV
Bibliografía
1. Berga-Caballero A, Forner-Navarro L, Amengual-Lorenzo J. At-home vital bleaching: a comparison of hydrogen peroxide and carbamide peroxide treatments. Med Oral Patol Oral Cir Bucal. 2006 Jan 1;11(1):E94-9
2. Alonso de la Peña V, Balboa Cabrita O. Comparison of the clinical efficacy and safety of carbamide peroxide and hydrogen peroxide in at-home bleaching gels. Quintessence Int. 2006 Jul-Aug;37(7):551-6.
3. Tredwin CJ, Naik S, Lewis NJ, Scully C. Hydrogen peroxide tooth-whitening (bleaching) products: review of adverse effects and safety issues. Br Dent J. 2006 Apr 8;200(7):371-6.
4. Haywood VB, Heymann HO. Nigthguard vital bleaching. Quintessence Int. 1989, 20:173-176.
5. Berga Caballero A, Forner Navarro L, Amengual Lorenzo J. In vivo evaluation of the effects of 10% carbamide peroxide and 3.5% hydrogen peroxide on the enamel surface. Med Oral Patol Oral Cir Bucal. 2007 Sep 1;12(5):E404-7
6. Rodrigues JA, Marchi GM, Ambrosano GM, Heymann HO, Pimenta LA. Microhardness evaluation of in situ vital bleaching on human dental enamel using a novel study design. Dent Mater. 2005 Nov;21(11):1059-67.
7. Yalcin F, Gürgan S. Effect of two different bleaching regimens on the gloss of tooth colored restorative materials. Dent Mater. 2005 May;21(5):464-8.
8. Heymann HO. Tooth whitening: facts and fallacies. Br Dent J. 2005 Apr 23;198(8):514.
9. Milnar FJ. Considering biomodification and remineralization techniques as adjuncts to vital tooth-bleaching regimens. Compend Contin Educ Dent. 2007 May;28(5):234-6, 238-40.
10. Fugaro JO, Nordahl I, Fugaro OJ, Matis BA, Mjör IA. Pulp reaction to vital bleaching. Oper Dent. 2004 Jul-Aug;29(4):363-8.
11. Fugaro OJ, Fugaro JO, Matis B, Gregory RL, Cochran MA, Mjör I. The dental pulp: inflammatory markers and vital bleaching. Am J Dent. 2005 Aug;18(4):229-32.
12. Joiner A. The bleaching of teeth: a review of the literature. J Dent. 2006 Aug;34(7):412-9.
13. Ribeiro DA, Marques ME, Salvadori DM. Study of DNA damage induced by dental bleaching agents in vitro. Braz Oral Res. 2006 Jan-Mar;20(1):47-51.
14. Pretty IA, Ellwood RP, Brunton PA, Aminian A. Vital tooth bleaching in dental practice: 1. Professional bleaching. Dent Update. 2006 Jun;33(5):288-90, 293-6, 299-300.
15. Kihn PW. Vital tooth whitening. Dent Clin North Am. 2007 Apr;51(2):319-31.
16. Bowles WH, Burns H Jr. Catalase/peroxidase activity in dental pulp. J Endod. 1992 Nov;18(11):527-34.
17. Rotstein I. Role of catalase in the elimination of residual hydrogen peroxide following tooth bleaching. J Endod. 1993 Nov;19(11):567-9.
18. Masaki H, Okano Y, Sakurai H. Differential role of catalase and glutathione peroxidase in cultured human fibroblasts under exposure of H2O2 or ultraviolet B light. Arch Dermatol Res. 1998 Mar;290(3):113-8.
19. Spector A, Yang Y, Ho YS, Magnenat JL, Wang RR, Ma W, Li WC. Variation in cellular glutathione peroxidase activity in lens epithelial cells, transgenics and knockouts does not significantly change the response to H2O2 stress. Exp Eye Res. 1996 May;62(5):521-40.
20. Björkman U, Ekholm R. Hydrogen peroxide degradation and glutathione peroxidase activity in cultures of thyroid cells. Mol Cell Endocrinol. 1995 Apr 28;111(1):99-107.
21. Baud O, Greene AE, Li J, Wang H, Volpe JJ, Rosenberg PA. Glutathione peroxidase-catalase cooperativity is required for resistance to hydrogen peroxide by mature rat oligodendrocytes. J Neurosci. 2004 Feb 18;24(7):1531-40.
22. Chu SJ. Use of a reflectance spectrophotometer in evaluating shade change resulting from tooth-whitening products. J Esthet Restor Dent. 2003;15. Suppl 1:S42-8
23. Fiedler RS, Reichl RB. Combined professional and home care nigthguard bleaching of tertracycline-stained teeth. Gen. Dent. 2000;48:257:61.
24. Pons A, Tur JA, Riutord P, Tauler P, Gimeno I, Balasch I, Sancho E. Teeth whitening product. European Patent Office Publication (Rijswijk). Published 14/08/2002. Granted 20/10/2004. Patent 00971448.6-2108-Es0000400, WO 01/35919.
25. Wiseman A. In: Horwood E, editor. Handbook of enzyme biotechnology. Chichester: LTD Publisher; 1985. p. 349.
26. Pütter J, Becker R. Peroxidases. In: Bergmeyer HU, editor. Methods in enzymatic analysis. Basel: Verlag chemie; 1983. p. 286-92.
27. Amengual-Lorenzo J, Forner-Navarro L, Riutord-Sbert P. Análisis del blanqueamiento dental obtenido con peróxido de carbamida activado enzimáticamente. Labor Dental. 2009, Nov-Dic;10(6):246-51.
28. Gimeno I, Riutord P, Tauler P, Tur JA, Pons A. The whitening effect of enzymatic bleaching on tetracycline. J Dent. 2008; 36:795-800.




