En los últimos años se ha hablado mucho de las células madre, de su enorme potencial terapéutico, de todas las controversias morales y éticas, de la legislación, de política y de la Unión Europea.
Hace poco, el día 24 de julio de 2006, la Unión Europea alcanzó un acuerdo entre sus miembros según el cual se cuadriplicarán las subvenciones oficiales para la investigación con células madre en aquellos países de la Unión cuya legislación la permita. Los ministros de Industria y Educación de los Veinticinco aprobaron el séptimo Programa Marco de Investigación, que contará con más de 50.000 millones de euros de financiación para el periodo 2007-2013.
Dicho acuerdo aporta financiación para la investigación sobre las células madre pero no para la obtención de las mismas.
Las células madre son células pluripotenciales, capaces de hacer copias exactas de sí mismas y de producir cualquier célula especializada. Las células madre son aquellas células dotadas simultáneamente de la capacidad de autorrenovarse y de originar células hijas que se pueden diferenciar hacia determinadas rutas de desarrollo convirtiéndose finalmente en tipos celulares especializados.
Existen dos tipos de células madre: células madre embrionarias y células madre adultas.
Las primeras son las que tienen mayor potencial terapéutico e investigador, pero hasta ahora han planteado muchos problemas éticos y morales porque se obtienen de fetos abortados o de óvulos fertilizados que han sobrado de fertilización in vitro. Se vienen obteniendo desde los años ochenta a partir de ratones y presentan dos importantes cualidades: pluripotencia y capacidad de contribuir a la línea germinal.
Se llama células madre germinales a las que se aíslan de fetos, a partir de la cresta germinal, donde se está produciendo la diferenciación de la línea germinal.
Las células madre adultas tienen en la célula madre hematopoyética su caso más significativo, que genera todos los tipos de células sanguíneas y del sistema inmunitario. En adultos se encuentran en la médula ósea y en periodo fetal en el bazo así como en el hígado. Los trasplantes de médula ósea tienen una muy importante aplicación clínica terapéutica desde hace muchos años para tratamiento de diversas patologías hematológicas, oncológicas e inmunitarias.
El objetivo de este artículo no es profundizar en conceptos biológicos acerca de la naturaleza de estas células, sino de acercarnos de forma comprensible las aplicaciones clínicas que ya existen con células madre y sus posibilidades de cara al futuro.
Entre las posibles aplicaciones futuras destacan su utilización para el diseño de nuevos medicamentos y su empleo para terapias celulares o incluso para la reparación de tejidos dañados.
En humanos adultos se conoce desde hace muchos años la existencia de células madre hematopoyéticas que residen en la médula ósea y dan origen a células sanguíneas e inmunes; también se conoce la existencia de células madre en la epidermis, y ambas presentan una elevada tasa de proliferación. No obstante, recientemente se ha descubierto que en el cerebro también existen células madre, en contra de lo que se pensaba, aunque con una baja tasa de proliferación.
Un punto a tener en cuenta es la llamada transdiferenciación de muchas células madre adultas. La transdiferenciación significa la capacidad de plasticidad de las células madre, es decir, la capacidad que tienen algunas de estas células al ser trasplantadas bajo unas determinadas condiciones en determinados tejidos de dar origen a linajes diferentes al suyo original. Así pues, se ha descubierto este hecho en ratones, en los que por ejemplo células madre neuronales han dado linajes de células musculares, o células de la médula ósea originando células hepáticas e incluso a células de la astrogía y microglía. Hasta ahora estos y otros descubrimientos similares han sido experimentados en ratones y en condiciones fisiológicas determinadas. No se conoce todavía la aptitud de estos experimentos en humanos con determinadas patologías, pero es evidente que las posibilidades terapéuticas que ofrece la utilización de células madre con esta sorpresiva flexibilidad para diferenciarse en líneas que no son las suyas originales es potencialmente inmensa.
Si se avanza en esta línea de investigación, como ya se está haciendo en Estados Unidos, se podrían obtener células madre aptas para terapias celulares y trasplantes sin la necesidad de obtenerlas a partir de embriones humanos, evitando el problema ético y moral que esto supone. Las autoridades tendrán que dejar a un lado sus reservas éticas y podrán apostar de una vez por todas por la investigación y terapia con células madre, levantando barreras legislativas y económicas.
Lo prometedor de la terapia con células madre para trasplantes de tejidos y terapias celulares es que se pueda prescindir de los problemas actuales que afectan a los aloinjertos: problemas de histocompatibilidad (pocos donantes compatibles), necesidad de administrar medicación inmunosupresora, con todos sus efectos secundarios e inconvenientes, riesgo de tumores, de infecciones….
Por esto se están persiguiendo unas determinadas características en las células madre para poder manejarlas con ciertas garantías, como son el carecer de potencial cancerígeno, ser susceptibles a modificaciones genéticas, poseer un fenotipo estable, tener la capacidad de autorrenovación indefinida, es decir, ser inmortal, y por supuesto ser pluripotente.
¿Qué se está haciendo en la actualidad? ¿Hacia dónde se están encaminando las investigaciones con células madre?
A continuación veremos algunos ejemplos de terapias experimentales con células madre.
En el campo de la neurología hay cierto optimismo para el tratamiento de la enfermedad de Parkinson, puesto que se ha logrado realizar trasplantes de células pluripotentes del mesencéfalo en ratas que presentaban parkinson. Estas células han originado neuronas funcionales dopaminérgicas y serotoninérgicas. Las ratas trasplantadas obtuvieron una recuperación transitoria.
 |
Todavía no se han encontrado células madre adultas en el propio corazón, pero sí se ha comprobado que células madre embrionarias humanas son capaces de originar cardiomiocitos (empresa Geron).
En 2001 un equipo del Medical College de Nueva York presentó un trabajo en el que ratones infartados recuperaron parte de su función cardiaca. Se les inyectó directamente células madre de médula ósea en el tejido miocárdico dañado. Histológicamente se objetivó que se habían regenerado músculo estriado y vasos sanguíneos.
En España hay hospitales como el Reina Sofía de Córdoba, en los que ya se están utilizando técnicas similares de inyección de células madre en corazones infartados humanos.
Hay grandes esperanzas en el aparato digestivo de cara al tratamiento de la diabetes. Estudios realizados en España por Bernat Soria (Universidad Miguel Hernandez de Elche) han logrado la curación en ratones diabéticos originando células secretoras de insulina a partir de células madre embrionarias de ratón. En la Universidad de Florida se ha logrado la reversión de diabetes en ratones mediante el trasplante de isotes de Langerhans generados a partir de células madre pancreáticas. Como éstos, existen actualmente muchos estudios y grupos de trabajo similares repartidos por Europa y los Estados Unidos.
También se ha descubierto la existencia de células madre de hepatocitos en la médula ósea, así como algunas células pancreáticas capaces de diferenciarse hacia hepatocitos.
Hay que destacar que las células madre embrionarias son susceptibles a la manipulación genética, pudiéndose plantear la terapia génica sustitutiva. Se reemplazan genes anómalos por versiones correctas para evitar o curar enfermedades. Esto es muy importante para enfermedades metabólicas y hematológicas, como por ejemplo la fenilcetonuria, la talasemia y la anemia falciforme, entre otras muchas. También se está investigando la creación de células inmunológicas modificadas genéticamente para combatir algunas enfermedades infecciosas, lo que supondría un paso de gigante para el tratamiento de algunas enfermedades consideradas “incurables” como el SIDA, hepatitis B y C, etc.
En especialidades como la traumatología y cirugía ortopédica siempre ha existido el problema de cómo y con qué sustituir tejido óseo insuficiente, infectado o defectuoso. Desde los años 60-70 en los que se impulsó mucho en avances para la cirugía traumatológica (hueso liofilizado) se han estado introduciendo diversos materiales de hueso artificial, pero ninguno ha demostrado ser tan eficaz como el propio hueso vivo de un autoinjerto. Por eso se investiga activamente para obtener tejido óseo autólogo sin el trauma de tener que obtenerlo de hueso sano del propio paciente. Esto plantea un nuevo problema: la matriz tridimensional sobre la que asientan las células. Éstas ya sabemos que se pueden obtener a partir de células madre, pero se necesitan estructuras organizadas tridimensionales, en las que las células se asienten y puedan organizarse para interaccionar con el organismo. Ya existen diversas matrices obtenidas a partir de varios materiales diferentes, como por ejemplo trozos de coral, cerámicas de hidroxiapatita y otros materiales artificiales. El coral aporta una matriz porosa reabsorbible, muy similar al hueso vivo. Por ser fáciles de obtener de la médula ósea se emplean células madre mesenquimales. Éstas pueden diferenciarse hacia osteoblastos cuando se tratan con factores como la vitamina C, corticoides o factores de crecimiento óseos como la BMP.
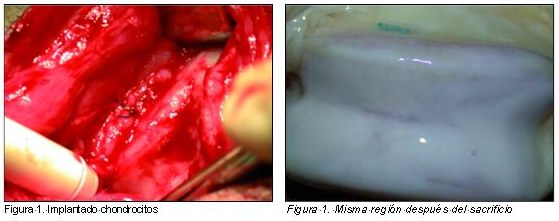
El trasplante autólogo de condrocitos es una técnica que se emplea desde hace algunos años para el tratamiento de determinadas lesiones articulares. El mayor problema que presentaba esta técnica era precisamente que, hasta hace poco, no se contaba con una matriz para dar estabilidad a los condrocitos y permitir que el tejido implantado se quede fijado al lugar exacto de la lesión condral sin diseminarse por toda la articulación. Hoy en día ya se investiga con resultados satisfactorios para obtener este soporte tridimensional.
La necrosis de la cabeza femoral es un problema que se presenta en adultos de edades no muy avanzadas, generalmente secundarias a tratamientos no protésicos de fracturas subcapitales o a necrosis avasculares o idiopáticas. La colocación de una prótesis de cadera se intenta retrasar lo máximo posible, por sus posibles complicaciones y revisiones necesarias por el desgaste protésico.
En estos momentos se están llevando a cabo estudios en los que se implantan células madre en la cabeza femoral. Los primeros resultados son bastante esperanzadores, pues se ha apreciado una regeneración parcial del tejido ncerosado. Falta por ver si los resutados son válidos a largo plazo.
Órganos huecos y macizos: ¿misión imposible? La respuesta es negativa. Ya se ha logrado reconstruir una vejiga urinaria en perros y se han logrado obtener arterias funcionales. Actualmente se está trabajando en la elaboración de riñones e hígados artificiales. Esto sin duda revolucionará la medicina moderna, haciendo posibles trasplantes de órganos macizos sin la necesidad de un donante humano.
En estos momentos existen numerosos productos comerciales aprobados en Europa y Estados Unidos derivados de piel, cartílago y hueso para su uso terapéutico como tejidos artificiales. Algunos ejemplos son el Chondrogel, Carticel, Apligraf, TransCyte, Dermagraft, entre otros.
Bibliografía
1. Fieldner MC. Research within the field of blood and marrow transplantation nursing: how can it contribute to higher quality of care? Journal: Int. J. Hematol; 2002 Aug 76 suppl 20:289-91.
2. Enrique Guerado Parra, José Becerra Ratia. Hospital Costa del Sol, Marbella, Málaga, España. Los fundamentos de la osteogénesis y la biología regenerativa. Rev. Mex. Ortop. Trauma 2002; 16 (3); mayo-junio: 181-182.
3. Austin TW, Lagasse E. Hepatic regeneration from heamtopoyetic stem cells. Mich. Dev; 2003 Jan; 120 (1): 131-5.
4. Pedersen RA. Developments in human embryonic stem cells. Reprod. Biomed Online; 2005 Mar; 10 suppl 10: 60-2.
5. Terkikh AV, Bryant PJ, Schwatrz PH. Mammalian stem cells. Pediatr. Res; 2006 Apr; 59 (4Pt2): 13R-20R.
6. Wager Aj, Weissman IL. Plasticity of adult stem cells. Cell 2004; 116: 639-48.
7. Sugiyama O, Orimo H, Suzuki, S, Yamashita K, Ito, H, Shimada T. Bone formation following transplantation of genetically modified primary bone marrow stomal cells. Journal of Orthopaedic Research, Vol 21, Issue 4, 2003, pp. 630-637.
8. Oh J, Kang H, Hyung J, Jang Y. Autologous bone-marrow stem cells for myocardial infarction. The Lancet, Vol. 368, Issue 9529, 2006, p. 27.
9. Janssens S, Dubois C, Bogaert J, Theunissen K, Deroose C, Desmet W, Kalantzi M, Lieven H, Sinnaeve P, Dens J. Autologous bone-marrow derived stem cells transfer in patients with ST-segment elevation myocardial infarction: double-blind randomised controlled trial. The Lancet, Vol. 367, Issue 9505, 14 Jan2006-20 Jan 2006, pp. 113-121.
10. Simón C. Células madre embrionarias humanas. Líneas de investigación Fundación IVI. http://www.ivi.es/fundacion/investigacion1.htm.
11. Iañez E. Células madre y clonación terapéutica. Departamento de Microbiología e Instituto de Biotecnología, Universidad de Granada. http: //www.ugr.es/~eianez/Biotecnologia/clonembrion.ht.
12. Grande D, Mason J, Light E, Dines D. Stem cells as platforms for delivery of genes to enhance cartilage repair. Journal of Bone and Joint Surgery. Am., Apr 2003; 85: 111-116.
13. Arinzeh TL, Peter SJ, Archambault MP, van den Bos C, Gordon S, Kraus K, Smith A, Kadiyala S. Allogenic mesenchymal stem cells regenerate bone in a ctritical-sized canine segmental defect. Journal of Bone and joint Surgery, Am., Oct 2003; 85: 1.927-1.935.
14. Quintana-Bustamante O, Atvarez-Barrientos A, Fabregat I, Bueren JA, Segovia JC. Regeneración hepática con células madre adultas. Haematologica (Edición española), vol 89, extraordin 1, oct 2004, pp. 283-286.
15. Roche E, Burcin M, Esser S, Rüdiger M, Soria B. The use of gating technology in bioengineering insulin-secreting cells from embryonic stem cells. Cytotechnology 2003; 41: 145-151.




