(continuación…)
5. Dimensiones clínicas del dolor (21, 34, 35)
El dolor es una percepción que posee varias dimensiones: duración, intensidad, localización, características y percepción.
5.1. Duración
Es el tiempo durante el cual se percibe el dolor. Este puede ser continuo o intermitente y, en la mayoría de los casos, la duración está relacionada directamente con la nocicepción. En clínica se ha convenido en denominar al dolor, de acuerdo con su duración, como agudo y crónico.
Dolor agudo es aquel dolor cuya duración es menor de tres meses. Produce un incremento de secreción de las glándulas sudoríparas, de la tensión muscular y de la presión sanguínea, dilatación de las pupilas e intensificación de la frecuencia respiratoria. Lo que habitualmente denominamos cambios vegetativos. También, puede producir ansiedad y habitualmente responde bien a los analgésicos y/o AINES habituales.
Dolor crónico es el dolor que ha tenido una duración mayor de tres meses, en forma continua o intermitente. Generalmente es un dolor con características patológicas, que puede persistir aún después de la curación de la lesión. Los pacientes muestran cambios vegetativos y presentan signos y síntomas depresivos que empeoran el cuadro clínico, con frecuencia se da en las enfermedades músculo esqueléticas que suelen cursar con dolor miofascial y además muestran un cuadro complejo de síntomas pudiendo dificultar el diagnóstico. Hay trastornos del sueño. Hoy lo denominamos síndrome ansioso-depresivo.
Es de manejo difícil y habitualmente requiere tratamiento por parte de equipos interdisciplinares. El interrogatorio y el examen clínico de los pacientes nos pueden ayudar a encontrar la causa y si es posible hallar un tratamiento adecuado o al menos paliativo.
Los estudios neurofisiológicos nos pueden aportar elementos diagnósticos importantes, por lo que debemos solicitarlos siempre que consideremos su ayuda en la orientación etiológica, la topografía del dolor, su grado de severidad y la orientación prónostica.
5.2. Intensidad
Es la magnitud del dolor percibido. La intensidad no depende solamente de la nocicepción. En ella influyen otros factores de orden psicológico, social y cultural, como decía Melzak. No obstante, la intensidad del dolor es un fenómeno subjetivo y por tanto es conveniente utilizar métodos que nos permitan medirla, por ejemplo la escala visual analógica (EVA). En esta, la intensidad del dolor es determinada por el mismo paciente sobre una línea recta cuyos dos extremos están marcados 0 y 10. El número 0 indica ausencia del dolor y el 10 describe al dolor más intenso que el sujeto pueda imaginar.
Intensidad del dolor EVA
Sin dolor 0 _______________________ 10 Máximo dolor
 |
5.3. Localización
Es el lugar del cuerpo donde el dolor es percibido.
Por ejemplo, el dolor somático se produce por la activación de los nociceptores de la piel, hueso y partes blandas. Es un dolor sordo, continuo y bien localizado, por ejemplo un dolor de hueso o de una artritis. Suelen responder bien al tratamiento con analgésicos según la escalera de la OMS. El ejemplo más típico en dentistería sería una periodontitis.
Otra muestra, sería el dolor visceral que está ocasionado por la activación de nociceptores por infiltración, compresión, distensión, tracción o isquemia de vísceras pélvicas, abdominales o torácicas. Se añade, además, el espasmo de la musculatura lisa en vísceras huecas. Se trata de un dolor pobremente localizado, descrito a menudo como profundo y opresivo, con la excepción del dolor ulceroso duodenal localizado a punta de dedo.
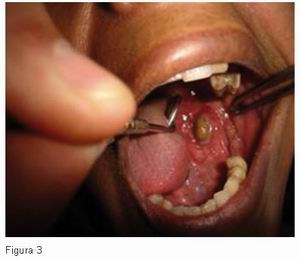
Cuando es agudo se acompaña frecuentemente de manifestaciones vegetativas como náuseas, vómitos, sudoración, taquicardia y aumento de la presión arterial. Con frecuencia, el dolor se refiere a localizaciones cutáneas que pueden estar distantes de la lesión, como por ejemplo el dolor de hombro derecho en lesiones biliares o hepáticas. El ejemplo en odontología sería una sialolitiasis aguda (Figura 3) o una sialoadenitis infecciosa aguda.
5.4. Características
Permiten describir el tipo de dolor que se percibe, por ejemplo, si es quemante, punzante, eléctrico, como un calambre, etc. Algunos dolores poseen una cualidad típica. Tal es el caso de las descargas eléctricas de las neuralgias del trigémino o de la sensación de quemadura en algunos dolores neuropáticos de las glosodinias.
5.5. Percepción
La influencia de la cultura y la etnia en la percepción y la expresión del dolor es un tema de investigación desde los años cincuenta (Zborowski). En los noventa Zatzick y colaboradores (33) en un metaanálisis de trece trabajos publicados no se encontró relación en la capacidad de diferenciar estímulos dolorosos entre grupos étnicos. No obstante, la valoración de la percepción del dolor entre hombres y mujeres denota una sensibilidad algo mayor al dolor para las féminas que para los varones.
6. Mecanismos de producción del dolor clínico (21, 34, 35)
De acuerdo con su fisiopatología el dolor clínico puede ser:
6.1. Nociceptivo, también llamado Inflamatorio, que es el producido por una lesión tisular que desencadena la liberación de sustancias químicas que estimulan directamente a los nociceptores.
 |
6.2. Neuropático debido a la lesión o disfunción de alguna parte del Sistema Nervioso.
6.3. Miofascial por una alteración neuromuscular.
6.4. Funcional por una disfunción en la gestión de la neurotransmisión. Ejemplos serían: la fibromialgia, el colon irritable, la cistitis intersticial y la cefalea tensional. No hay lesión, hay alteración de la función con respuesta aumentada al impulso doloroso.
Finalmente, si no se puede determinar el mecanismo causal, hablaremos de un dolor idiopático.
Algunos autores incluyen en esta clasificación el dolor psicógeno, el cual sólo puede diagnosticarse por exclusión, pues no hay prueba directa de su existencia. Aunque también es verdad, que todo dolor tiene componentes psicológicos y algunas veces puede estigmatizar al paciente al ser este catalogado como neurótico o hipocondriaco y forzarle a un peregrinaje de médico en médico.
El dolor nociceptivo se divide, de acuerdo con la localización de la lesión que lo produce, en: somático y visceral.
El dolor somático es superficial cuando la lesión causante del dolor se localiza en la piel, o en el tejido celular subcutáneo, y profundo en el caso de los dolores del sistema óseo-músculo-articular.
El dolor visceral es aquel que tiene su origen en las vísceras de las cavidades craneana, torácica o abdominal.
El dolor neuropático se divide en periférico, si la lesión afecta los nervios periféricos, y central, cuando la lesión altera alguna estructura del neuroeje. En la actualidad se está popularizando la tendencia a llamar dolor neuropático, solamente al dolor periférico, y dolor central, sin el calificativo de neuropático, al dolor causado por lesiones en el neuroeje. Sin embargo, los mecanismos fisiopatológicos de estos dos tipos de dolores pueden ser similares.
Características del dolor
• Evolución: agudo y crónico.
• Localización: dolor de cabeza (cefalea), dolor dental, dolor abdominal…
• Tipo: punzante, opresivo, lacerante, cólico, eléctrico, etc.
• Duración: el tiempo desde su aparición, desde cuándo.
• Irradiación: es el trayecto que recorre el dolor desde su localización original hasta otro lugar. Muy frecuente en odontología.
• Frecuencia: es el número de veces que ha ocurrido el dolor de similares características.
• Intensidad: generalmente cuando es el primer dolor suele ser intenso o fuerte, pero cuando se ha repetido varias veces en el tiempo, se puede cuantificar.
• Síntomas acompañantes: náuseas, vómitos, diarrea, fiebre, temblor…
• Signos acompañantes: sudoración, palidez, escalofríos, trastornos neurológicos…
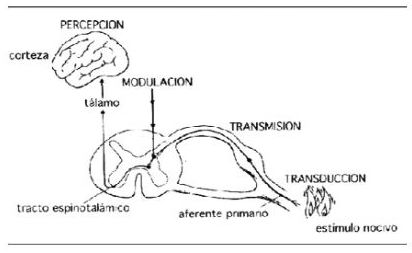
7. Los cuatro procesos fisiológicos en el dolor (22-25, 34, 35)
7.1. Transducción: proceso por el cual el estímulo nocivo periférico se transfo
7.2. Transmisión: propagación del impulso nervioso hasta los niveles sensoriales del SNC.
7.3. Modulación: capacidad que tienen los sistemas analgésicos endógenos de modificar la transmisión del impulso nervioso, fundamentalmente inhibición en las astas dorsales de la médula, pero también a otros niveles (periférico).
7.4. Percepción: proceso final en que los tres primeros, interactuando con una serie de otros fenómenos individuales, crean la experiencia subjetiva y emocional denominada dolor.
8. La fisiología de la nocicepción
8.1. Los nociceptores
Son los receptores especializados en la detección de estímulos nocivos.
Morfológicamente son terminaciones nerviosas libres de fibras Aδ (mielínicas) y C (amielínicas) que funcionan como transductores biológicos. Sus cuerpos celulares de origen se localizan en los ganglios de la raíz dorsal (GRD) o en los ganglios sensoriales de los pares craneanos correspondientes, y se conocen como neuronas de primer orden o aferentes primarios, de la vía nociceptiva.
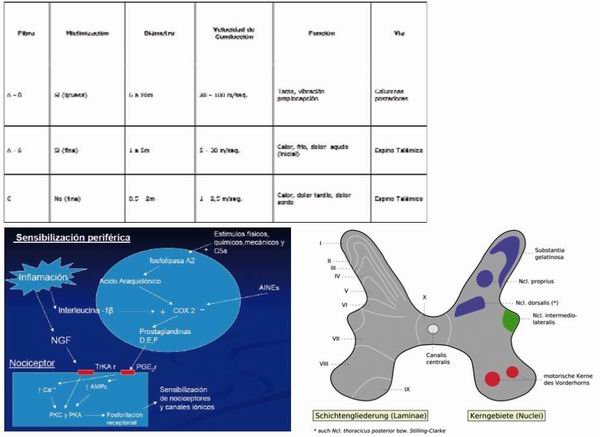
Las fibras A ∂ poseen un diámetro de 1 a 5 mm y una velocidad de conducción de 5 a 30 m/seg. Las fibras C tienen un diámetro de 0,5 a 2 mm y una velocidad de conducción de 1 a 2,5 m/seg.
Cuando se produce una lesión superficial en la piel, se perciben dos clases de dolores: uno inicial, rápido, de corta duración, bien localizado, debido a la actividad de las fibras A ∂, llamado dolor primario y, otro, de aparición más tardía, lento, persistente y difuso, debido a la actividad de las fibras C, llamado dolor secundario. Los nociceptores pueden clasificarse funcionalmente como mecano-nociceptores, termo-nociceptores y polimodales.
Los tres tipos de nociceptores se encuentran en la piel y en la mayoría de las vísceras y, algunos de ellos, han sido identificados como canales de membrana.
Los mecano-nociceptores son fibras A ∂ que se activan por estímulos de presión intensa. Los termo-nociceptores corresponden a fibras A ∂ y son activados por temperaturas superiores a 45 °C o inferiores a 5 °C. Los nociceptores polimodales pertenecen a fibras C y son activados por una gran variedad de sustancias químicas, estímulos mecánicos intensos y temperaturas extremas de frío o calor. El nociceptor de fibras C se encuentra a una profundidad entre 20 y 570 mm y su actividad evoca una sensación tipo ardor o dolor sordo. El tamaño de su campo receptor en humanos es de cerca de 100 mm cuadrados y las áreas de los campos receptores vecinos tienden a fusionarse.
La activación de los nociceptores da lugar a la generación de potenciales de acción que inducen, a su vez, la liberación de neurotrasmisores en el asta dorsal de la médula espinal. De éstos, los principales son: el glutamato, que da lugar a potenciales sinápticos rápidos en las neuronas del asta dorsal, y la sustancia P, liberada en la mayor parte de las terminaciones tipo C.
Además, las fibras aferentes de las neuronas de los GRD pueden liberar antidrómicamente sustancias químicas proinflamatorias dando lugar a la llamada inflamación neurogénica de los tejidos lesionados.
La mayoría de los nociceptores descritos tiene la propiedad de disminuir su umbral, o de aumentar su respuesta, cuando son sometidos a estimulación repetitiva. Este fenómeno se llama sensibilización periférica y puede ser de dos clases: autosensibilización, cuando es debida a acomodación de la membrana del nociceptor, o heterosensibilización, cuando se debe a la acción de sustancias químicas presentes en la zona de lesión.
Cuando se produce una lesión tisular, se desencadena una cascada de liberación de sustancias inflamatorias sensibilizantes o excitadoras de los nociceptores. Entre ellas se mencionan iones K+ y H+, serotonina, bradiquinina, histamina, prostaglandinas, leucotrienos y Sustancia P.
Algunos tejidos, especialmente viscerales, poseen nociceptores que inicialmente no son activados por los estímulos nocivos pero que, luego de estímulos repetidos e intensos, responden en forma notoria. Estos receptores se conocen como nociceptores silenciosos.
La primera sinapsis de la vía de la nocicepción se halla en el asta dorsal de la médula espinal o en los núcleos sensoriales de los pares craneanos correspondientes. El asta dorsal comprende seis capas histológicas, denominadas por Rexed como láminas I (la más superficial) a VI (la más profunda). Las neuronas nociceptivas de segundo orden (NNSO) se localizan en las Láminas I y II. Hacen sinapsis con fibras A y C y se dividen en dos clases: las neuronas nociceptivas específicas que responden solamente a estímulos nocivos y las neuronas de rango dinámico amplio (WDR) que pueden responder tanto a estímulos mecánicos nocivos como no nocivos. Las Láminas III y IV contienen neuronas que responden a estímulos no nocivos, provenientes de fibras Aß. Las neuronas de la lámina V son, básicamente, neuronas WDR que reciben información de fibras Aß, A ∂ y C. Finalmente, las neuronas de la Lámina VI reciben impulsos mecánicos no nocivos provenientes de músculos y articulaciones.
Las NNSO pueden sufrir cambios funcionales duraderos. Así, luego de estimulación repetida y persistente, las neuronas pueden aumentar progresivamente su respuesta. Este fenómeno llamado “wind-up” depende de la actividad de receptores de glutamato NMDA. En general, la hiperexcitabilidad de las NNSO debida a causas, como la anterior, se denomina Sensibilización central.
Mecanismos de progresión del dolor
1. Nocicepción
2. Sensibilización periférica
3. Cambios fenotípicos
4. Sensibilización central
5. Excitabilidad ectópica
6. Reorganización estructural
7. Pérdida de sistemas inhibitorios
 |
8.2. Vías nociceptivas ascendentes
Los axones de las NNSO se proyectan a niveles superiores del sistema nervioso central dando lugar a, por lo menos, cinco haces diferentes: espinotalámico, espinoreticular, espinomesencefálico, cervicotalámico y espinohipotalámico.
El haz espinotalámico está conformado por axones que cruzan al lado contralateral de la médula y ascienden en la sustancia blanca anterolateral hasta los núcleos ventral posterolateral y ventral posteromedial talámicos.
Las vías espinotalámica y trigémino talámica son las relacionadas con la sensación de dolor, en la especie humana son las más importantes y constituyen alrededor del 90% de todas las vías ascendentes.
9. Modulación del dolor a través de la Teoría de la Compuerta (1, 2, 26-32)
En 1965 Melzack y Wall propusieron la teoría de la Compuerta para explicar los fenómenos relacionados con el dolor y su modulación.
Es un esclarecimiento de cómo la mente y determinados estímulos táctiles o de presión desempeñan un papel esencial en la modificación del dolor.
Sugirieron que habría un sistema de bloqueo a nivel del SN que hace que se abran o se cierren las vías o del dolor.
Las puertas se pueden abrir, dejando pasar el dolor a través de las fibras aferentes hacia el cortex o a través de las fibras eferentes hacia la periferia.
Las puertas se pueden cerrar para bloquear estos caminos del dolor, este mecanismo puede ser influenciado por impulsos nerviosos aferentes o eferentes.
El mensaje enviado desde el cerebro (vías eferentes) al área donde se siente el dolor se puede modificar por medio de la mente.
Muchos factores externos afectan la interpretación del dolor tales como emociones, experiencias anteriores con dolor y ansiedad.
Esta teoría integra componentes fisiológicos, psicológicos, cognoscitivos y emocionales que regulan la percepción del dolor.
Melzack postuló que una persona podría modular su dolor usando fuerzas externas. Sus ideas sobre los aspectos interpretativos del dolor forman la base de la teoría de la compuerta.
La teoría de la compuerta explica porqué disminuye el dolor cuando el cerebro está experimentando una sensación de distracción.
En estas circunstancias, la percepción del dolor se reduce porque su interpretación es modulada por la experiencia agradable de la distracción.
Puntos a tener en cuenta:
1. Compuerta espinal.
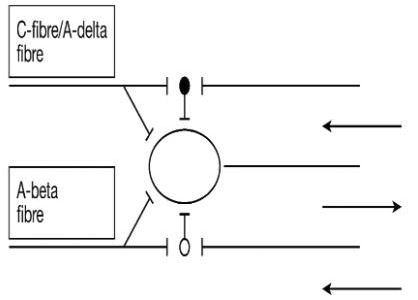
La actividad de las células de la sustancia gelatinosa (SG, está en el vértice del asta posterior a lo largo de toda la médula espinal, está relacionada con la información termoalgésica y táctil, Lámina II o III) modulan y regulan el ingreso de los impulsos nerviosos procedentes de fibras aferentes a las células de transición o células T (Lámina V).
2. Las células de la sustancia gelatinosa influyen de dos maneras en la transmisión del impulso aferente a las células T.
a) A nivel presináptico: bloqueando los impulsos o reduciendo la cantidad de neurotransmisor liberado por los axones de las fibras A delta y C.
b) A nivel postsináptico: modificando la receptividad de los impulsos que llegan.
3. Las fibras A delta y C facilitan la transmisión (abrir com (puerta) inhibiendo a las células de la sustancia gelatinosa.
Las fibras A delta y C están directamente relacionadas con la transmisión del estímulo doloroso.
4. Las fibras A alfa y beta excitan a las células de la sustancia gelatinosa inhibiendo la transmisión y cerrando compuerta.
Las fibras A beta están directamente relacionadas con las aferencias táctiles y de presión. Las fibras A alfa están directamente relacionadas con la función motora grosera, la propicepción y las fibras extrafusales del músculo estriado.
Aquí, por ejemplo, la fisioterapia tiene su función antiálgica, ya que si estimulamos estos tipos de fibras ayudaremos a disminuir o aliviar el dolor porque cerraremos la compuerta.
5. Las células de la Lámina V (células T): son excitadas o inhibidas por las células de sustancia gelatinosa.
6. Compuerta raquídea.
La estimulación de fibras A alfa activa de inmediato los mecanismos centrales, ascendiendo por los cordones dorsales de la médula y las vías dorso laterales a través del lemnisco medial hacia tálamo posterior; proporcionando información mucho antes de la llegada de las vías del dolor.
Este sistema pone en alerta receptores centrales y activa mecanismos selectivos como:
• Experiencia previa. Emociones.
• Cognición. Respuestas.
A continuación desciende información cortical por las fibras eferentes para activar la compuerta raquídea; antes de la activación central de las células T.
La combinación de impulsos aferentes periféricos modulados por S.G. y centrales descendentes producen la actividad de las células transmisoras de la médula espinal.
 |
10. Modulación del dolor a través del sistema opioide interno (21)
Además de este mecanismo espinal modulador de la nocicepción existe un completo sistema analgésico intrínseco. Este sistema comenzó a ser estudiado a partir de las investigaciones sobre los efectos analgésicos de la morfina y sus derivados. Así, se logródemostrar la existencia de sustancias endógenas localizadas en el sistema nervioso central y en otras áreas corporales como la hipófisis y el intestino, que se unen a receptores de membrana que también aceptan a la morfina y a sus derivados. Estas sustancias, denominadas globalmente como endorfinas u opioides endógenos, son péptidos de bajo peso molecular, con estructura bioquímica diferente a la de la morfina. Se han identificado tres tipos de receptores de opioides que pertenecen al tipo de receptores mediados por proteínas G. Los opioides endógenos que se ligan a estos receptores son las encefalinas, la beta-endorfina y las dinorfinas. La beta-endorfina se expresa básicamente en la hipófisis, a partir del polipéptido proopiomelanocortina (POMC), que también es precursor de la corticotropina (ACTH) y de la hormona melanino-estimulante.
La estimulación eléctrica, en humanos, de la región anterior del hipotálamo, de las áreas septales anteriores y de varias zonas de la sustancia gris periacueductal (PAG) produce control efectivo del dolor. Esta analgesia es mediada por opioides endógenos pues puede ser bloqueada por naloxona, un antagonista opioide. De la PAG descienden tres vías que juegan un papel central en la inhibición del dolor:
1. la que se dirige a la región rostromedial vecina al núcleo locus coeruleus, 2) una proyección al núcleo paragigantocellularis y 3) la más importante, la eferencia a los núcleos del rafé, especialmente al núcleo magnus. La estimulación directa del núcleo magnus del rafé produce analgesia y se considera que esta acción es mediada por la acción de neuronas serotoninérgicas, cuyos axones descienden por la parte dorsal del cordón lateral hacia el asta dorsal de la médula, donde hacen sinapsis con interneuronas inhibitorias en las Láminas I, II y V de Rexed.
11. Función talámica (21)
Fueron Head y Holmes en 1911 quienes describieron el papel crítico del tálamo en la sensación dolorosa al describir el síndrome doloroso talámico de Dejerine-Roussy, conocido actualmente como dolor central. Este síndrome causa en el paciente un dolor persistente descrito como un dolor quemante en un área del cuerpo (cara, brazo o un hemicuerpo) asociado a una paradójica pérdida de la sensibilidad cutánea a la estimulación dolorosa y acompañado casi siempre de termo anestesia y alodinia.
Por tanto, se desprende que el estímulo doloroso activa múltiples vías y regiones del cerebro que son integradas a la experiencia pasada y al contexto actual lo que resulta una experiencia multidimensional compleja.
El tálamo es la segunda estación de relevo en las vías ascendentes clásicas de la sensibilidad dolorosa y no dolorosa. Se distinguen los siguientes núcleos:
• Núcleo ventral posterior (NVP). Es el núcleo de relevo principal del SSS (sistema somato sensorial) hacia la corteza somato sensorial (S1), el cual contiene una representación somato tópica de lasuperficie mecano receptiva cutánea.
• Núcleo ventro postero medial (NVPM) al que llega la vía trigémino talámica proveniente de la cara.
• Núcleo ventro posterolateral (NVPL) al que llega la vía espino talámica proveniente del miembro/superior y el inferior.
En pacientes con síndromes dolorosos por desaferentación (miembro fantasma), las neuronas de este núcleo (NVPL) desarrollan una actividad espontánea explosiva que puede estar en relación con su cuadro clínico; por contraste, la estimulación eléctrica con electrodos implantados puede aliviar el cuadro doloroso. La inyección de lidocaína en el NVPM del mono altera su conducta discriminativa entre un estímulo nocivo de uno inocuo.
• Núcleo medial dorsal (NMD).
La aferencia a la región ventro caudal del NMD desde la Lámina I y su proyección hacia la región anterior del cíngulo (área 24) revelan su importancia en el procesamiento del dolor.
Estudios en monos revelan la presencia de neuronas NE (no específicas) con campos receptivos amplios y a veces bilaterales, la actividad de sus neuronas puede ser inhibida por estímulos termales inocuos (temperatura fría y tibia), lo que es consistente con la observación clínica de la analgesia inducida por el frío.
No se conoce, con certeza, la función que realiza el tálamo en el procesamiento de la información nociceptiva en el humano. Sin embargo, hay evidencia, mediante registros de potenciales evocados, de que el tálamo recibe información nociceptiva bien organizada topográficamente. Además, los resultados de la estimulación eléctrica y el efecto de algunas lesiones del tálamo, especialmente el denominado Síndrome Talámico, permiten plantear que esa estructura es fundamental para la percepción del dolor.
12. Papel del cerebro en la percepción del dolor
La experiencia del dolor sólo puede ser definida en términos de una experiencia sensorial difícil de cuantificar. Dolor no es siempre sinónimo de nocicepción, si bien la nocicepción puede darnos una experiencia dolorosa y ocurrir también en ausencia de dolor. Esto último explica la existencia de términos como dolor no nociceptivo (dolor neuropático) y el dolor nociceptivo (por ejemplo, dolor inflamatorio).
La experiencia dolorosa varía desde el dolor relacionado con un daño tisular y el dolor generado sin un impulso físico periférico. El cerebro actúa como un gobierno que puede o no ser controlado por la interacción con el medio ambiente interno o externo del cuerpo. Para entender esta interacción se requieren métodos no invasivos para medir la respuesta cerebral humana. La técnica de electrofisiología de superficie puede ser de utilidad para entender los eventos cerebrales iníciales (los primeros 800 milisegundos) de cómo el cerebro procesa los impulsos nociceptivos y elabora la experiencia del dolor (36). Las áreas de representación del dolor en el cerebro no están uniformemente definidas, pero sí se puede decir que incluyen una serie de lugares fundamentales: el tálamo y área somática primaria (SI), área somática secundaria (SII), cortex insular, cortex prefrontal, cíngulo y la corteza parietal (37).
Al poner a animales en situaciones amenazantes como ante la proximidad de un depredador, algunos animales se petrifican y no responden a estímulos nocivos; esta respuesta es parte del repertorio conductual al miedo que presumiblemente ayuda a la supervivencia al aumentar las posibilidades de que el animal escape a la detección, una respuesta similar puede ser también aprendida. La analgesia que acompaña a estas situaciones de miedo puede ser bloqueada por lesiones en la amígdala, así también como por la aplicación de naloxona sistémica (38).
Duncan y colaboradores demostraron en un experimento en monos, que con el aprendizaje, una señal contextual neutra adquiere el poder de incrementar o disminuir la actividad de las neuronas nociceptoras del APME (asta posterior de la medula) en ausencia de estímulo nocivo; estudios como este incrementan la posibilidad de que el dolor puede ser producido por un manejo de origen central de las neuronas nociceptivas del APME, sin la activación de los nociceptores aferentes primarios (39).
Otro fenómeno interesante en la práctica médica es la analgesia por placebo; los estudios sugieren que este tipo de analgesia es mediada por la acción de circuitos mediados por opioides (40). Más recientemente se ha demostrado que la analgesia por placebo no sólo se reduce por la aplicación de naloxona, sino que además puede incrementarse por la utilización de antagonistas de la CCK (colecistoquinina) (41).
13. Conclusión
Los mecanismos de producción del dolor son múltiples y complejos.
La mayoría de ellos se desconocen. Aunque hay mecanismos etiológicos comunes en muchas patologías, debemos investigar con precisión la fisiopatología específica para cada entidad clínica, sólo de esta manera, podremos lograr en el futuro, tratamientos más racionales y efectivos para el paciente con dolor.
La investigación debe seguir avanzando, no sólo desde el aspecto farmacológico sino también en aspectos diversos como la neurociencia, la genética, la bioquímica, la fisioterapia, la medicina física, la rehabilitación, la neurofisiología, la psicología, la osteopatía, etc., hasta conformar un tratamiento integral del dolor, especialmente en el dolor crónico al ser este el que más condiciona la calidad de vida de los pacientes.
Y en ningún caso deberíamos olvidar el pensamiento de nuestro ilustre cordobés. Séneca decía: ”El dolor está extendido en la tierra en proporción más vasta que la alegría; quien crea que no ha sufrido, sólo tiene que tener un poco de paciencia».
BIBLIOGRAFÍA
1. Melzack R. From the gate to the neuromatrix. Pain 1999; 6 (suppl): S121-S126.
2. Melzack R. Wall PD. Pain mechanisms: a new theory. Science 1965; 150: 971-979.
3. Guyton AC, Hall JA. Tratado de fisiología médica. 10.ª ed., McGraw-Hill 2001, 669-680
4. Ganong WF. Fisiología médica, 16.ª ed., Manual moderno 1998, 160-167.
5. Rouviere. Anatomia Humana. Vol. 2, tronco. Editorial Masson, 2005.
6. Wall P. Inflammatory and neurogenic pain: new molecules, new mechanisms. Br J Anaesth 1995; 75.
7. Ollat H, Cesaro P. Neurogenic pain. P Clin Neuropharmacol 1995; 18: 391-404.
8. Calvo J, Martín J, Sombrero I, Alonso V, Castan E, Blanc M, Benabarre A, Pifarre J. La inflamación neurogénica en la psoriasis: una nueva hipótesis fisiopatológica. Rev Psiquiatría Fac Med Barna 2005; 32(3): 120-132.
9. Gabriel R, Sánchez- Magro I, Tornero J, Gamero F, Carbonell J. El dolor en las consultas de Reumatologías españolas: estudio epidemiológico EPIDOR. Rev Clin Esp 2004; 204(5): 157-63.
10. Villanueva VL, Valía JC, Cerdá G, Monsalve V, Bayona MJ, de Andrés J. Fibromialgia: diagnóstico y tratamiento. El estado de la cuestión. Rev Soc Esp Dolor 2004; 11: 430-443.
11. Travell J, Simons D. Dolor y disfunción miofascial. El Manual de los Puntos Gatillo. Vol. 2. Ed. Panamericana, 1999.
12. David G. Simons D. Understanding effective treatments of myofascial trigger points. Journal of Bodywork and Movement Therapies.2002; 6 (2): 81-88.
13. Travell J, Simons D. Dolor y disfunción miofascial. El Manual de los Puntos Gatillo. Vol. Ed. Panamericana, 1999, 138-152
14. Cervero, F. Visceral pain: mechanisms of peripheral and central sensitization. Ann Med. 1995 Apr; 27(2): 235- 239.
15. Cervero F. Visceral pain-central sensitization. Gut. 2000 Dec; 47 Suppl 4: iv56-7; discussion iv58. Review.
16. Woolf, CJ & Mannion, RJ. Neuropathic pain: aetiology, symptoms, mechanisms, and management. Lancet 353, 1959-1964 (1999).
17. Serra J. Overview of neuropathic pain syndromes. Acta Neurol Scand.1999; 100 (suppl): 7-11.
18. Raja SN, Grabow TS. Complex regional pain syndrome I (Reflex Sympathetic Dystrophy) Anesthesiology 2002; 96: 1254-1260.
19. Reuben SS, Rosenthal EA, Steinberg RB. Surgery on affected upper extremity of patients with a history of complex regional pain syndrome: a retrospective study of 100 patients. J Hand Surg.(Am) 2000; 25: 1147-51.
20. Manning DC. Reflex Sympathetic Dystrophy, Sympathetically Maintained Pain, and Complex Regional Pain Syndrome: Diagnoses of Inclusion, Exclusion, or Confusion? J Hand Ther 2000; 13: 260-268.
21. Loeser J. Bonica Terapéutica del dolor. Vol.1, Editorial Interamericana, 2003.
22. Fisiología del dolor. En: Aliaga L, Baños JE, De Barutell C, Molet J, Rodríguez de la Serna A. Tratamiento del dolor. Teoría y práctica. Barcelona: Editorial MCR, 1995; 9-25 Burgess PR, Perl ER.
23. Cutaneous mechanoreceptors and nociceptors. En: Iggo A (ed.) Handbook of sensory Physiology. Springer- Verlag. Berlin 1973; 2: 29-78.
24. Besson JM, Chaouch A. Peripheral and spinal mechanisms of nocipception. Physiol Rev 1987; 67: 67-186.
25. Feria M. Neuroquímica funcional del dolor. En Aliaga L, Baños JE, Barutell C, Molet J, Rodríguez de la Serna A. Tratamiento del dolor teoría y práctica. Ed. MCR, 1995: 27-34.
26. Melzack R. Loeser JD. Phantom body pain in paraplegics: evidence for a central “pattern generating mechanism” for pain. Pain 1978; 4: 195-210.
27. Melzack R, Wall PD. On the nature of cutaneous sensory mechanisms. Brain 1962; 85: 331-356.
28. Melzack R, Stotler WA, Livingston WK. Effects of discrete brainstem lesions in cats on perception of noxious stimulation. J Neurophysiol 1958; 21: 353-367.
29. Melzack R, Israel R. Lacroix R, Schuhz G. Phantom limbs in people with congenital limb deficiency or amputation in early childhood. Brain 1997; 120: 1603-1620.
30. Melzack R. Pain and stress: clues toward understanding chronic pain. In: Sabounn M, Craik F, Robert M. editors. Advances in psychological science, Vol. 2. Biological and Cognitive Aspects, Hove: Psychology Press, 1998: 63-85.
31. Melzack R. Pain and stress: a new perspective. In: Gatchel RJ. Turk DC, editors. Psychosocial factors in pain, New York: Guilford Press. 1999: 89-106.
32. Melzack R. Phantom limbs, the self and the brain. (The D.O. Hebb Memorial Lecture). Can Psychol 1989; 30: 1-16.
33. Zatzick DF, Dimsdale JE. Cultural variations in response to painful stimuli. Psychosom Med. 1990 Sep-Oct; 52(5): 544-57.
34. Clancy J, et al. Neurophysiology of Pain. Br J Theatre Nurs 1998; 7: 19, 22-7.
35. Hoffert MJ. The Neurophysiology of Pain. Neurol Clin 1989, 7: 1983-203.
36. Chen AC, Feng W, Zhao H, Yin Y, Wang P. EEG default mode network in the human brain: spectral regional field powers. Neuroimage. 2008 Jun; 41(2): 561-74.
37. Chen AC. Pain perception and its genesis in the human brain. Sheng Li Xue Bao. 2008 Oct 25; 60(5): 677-85
38. Helmstetter FJ, Landeira-Fernandez J. Conditional hypoalgesia is attenuated by naltrexone applied to the periaqueductal gray. Brain Res. 1990 Dec 24; 537(1-2): 88-92.
39. Duncan GH, Bushnell MC, Bates R, Dubner R. Task-related responses of monkey medullary dorsal horn neurons. J Neurophysiol. 1987 Jan; 57(1): 289-310.
40. Benedetti F. The opposite effects of the opiate antagonist naloxone and the cholecystokinin antagonist proglumide on placebo analgesia. Pain. 1996 Mar; 64(3): 535-43.
41. Levine JD, Gordon NC, Fields HL. The mechanism of placebo analgesia Lancet. 1978 Sep 23; 2(8091): 654-7.
42. Fricton JR. Masticatory myofascial pain: an explanatory model integrating clinical, epidemiological and basic science research. Bull group int rech sci stomatol odontol 1999; 41(1): 14-25.
43. Fricton J. Myogenous temporomandibular disorders: diagnostic and management considerations. Dent Clin North Am. 2007 Jan; 51(1): 61-83, vi. Review.
44. Fernández de las Peñas y cols. The local and referred pain from myofascial trigger points in the temporalis muscle contributes to pain profile in chronic tension-type headache. Clin J Pain. 2007 Nov-Dec; 23(9): 786-92.



