Introducción
El vertiginoso desarrollo del mercado mundial de los implantes dentales lleva aparejado nuevos desafíos para los fabricantes. La superficie de los implantes constituye uno de esos desafíos, al ser el lugar donde se realizan los intercambios químicos y biológicos con el medio interno. La superficie tiene pues una importancia máxima en el éxito clínico del implante, ya que es la parte del implante que los tejidos “ven” directamente.
Por ello, una de las grandes líneas actuales de investigación se dirige a conseguir una superficie que minimice el riesgo cuando se usan protocolos de carga inmediata o temprana, y que facilite el éxito cuando se trabaja en indicaciones comprometidas, como en zonas con poco volumen o escasa densidad de hueso.
La intensa competencia, propia de este mercado, mueve a la investigación y desarrollo en el intento de mejorar la competitividad del implante. Así, en los últimos años, todos los fabricantes líderes han lanzado nuevas superficies modificadas en sus implantes. Es éste un contexto favorable también para los consumidores, y para los pacientes, que serán los últimos beneficiados. Pero, para poder seleccionar, y también exigir, los clínicos debemos conocer información adicional que tiene que ver con la física, química y las tecnologías asociadas. El objetivo de este trabajo es presentar, de modo tutorial, una revisión bibliográfica de las nuevas superficies implantarias.
Reacciones moleculares en cascada
Desde los primeros años ochenta, Bengt Kasemo, un biofísico de la Universidad Tecnológica Chalmers de Göteborg miembro desde el principio del equipo del profesor Branemark, dibujó las líneas maestras de lo que supone la interacción entre la superficie de un implante y el medio interno1,2. Trataremos de resumir muy brevemente estos complejos procesos:
Las superficies están repletas de enlaces químicos insaturados que, al oxidarse, forman capas reactivas. Al contactar con el entorno biológico, se producen reacciones en cadena que van modificando más y más esta superficie, empezando por la interacción con el agua en los primeros nanosegundos. Las moléculas de agua se orientan de modo anisotrópico según las propiedades atómicas de la superficie. Esta capa acuosa se estructurará de modo diferente según su capacidad hidrofílica-hidrofóbica. La superficie hidrofílica atrae el agua con gran fuerza, tanta que, cuando supera a las fuerzas de cohesión internas de la molécula de H2O, llega a provocar su disociación en forma hidroxilada. Sin embargo, la superficie hidrófoba, menos reactiva, atrae el agua de manera mucho más débil, por lo que no resulta “mojante”. Así los conceptos “hidrófilo/hidrófobo” tienen una definición a escala molecular, dependiendo de la fuerza de unión del agua a la superficie, y se reflejan en un diferente ángulo de contacto para las gotas de agua.
Tras el agua, se produce casi simultáneamente, la entrada de iones hidratados en la interfase. Son especialmente importantes los iones de Ca, que son atraídos por las cargas electroquímicas negativas del oxígeno de la superficie ya hidratada. A este proceso le sigue la adsorción de las proteínas, empezando por las pequeñas y siguiendo las más grandes. De la forma en que esta superficie ya hidratada se vea recubierta de las macromoléculas del medio biológico, va a depender su biocompatibilidad. En efecto, las proteínas pueden adherirse con mayor o menor intensidad y ser más o menos seleccionadas por esta superficie; algunas son facilitadoras de la mineralización y otras inhibidoras. Estas proteínas pueden orientarse según grupos funcionales, pueden mantener o no su estructura 3D, y pueden incluso desnaturalizarse. Por fin llega el contacto con las células. Las células interaccionan con la superficie ya cubierta de proteínas a través de los receptores y de los sistemas de adhesión de las membranas celulares. Dependiendo de qué escenario químico y proteico encuentren las células, así será su respuesta2.
El efecto de la microtopografía
A lo que acabamos de esbozar hay que sumarle otras variantes, como son las irregularidades superficiales, las características químicas o las propiedades micromecánicas y viscoelásticas. La más estudiada hasta ahora es la morfología, o topografía, de la superficie.
Desde que comenzó la etapa científica de la implantología, la superficie más utilizada en el implante de titanio ha sido la mecanizada, producida por el recortado del torno. Es la que ha dado las espectaculares tasas de éxito iniciales y la más ampliamente documentada de todas. Para una revisión véanse los metánalisis de Roos et al 3 y Eckert et al 4. Sin embargo, pronto se detectaron algunas limitaciones clínicas de los implantes de superficie mecanizada. En 1991, Friberg et al 5 y Jaffin y Berman6, reportaron excesivas pérdidas de implantes en el hueso de densidad D4, el llamado “de mala calidad”. Por su parte, las demandas de los profesionales y del público fueron creciendo a la par: se quería acortar los tiempos de espera, utilizar cirugías avanzadas en condiciones comprometidas y extender así las indicaciones de los implantes a virtualmente todas las situaciones clínicas.
Durante los años noventa, la investigación fue acumulando cada vez más evidencias de que las superficies rugosas, comparadas con las mecanizadas, favorecían una regeneración ósea más temprana, provocando una mayor densidad ósea periimplante, lo cual quedaba demostrado tanto en las mediciones histomorfométricas como en los test mecánicos7-11. Y la conclusión simplista fue que la superficie rugosa era mejor que la lisa. Pero, si hablamos con propiedad, ni la superficie mecanizada era del todo “lisa”, ni sabemos bien qué queremos decir cuando decimos “rugoso”.
 |
¿Qué significa “liso” y “rugoso”? Caracterizar una superficie es difícil. No es suficiente interpretar más o menos subjetivamente, unas microfotografías SEM (microscopio electrónico de barrido). En realidad, hay hasta 150 parámetros descriptivos y hoy en día se echa en falta una estandarización12, que impida que comparemos sin darnos cuenta “peras con manzanas”. El artículo “Suggested Guidelines for the Topographic Evaluation of Implant Surfaces” es a mí entender fundamental para crear acuerdos básicos que permitan a los investigadores comparar las superficies al mismo nivel y poder llegar a así a conclusiones válidas12.
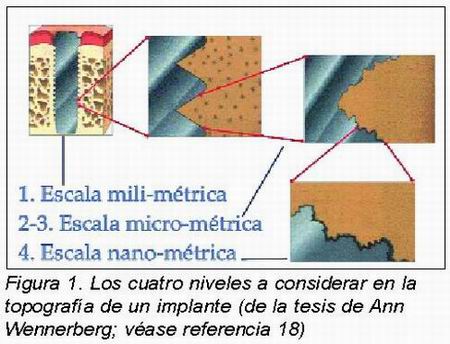
Si nos fuéramos acercando progresivamente a una superficie, podríamos distinguir cuatro niveles: 1) Forma, a escala milimétrica; 2) Ondulaciones, o “wavines”, a escala de décimas de milímetro; 3) Rugosidad, a escala de micras, o milésimas de milímetro y 4) Irregularidades nanométricas (Figura 1). Vamos a intentar resumir qué conocimientos científicos tenemos de cada nivel:
1. En cuanto a la primera escala, la macro-forma, los estudios comparativos longitudinales a largo plazo nos demuestran resultados superiores en los diseños roscados frente a los tornillos impactados13. Esto ha quedado claro al menos para superficies de rugosidades medias y puede deberse al anclaje mecánico que producen las espiras, especialmente en la zona cortical, que impide la pérdida ósea progresiva y a la vez es un factor de estabilización primaria del implante.
2. En la segunda escala, Thomas Albrektsson, en su tesis14, cuantificó en 100-150 m. el espacio que requiere el llamado “bone in-growth”, o crecimiento del hueso hacia dentro de las rugosidades. Esta interpenetración de las osteonas en la superficie del implante, se usa en muchas prótesis de cadera y en las superficies de poro de titanio, a base de microesferas de Ti sinterizadas, bien documentadas en la Universidad de Toronto por el grupo de Pilliar y Deporter15,16.
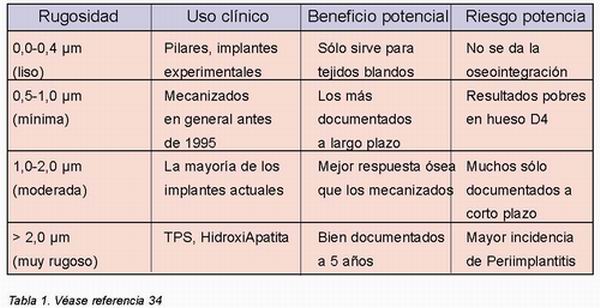
3. En la tercera escala, se ha demostrado que hay depósitos de materia fundamental en las irregularidades o pits de hasta 1 m., lo que sirve de fundamento para la interdigitación microscópica entre el hueso y la superficie implantaria. Stig Hansson17 ha elaborado una singular aproximación matemática a la rugosidad ideal, que tendría una alta concentración de pits hemiesféricos de 1 metro, descripción que coincide con la superficie TiOblastTM. En su tesis, Ann Wennerberg18, demostraba la superioridad experimental de la rugosidad media (Sa entre 1 y 2 m.) sobre las superficies más lisas o más rugosas. Estas últimas, además, favorecen la periimplantitis19 (Tabla 1).
 |
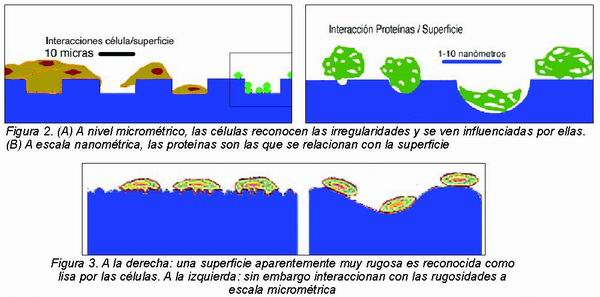
4. Por último, respecto al cuarto nivel o escala nanométrica (la milésima de micra), se presupone que es de gran importancia para la oseointegración, como el grosor de la capa de óxido y su cristalinidad 20, así como la presencia de porosidad a nivel nanométrico (Figura 2). Pero como aún no se dispone de suficientes datos, la descripción relevante de una superficie debe centrarse en la tercera escala, o micrométrica 12.
La acción de la rugosidad resulta de un doble mecanismo. Por una parte produce un acoplamiento mecánico con el hueso y por otra tiene un efecto biológico, ejerciendo una influencia directa e indirecta sobre las células y su metabolismo. Numerosos estudios con cultivos celulares han demostrado la influencia de la rugosidad del material en la función y metabolismo celulares. Los pre-osteoblastos muestran una especie de “rugofilia”, reconociendo la microtopografía para adherirse y orientándose en ella para migrar21 (Figura 3). De las señales, entre otras, que reciben de la superficie, depende su expresión génica, o diferenciación, y la fabricación y depósito de matriz que se mineralizará 22.
 |
John Davies ha descrito el proceso de curación periimplantaria de una manera muy convincente, designando como “osteogénesis de contacto” a la formación de novo de hueso, directamente sobre las superficies rugosas23-25. Esta rugosidad mantendría la aposición íntima del coágulo sobre la superficie implantaria, contrarrestando la retracción de la red de fibrina, y favoreciendo así la colonización celular del implante desde el principio. Por el contrario, en las superficies poco rugosas, menos retentivas, las redes proteicas se separarían y la osteogénesis se daría “a distancia”, o sea, hacia el implante, a partir de los frentes osteoblásticos provenientes de la pared del neoalvéolo25.
En realidad, como aún no podemos hablar de capacidad directa de generar ni inducir hueso, lo que todas las nuevas superficies hacen es acelerar la osteoconducción, estimulando la llegada de brotes capilares y células perivasculares osteoprogenitoras a la superficie del implante. Ahora bien, ¿Por qué unas superficies son más osteoconductoras que otras?
Biocompatible no es sinónimo de bioactivo
Clásicamente, según la definición de Osborn entre otros, el titanio ha sido considerado un material osteo-tolerado, pero no bioactivo26. La bioactividad se define como la capacidad de un material de unirse a los tejidos vivos y, refiriéndonos al hueso, sería la capacidad para formar en su superficie apatitas similares a las de la sustancia fundamental del tejido óseo. Los materiales bioactivos son capaces in vitro de precipitar en su superficie el fosfato cálcico, al ser sumergidos en un suero similar al fisiológico (Figura 4).
 |
Esta capacidad de precipitación del fosfato cálcico y de nucleación de sus cristales in vitro, es una forma de objetivar la bioactividad de un material27,30. Hace ya 27 años, Larry Hench describió la unión química con el hueso en biocristales silícicos como una unión íntima y directa entre hueso y biomaterial, creando una firme interfase28. Desde entonces surgió un nuevo concepto, el de “biointegración”, para referirse a la unión química. Ya en 1977, el grupo de Jarcho demostró unión directa con el hueso en los recubrimientos de hidroxiapatita29. Si bien estos recubrimientos han mostrado una oseointegración precoz, mayor tolerancia al micromovimiento y mayor capacidad de puentear el gap hueso/implante, han fallado en el largo plazo, al romperse la interfase entre implante y recubrimiento, al producirse la disolución del mismo y/o facilitar el desarrollo de una intensa y progresiva periimplantitis.
Hoy en día se trabaja intensamente, y con resultados prometedores, en el intento de dotar al titanio de esa capacidad de bioactividad30. Diversos métodos de oxidación incrementada están siendo ensayados: procesos térmicos, implantación de iones31, oxidación electroquímica32, tratamientos con ácidos o álcalis o métodos combinados33. Se ha demostrado que el titanio así tratado es capaz in vitro de nuclear la cristalización del fosfato cálcico sobre su superficie, formando una capa de precipitación de apatita, cuyo grosor va aumentando con el tiempo.
Así que son las propiedades químicas de las superficies implantarias el punto de mira de la investigación actual. Conseguir unión química significa disponer de los enlaces químicos entre el tejido y el implante mucho antes de que se haya desarrollado la unión biomecánica. La consecuencia clínica es evidente: una oseointegración más rápida y más fuerte que permite aplicar carga inmediata con menores riesgos, acortar los tiempos de espera y extender el uso de los implantes a situaciones más comprometidas, manteniendo la tasa de éxito en las cifras de las indicaciones clásicas. Existen cuatro características que nos permitirían hablar de unión química: 1) cuando no se observa separación entre implante y tejido; 2) cuando en los tests mecánicos se producen fracturas cohesivas en el espesor del hueso y no en la interfase; 3) cuando hay evidencia de formación de capas de apatita en la superficie implantaria, o bien 4) cuando los tests mecánicos muestran fuerzas de unión muy superiores a las de los controles, que no pueden explicarse por otros motivos conocidos34.
Ahora bien, ¿son bioactivas las superficies recientemente aparecidas en el mercado? Todas parecen superar los resultados de los controles en contacto hueso/implante y retención ósea. Pero, han dado sus prestaciones el salto cualitativo necesario para que ya puedan considerarse capaces de unión química?
Las “nuevas superficies”: OsseoSpeed®
A esta pregunta no podemos aún responder de forma tajante. Las nuevas superficies aseguran todas tener osteofilia y ser capaces de atraer más al hueso. Pero, desde un punto de vista científico, es difícil diferenciar entre una moderada “osteofilia” propia, como hemos visto, de las microrrugosidades medias, y la “particular” osteofilia que proclaman los fabricantes de estas nuevas superficies. Esta dificultad estriba en que la mayoría de las investigaciones se han centrado en el parámetro de la rugosidad, sin atender al conjunto de las propiedades físico-químicas de cada superficie y, aunque dos superficies tengan la misma rugosidad, eso no significa que vayan a producir la misma respuesta biológica.
Nos centraremos ahora en una superficie prometedora, probablemente la primera de una serie de superficies de titanio bioactivo que serán el futuro inmediato del tema que nos ocupa: OsseoSpeed®. Según el profesor Albrektsson, entre las superficies que se comercializan en estos momentos en el mundo de los implantes, sólo hay dos que puedan considerarse potencialmente bioactivas: los recubrimientos de hidroxiapatita y la superficie de titanio fluorizado de Astra Tech, denominada OsseoSpeed®34. Como él mismo señala, un estudio experimental llevado a cabo por el grupo de investigación del Handicap Research en la Universidad de Göteborg35, no consiguió una prueba concluyente de bioactividad en una superficie similar a TiUnite‰, la superficie que Nobel Biocare introdujo en 2001 y que está dando buenos resultados clínicos aunque aún documentados sólo en el corto plazo.
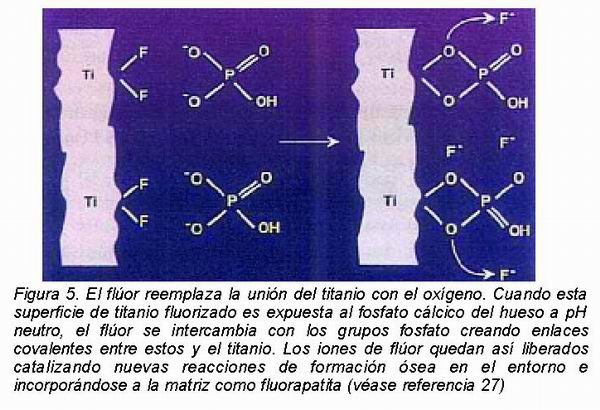 |
OsseoSpeed®, lanzada en 2004, es una modificación química de TiOblast®, la superficie de los implantes Astra Tech. TiOblast® es una superficie de sustracción, que se obtiene por chorreado con micropartículas de dióxido de Ti de un tamaño medio de hasta 50 metros. Tiene una textura uniforme, o isotrópica, y moderadamente rugosa, con un valor Sa de 1-1,5 metros, y está bien documentada en estudios clínicos longitudinales a 10 años36. La superficie OsseoSpeed® fue introducida, hace más de 10 años, por Jan Ellingsen y es capaz de absorber, en el Test de nucleación in vitro, más iones de Ca que los controles, apareciendo cubierta por precipitados de fosfato cálcico. Esta capacidad de nuclear la apatita ha sido también verificada por medición de radiactividad de isótopos de fosfato y es unos de los fundamentos de su potencial bioactividad 37. OsseoSpeed®ha demostrado en los estudios experimentales una fuerza de unión al hueso que no es explicable sólo por una interpenetración mecánica37-40. Su probable modo de acción es el intercambio del flúor con los grupos fosfato del hueso para formar, por un lado fluorapatita y por otro, uniones covalentes entre la superficie del implante y el fosfato cálcico del hueso27 (Figura 5). Actualmente, el fabricante mantiene en seguimiento un estudio multicéntrico que empezó 1 año antes del lanzamiento de OsseoSpeed®, el proyecto FOCUS, en el que participan 109 clínicas en 13 países, con un seguimiento de 1.501 implantes en 624 pacientes. Se trata de un estudio abierto, en el que los clínicos participantes no se someten a un protocolo de utilización estricto de los nuevos implantes, sino que los usan según su libre criterio. La tasa de éxito acumulativa del 98,9 %, manifiesta el comportamiento altamente favorable de esta superficie en una gran variedad de rutinas de tratamiento y manos clínicas diferentes.
Conclusiones
Todavía no han sido totalmente dilucidados los mecanismos íntimos de respuesta ósea a los implantes. Sólo sobre el conocimiento de estos procesos, podrán ser superados los métodos empíricos de ensayo/error. Actualmente los fabricantes están haciendo un gran esfuerzo, empezando a aplicar la bioingeniería para diseñar la superficie implantaria, en el intento de llegar a controlar la estructura y química superficiales, las uniones iónicas, la adsorción proteica, y la adhesión, proliferación y diferenciación celulares sobre la superficie. Es bien sabido que no se puede modificar un parámetro como la rugosidad sin que se afecten consecutivamente otras características. Estamos pues en un campo científico complejo en el que se debe valorar, no sólo la morfología, sino el conjunto de las propiedades físico-químico-mecánicas que singularizan una superficie.
A la vez, toda esta investigación está sometida a una fuerte presión del mercado, con lo que la pretendidas prestaciones de las superficies comerciales no suelen estar suficientemente arropada por estudios previos41. La mayoría de las nuevas superficies están basadas en trabajos experimentales, pero han sido lanzadas al mercado sin estudios clínicos previos. Es necesario demostrar la capacidad real de bioactividad y además, documentar su uso clínico a medio y largo plazo. Sería importante también contar con estudios comparativos entre diversas superficies en condiciones bien controladas. En un próximo trabajo intentaremos precisar, de un modo comparativo y a la luz de la evidencia científica disponible, los logros y las carencias de “las nuevas superficies”.