Dr. A. Echeverría / Dr. J. Ferrús / Dr. S. Morante / Dr. D. Rodrigo / Dr. F. Vignoletti / Dr. M. Sanz. Máster de Periodoncia Facultad de Odontología UCM
Madrid.
El objetivo fundamental del tratamiento periodontal es el control de la infección que conduce al restablecimiento de la salud. Sin embargo, el tratamiento de las consecuencias de la enfermedad, incluyendo la reconstrucción de los tejidos, son también objetivos de la terapia periodontal.
Al tratar la enfermedad periodontal se producen dos tipos básicos de cicatrización, siendo el más común la reparación a través de un epitelio largo de unión y una pequeña inserción conectiva apical. Este tipo de cicatrización es el que se produce tras los tratamientos periodontales convencionales tanto quirúrgicos como no quirúrgicos 1,2. La segunda posibilidad reparativa consiste en el restablecimiento funcional del ligamento periodontal, hueso y cemento destruidos tras el proceso patológico, lo que significa regenerar los tejidos periodontales. Sin embargo, a pesar de existir varios procedimientos dirigidos a dicho fin, no siempre el relleno óseo que se observa radiológicamente tras la realización de procesos regenerativos constituye una verdadera regeneración3. Actualmente, la única forma de saber si se ha producido regeneración periodontal es el examen histológico a través de una biopsia. Generalmente, este tipo de abordaje no es posible fuera del contexto científico y por tanto el dentista no tiene más remedio que confiar en los resultados contrastados por la literatura cuando analice sus propios resultados a través del sondaje y la radiografía.
Repaso histórico
A lo largo de los años han sido numerosos los intentos que pretendían conseguir la regeneración de los tejidos periodontales, incluyendo el uso de injertos óseos, ya fueran éstos de origen animal, humano o sintético. Sin embargo, existe poca evidencia histológica que valide de manera predecible el uso clínico de tales materiales4. A principios de los años ochenta, Nyman y colaboradores publicaron uno de los primeros estudios histológicos realizado en humanos en el que se observó regeneración periodontal, en este caso utilizando una técnica de barrera que favorecía la regeneración a partir de la diferenciación de las células ectomesenquimales del ligamento periodontal1. Esta técnica de regeneración periodontal “guiada” ha supuesto durante estos años el “gold estandar” del tratamiento regenerador. Sin embargo, el análisis detallado de todos estos estudios muestra gran variabilidad en cuanto al grado de predictabilidad clínica, eficacia y resultados histológicos5.
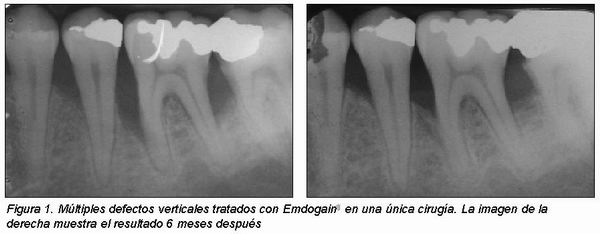 |
Hoy en día se están estudiando nuevos recursos para conseguir regeneración basándose en las propiedades que los factores de crecimiento y las proteínas morfogenéticas tienen sobre los tejidos. A pesar del gran potencial de dichas técnicas, se trata de una línea de investigación aún en desarrollo y con escasas aplicaciones en la clínica actual6.
Finalmente, existe una última alternativa cuando se trata de tratamientos regenerativos basada en la biomimética, es decir, en la regeneración tisular que se puede observar cuando se intentan copiar los acontecimientos que suceden durante el desarrollo de los tejidos en estadios embrionarios. Estas técnicas se han aplicado en periodoncia tras el descubrimiento de una proteína sintetizada durante el proceso de formación del diente y que se conoce como amelogenina. La amelogenina es expresada por el órgano del esmalte derivado de la vaina epitelial de Hertwig que al entrar en contacto con las células mesenquimales del folículo dental estimula la formación de cemento7.
Fundamentos biológicos
EMD constituye la matriz del esmalte procedente de embriones porcinos que incluye amelogenina en un 90 por ciento y otras proteínas no amelogénicas que componen el 10 por ciento restante. La matriz del esmalte que constituye la base del EMD va cargada en un vial de alginato propilenoglicol (PGA) que posee una consistencia variable en función del pH y la temperatura y que permite al producto activo ejercer su acción una vez introducido en el defecto periodontal8.
Comercialmente, EMD es una sustancia disuelta en un pH ácido, de manera que el PGA que lo contiene se encuentra en estado soluble y es de fácil manejo. Cuando se introduce en el defecto óseo, el PGA forma agregados insolubles debido al incremento del pH, lo que permite la formación de una matriz sobre la dentina previamente grabada que es más retentiva y capaz de ejercer su acción9. Bajo estas nuevas condiciones y durante los estadios iniciales de cicatrización, las amelogeninas presentes en la matriz del esmalte del EMD actúan de forma selectiva en el crecimiento y colonización de estirpes celulares sobre las superficies radiculares expuestas. De esta forma se reduce la colonización de las mismas por fibroblastos gingivales mientras que se estimula la colonización por fibroblastos procedentes del ligamento periodontal. Además, se ha comprobado que EMD es capaz de inhibir el crecimiento epitelial, lo cual da más tiempo al desarrollo de los acontecimientos que promueven la regeneración periodontal7,8. Además de la capacidad regenerativa de EMG a través del proceso expuesto, su utilización tiene efectos a varios niveles. Uno de especial interés es la comprobación tanto in vivo como in vitro de su influencian cuantitativa y cualitativa sobre la flora bacteriana. Inmediatamente tras su aplicación y debido al bajo pH y sus propiedades hidrofóbicas, se ha observado una reducción en los niveles bacterianos que podrían influir positivamente sobre el proceso regenerativo10.
A modo de resumen, el uso de EMD durante la cirugía periodontal de acceso a la raíz, puede activar los procesos de cicatrización al suponer el sustrato necesario para que las proteínas derivadas de la matriz del esmalte ejerzan su acción. El resultado es la obtención de un ligamento periodontal con fibras colágenas perpendicularmente adheridas a un nuevo cemento acelular en la porción más apical y a cemento celular en la porción coronal. Esta orientación perpendicular de las fibras sobre cemento acelular es una de las principales diferencias que se observan al comparar la regeneración mediante EMD con la obtenida tras técnicas de regeneración tisular guiada (RTG)11. En este último caso, se ha observado que se forma únicamente un cemento de tipo celular que contiene fibras intrínsecas y está asociado a procesos de reabsorción y reparación. Sin embargo, el cemento celular obtenido con EMD es el que confiere inserción al permitir el anclaje de las fibras de Sharpey que unen el hueso al cemento.
 |
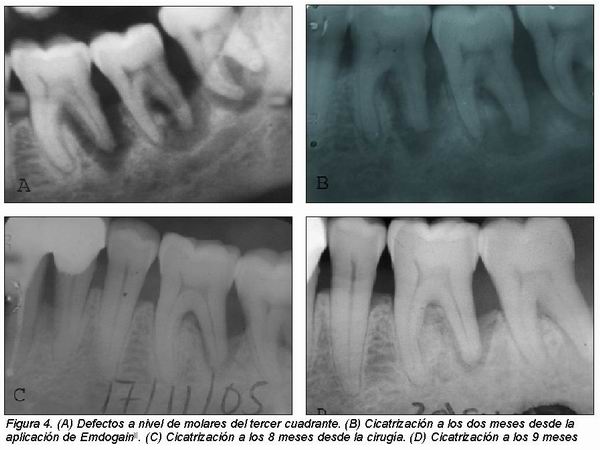
Otra diferencia significativa entre el tratamiento con EMD y RTG es que en el último caso se utilizan membranas, lo cual supone un riesgo añadido por la posibilidad de exposición de la misma, contaminación y por consiguiente una menor regeneración (Figura 3)12. Además, el fácil manejo de EMD lo hace especialmente útil en caso de múltiples defectos en un área determinada pues sería suficiente con una única cirugía (Figura 1).
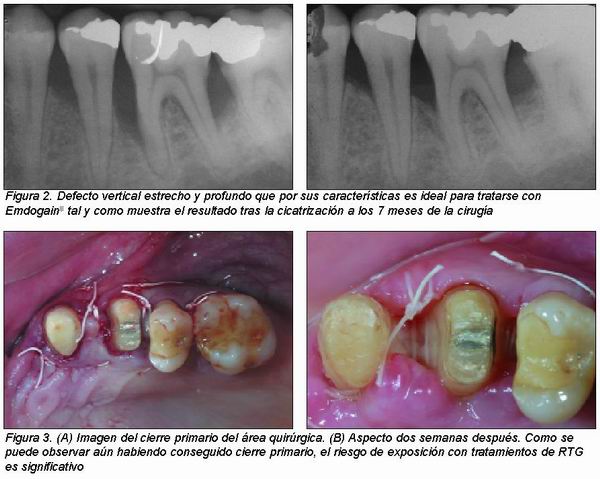
Finalmente, EMD posee la capacidad de actuar sobre células inmaduras y diferenciarlas en cementoblastos y osteoblastos concediéndole una acción osteoinductora que no poseen los procedimientos a base de membrana (RTG). Además, se trata de una sustancia capaz de estimular la producción de algunos factores de crecimiento tales como factores de crecimiento derivados de las plaquetas (PDGF) o factor de crecimiento transformador beta (TGF-ß) así como de inhibir la producción de metaloproteinasas. Todas estas acciones, junto con su efecto estimulante sobre las células del ligamento periodontal e inhibitorio sobre las del epitelio, hacen del EMD un producto extremadamente útil en procesos regenerativos (Figura 2)9,13.
 |
Efectos del tratamiento con Emdogain®
El primer estudio que se realizó con EMD en humanos fue publicado en 1997 por Heijl. Para este estudio se seleccionó un único diente al que se le realizó artificialmente un defecto vertical. Tras la aplicación de EMD y pasados 4 meses se observó que el nuevo cemento cubría el 73 por ciento del defecto y que estaba unido a la superficie radicular. Además, también se observó un relleno óseo del 65 por ciento unido al cemento a través de fibras colágenas14. Este estudio, a pesar de estar basado en un único caso, abrió las puertas al uso clínico de EMD y a la aparición de nuevos estudios con mayor muestra, mejor controlados y por tanto mayor evidencia científica.
Inicialmente, estos estudios iban dirigidos a comparar el tratamiento con EMD versus únicamente una cirugía de acceso al defecto. Los resultados mostraron mejores resultados en cuanto a disminución de la profundidad de sondaje (PS) y aumento del nivel de inserción (NI) para los defectos tratados con EMD. Según la revisión Cochrane realizada a este respecto, las diferencias medias entre ambos tratamientos son de 0,96 mm para la PS y de 1,31 mm para el NI. Sin embargo, no existen diferencias con respecto a la retracción gingival ni con respecto a la presencia de infecciones tras el tratamiento entre ambas técnicas15.
Una vez contrastada la eficacia de EMD con respecto a no realizar ningún tratamiento adicional durante la cirugía de acceso, era necesario comparar la eficacia de EMD respecto a la RTG. En este sentido, el análisis sistemático de los resultados muestra una ausencia de diferencias con respecto al NI y la presencia de infecciones postoperatorias. Sin embargo, existen diferencias estadísticamente significativas cuando se compara la reducción en la PS, que es 0,58 mm. de media mayor en RTG, así como en relación a la retracción gingival, superior en el tratamiento con RTG (0,47 mm de media)15.
Variables que influyen en el éxito del tratamiento con Emdogain®
Existen múltiples variables que afectan a los resultados obtenidos durante procedimientos regenerativos aunque la mayoría de ellas se refieren a los procedimientos regenerativos con membrana (RTG) 15-18. De acuerdo con los diferentes estudios publicados al respecto28, el nivel de inserción alcanzado tras el tratamiento regenerativo depende de diferentes variables entre las que destacan las siguientes:
1. Anchura del componente infraóseo: Mejor cuanto más estrecho (< 45°) puesto que favorece la estabilidad del coágulo que se forma en las fases iniciales de la cicatrización favoreciendo el proceso regenerativo (Figura 2).
2. Profundidad del componente infraóseo: Se conseguirá mayor ganancia cuanto mayor sea la profundidad, que debe ser como mínimo de 4 mm (Figura 2).
3. Número de paredes: Mayor cuantas más paredes. Se ha demostrado que en defectos de tres paredes sobre todo, pero también de dos, el nivel de regeneración es mayor debido a que cada una de las paredes supone una fuente vascular capaz de aportar las sustancias necesarias para que se lleve a cabo el proceso de regeneración.
4. Profundidad de sondaje inicial: Mayor cuanto mayor sea la PS inicial.
5. Sangrado al sondaje: Mejores resultados si no sangra antes de la cirugía, lo que puede indicar la ausencia de inflamación.
6. Cobertura total del área interproximal: El uso de técnicas de preservación de papila, así como un correcto diseño del colgajo, aseguran el cierre por primera intención y por tanto mejoran la predictabilidad.
7. Hábito tabáquico: Está comprobado que en los pacientes fumadores el aumento del NI y la cantidad de relleno óseo tras realizar tratamientos con Emdogain® es menor que en pacientes no fumadores. Así, un estudio muestra que mientras que los pacientes no fumadores consiguen ganancias de inserción medias de 4,4 mm y relleno del defecto de 3,3 mm, los pacientes fumadores aumentan su inserción clínica 3,8 mm y ganan 2,6 mm de relleno óseo19.
8. Administración de antibióticos sistémicos: Los únicos estudios que han valorado el uso de antibióticos con EMD, observan que su administración no mejora los resultados respecto a su no darlos20.
 |
Otras aplicaciones del uso de Emdogain®
Debido a sus propiedades biológicas, el uso de EMD se ha propuesto para otro tipo de tratamientos, como el cubrimiento de recesiones con el uso concomitante de injertos de conectivo21 o asociado a técnicas de reposición coronal22, tratamiento de furcas23, autotransplantes24, tratamiento endodóncico25 e implantología26,27. En todos los casos parece que el uso del EMD podría aportar resultados innovadores, aunque la escasa evidencia existente no permite todavía justificar su uso rutinario.
Conclusiones
En vista de lo observado desde que en 1997 se aplicara por primera vez matriz derivada del esmalte para el tratamiento de defectos infraóseos, el uso de EMD aporta resultados clínicamente significativos, con evidentes ventajas en ciertos casos respecto a la regeneración tisular guiada. Se observa mayor reducción en la profundidad de sondaje si se utiliza RTG y ausencia de diferencias significativas entre ambos procedimientos con respecto al NI. Sin embargo, Emdogain® supone un tratamiento más predecible debido a su menor dificultad técnica, menos posibilidad de complicaciones y reducida morbilidad, todo lo cual es clínicamente relevante. Además, EMD tiene la ventaja de permitir tratar varias localizaciones con una única cirugía y en menos tiempo debido a su fácil manipulación.
La acción estimulante que EMD tiene sobre cemento, hueso, epitelio, ligamento periodontal y factores de crecimiento así como su capacidad inhibitoria sobre las metaloproteinasas y bacterias, convierten a las proteínas derivadas del esmalte en un recurso que requiere mayor investigación para comprobar su aplicabilidad en otros campos de la odontología.
Caso clínico
Paciente varón de 62 años, no fumador y que no refiere enfermedad sistémica alguna. Acudió por primera vez a la consulta en diciembre del 2004 solicitando tratamiento restaurador con implantes. Previo a cualquier tratamiento se le realizaron radiografías periapicales y se valoró la profundidad de sondaje, el índice de placa, el índice gingival, el grado de afectación furcal y la movilidad de todos los dientes. Los índices de placa y de sangrado eran elevados y generalizados superando en ambos casos el 80 por ciento.
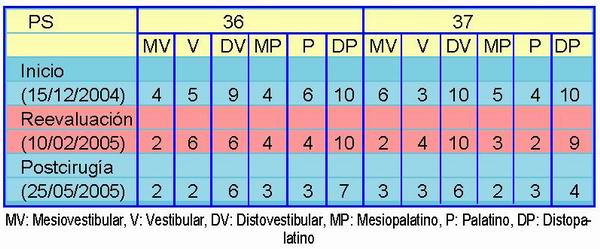
A nivel del tercer cuadrante se observaron defectos verticales que afectaban a los tres molares y que llegaban incluso a rodear las raíces distales de 36 y 37 así como la mesial del 38. Estos defectos abarcaban también el espacio furcal creando lesiones de grado 3 en los tres molares y movilidades tipo 1 también en las tres piezas.
Se decidió extraer el 38 y realizar tratamiento a nivel de 36 y 37 puesto que presentaban vitalidad y poca movilidad. En la Tabla 1 se pueden observar los sondajes a lo largo del tratamiento. Debido a la magnitud de los mismos no fue suficiente con el tratamiento periodontal básico debiendo recurrir a la cirugía con dos objetivos fundamentales. El primero era conseguir un mejor acceso a las raíces para eliminar de forma completa y segura los restos de placa que hubiesen quedado tras el raspado. En segundo lugar se trató de regenerar en lo posible la inserción perdida a base de aplicar Emdogain® en todos los defectos óseos verticales presentes.
Previamente a la cirugía, se remitió al paciente al endodoncista para que valorase la necesidad de tratamiento pulpar. Sin embargo, debido a que ambos dientes mostraron vitalidad, el especialista recomendó no llevar a cabo ningún tratamiento y por tanto se procedió directamente con el tratamiento quirúrgico.
Se realizaron incisiones intrasulculares tanto por vestibular como por palatino en un intento por preservar al máximo los tejidos blandos y conseguir posteriormente cierre primario. Es importante en este tipo de tratamiento eliminar por completo el tejido de granulación al realizar el raspado de la zona puesto que se debe tener acceso directo a las raíces de los dientes a regenerar. Una vez realizada la fase higiénica, se procedió al grabado de la superficie con ácido vigilando no contaminar la zona con sangre o saliva. Posteriormente se aplicó el producto y se suturó buscando el cierre primario de ambos colgajos.
Se realizaron visitas de mantenimiento a las dos semanas para retirar los puntos, al mes y posteriormente a los dos meses, momento en el cual se realizaron nuevas radiografías de la zona (Figura 4). Como se puede observar en las mismas, el relleno de los defectos es evidente y la disminución en la profundidad de sondaje notoria. Teniendo en cuenta que según la literatura científica se pueden observan mejorías hasta tres años después de la aplicación de Emdogain® los resultados que muestran las radiografías a los tres meses son prometedores.
Recientemente el paciente ha sido remitido al endodoncista para que se le realice la endodoncia del 36. La razón por la que se ha insistido en este aspecto ha sido que durante la cirugía se pudo observar cómo la cureta bordeaba el ápice de la raíz distal, lo cual supone que el paquete vasculonervioso estaba seccionado y por tanto la ausenciavitalidad de dicha raíz. La raíz mesial no presentó el mismo problema y posiblemente fuese ésta la que diese positivo al test de vitalidad pulpar cuando se remitió al endodoncista inicialmente.
Bibliografía
1. Nyman S, Karring T, Lindhe J, y Rylander H. New attachment following surgical treatment of human periodontal disease. J Clin Periodontol 1982; 9: 290-296.
2. Waerhaug J. Healing of the dentoepithelial junction following subgingival plaque control. J Periodontol 1978; 49(1): 1-8.
3. Listgarten MA y Rosenberg MM. Histological study of repair following new attachment procedures in human periodontal lesions. J Periodontol 1979; 50: 333-344.
4. Nasr HF, Aichelmann-Reidy ME y Yukna R. Bone and bone substitutes. Periodontol 2000 1999; 19: 74-86.
5. Garret S. Periodontal regeneration around natural teeth. Ann Periodntol 1996; 1: 621-666.
6. Bartold PM, McCullogh CAG, Narayanan AS, Pitaru S. Tissue engineering: A new paradigm for periodontal regeneration based on molecular and cell biology. Periodontol 2000 2000; 24: 253-269.
7. Hammarström L. Enamel matrix, cementum development, and regeneration. J Clin Periodontol 1997; 24: 658-668.
8. Hammarström L. Periodontal regeneration in a buccal dehiscence model in monkeys after application of enamel matrix proteins. J Clin Periodontol 1997; 24: 658-668.
9. Gestrelius S, Lyngstadaas SP, Hammarström L. Emdogain-periodontal regeneration based on biomimicry. Clin Oral Invest 2000; 4: 120-125.
10. Sculean A, Auschill TM, Donos N, Brecx M, Arweiler NB. Effect of an enamel matrix protein derivative (Emdogain®) on ex vivo dental plaque vitality. J Clin Periodontol 2001; 28: 1074–1078.
11. Sculean A, Donos N, Miliaukaite A, Arweiler N, Brecx M. Treatment of intrabony defects with guided tissue regeneration and enamel-matrix proteins. J Clin Periodontol 2000; 27: 466-472.
12. Sanz M, Tonetti MS, Zabalegui I, Sicilia A, Blanco J, Rebelo H, Rasperini G, Merli M, Cortellini P, Suvan JE. Treatment of intrabony defects with enamel matrix proteins or barrier membranes: results from a multicenter practice-based clinical trial. J Periodontol. 2004 May; 75(5): 726-33.
13. Gestrelius S, Andersson C, Lidström D, Hammarström L, Somerman M. In vitro studies on periodontal ligament cells and enamel matrix derivative J Clin Periodontol 1997; 24: 685-692.
14. Heijl H, Heden G, Svardstrom G, Ostgren A. Enamel matrix derivate (EMDOGAIN®) in the treatment of infrabony periodontal defects. J Clin Periodontol 1997; 24: 705-714.
15. Esposito M, Coulthard P, Worthington HV. Derivado de la matriz del esmalte (Emdogain®) para la regeneración de tejido periodontal en defectos intraóseos (Revisión Cochrane traducida). En: La Biblioteca Cochrane Plus, 2005, núm 1.
16. Tonetti M, Pini.Prato G, Cortellini P. Periodontal regeneration of human intrabony defects. IV. Determinants of healing response. J Periodontol 1993;64(10): 934-940.
17. Cortellini P, Pini-Prato G, Tonetti M. Colgajo de conservación papilar simplificado. Nuevo enfoque para tratar tejidos blandos en procedimientos regeneradores. Revista internacional de Odontología Restauradora y Periodóncia 1999; 3 (6): 589-599
18. Cortellini P, Bowers GM. Periodontal regeneration of intrabony defects: an evidence-based treatment approach. Int J Periodontics Restorative Dent. 1995 Apr;15(2):128-45.
19. Heden G. A case report study of 72 consecutive Emdogain-treated intrabony periodontal defects: clinical and radiographic findings after 1 year. Int J Periodontics Restorative Dent. 2000 Apr; 20(2): 127-39.
20. Sculean A, Blaes A, Arweiler N, Reich E, Donos M, Brecx M. The effect of postsurgical antibiotics on the healing of intrabony defects following treatment with enamel matrix proteins.. J Periodontol 2001; 72: 190-5.
21. Carnio J, Camargo PM, Kenney EB, Shenk RK. Histological evaluation of 4 cases of root coverage following a connective tissue graft combined with an enamel matrix derivative preparation. J Periodontol. 2002 Dec; 73(12): 1534-43.
22. McGuire MK, Cochran DL. Evaluation of human recession defects treated with coronally advanced flaps and either enamel matrix derivate or connective tissue. Part 2: Histological evaluation. J Periodontol 2003; 74: 1126-1135.
23. Meyle J, Gonzales JR, Bodeker RH, Hoffmann T, Richter S, Heinz B, Arjomand M, Reich E. Sculean A, Jepsen K, Jepsen S. A randomized clinical trial comparing enamel matrix derivative and membrane treatment of buccal class II furcation involvement in mandibular molars. Part II: secondary outcomes. J Periodontol. 2004 Sep; 75(9): 1188-95.
24. Chappuis V., von Arx T. Replantation of 45 avulsed permanent teeth: a 1-year follow-up study. Dent Traumatol. 2005 Oct; 21(5): 289-96.
25. Filippi A, Pohl Y, von Arx T. Treatment of replacement resorption with Emdogain -preliminary results after 10 months. Dent Traumatol. 2001 Jun; 17(3): 134-8.
26. Franke Stenport V, Johansson CB. Enamel matrix derivative and titanium implants. J Clin Periodontol. 2003 Apr; 30(4): 359-63.
27. Casati MZ, Sallum EA, Nociti FH Jr, Caffesse RG, Sallum AW. Enamel matrix derivative and bone healing after guided bone regeneration in dehiscence-type defects around implants. A histomorphometric study in dogs. J Periodontol. 2002 Jul; 73(7): 789-96.
28. Rodrigo D. Evidencias científicas del uso clínico de las proteínas derivadas de la matriz del esmalte (Emdogain). Periodoncia y osteointegración 2004; 14(3): 185-206.




