Se resume en este estudio nuestra experiencia preliminar al utilizar un copolímero poliláctico/poliglicólico de nueva creación como relleno óseo. Este material sintético, disponible en distintas formas (esponjas, polvo y gel), se ha comprobado que resulta muy fácil de utilizar en 30 casos tanto periodontales como después de extracciones, porque se adapta perfectamente a las distintas condiciones que necesitan empastes o rellenos para formar material óseo nuevo.
Stancari F. * Zanni B. * Bernardi F. * Calandriello M. * Salvatorelli G. ** * Facultad de Odontología Universidad de Bolonia Departamento de Periodontología, Director: Profesor Marcello Calandriello ** Director del Departamento de Histología y Citología Universidad de Ferrara
PLA-PGA UTILIZADO COMO RELLENO ÓSEO
La experiencia clínica y radiografías indican que este nuevo biomaterial es biocompatible, no produce alergias ni origina inflamación.
En un caso clínico, los resultados histológicos han demostrado que, al terminar la cicatrización, el material óseo trabecular había sustituido por completo al biopolímero. Entre las travéculas, se observan espacios que contienen células tanto adiposas como vasculares, indicando la formación de médula ósea.
La observación mediante microscopio electrónico ha confirmado estos resultados.
Palabras clave
Defectos óseos; reparación ósea; relleno óseo.
Introducción
Actualmente, la cirugía periodontal exige utilizar, en algunos casos, injertos óseos (autólogos y/o alogénicos) para aportar apoyo estructural durante la cicatrización del hueso además de para sustituir tejidos enfermos o en mal estado. El riesgo de transmitir la infección (hepatitis, BSE, etc.), existe siempre en el caso de los injertos alogénicos, mientras que, en el de los autólogos, especialmente, de carácter extenso, surgen riesgos quirúrgicos y complicaciones posoperatorias en el emplazamiento donante.
Por las razones citadas, la clínica utiliza cada vez más materiales sintéticos. La bibliografía describe gran número de materiales de relleno utilizados para reparar defectos óseos y polímeros sintéticos bioabsorbibles que constituyen una de las innovaciones más importantes en el sector de los biomateriales (Ashman, 1992:, Ashman, 1993a; Ashman, 1993b;, Ewers y Lieb-Skowron, 1990; Kulkarny et al., 1971).
Entre dichos materiales, se ha utilizado el ácido poliláctico (PLA) y el poliglicólico (PGA) tanto en ortopedia como en cirugía maxilofacial desde hace más de una década. Los estudios de osteosíntesis han demostrado su eficacia tan elevada (Bos et al., 1989; Desilets et al., 1990; Giudice, 1993; Hollinger y Schmitz, 1987;, Majola, 1991; Manninen et al., 1992;, Miettinen et al., 1992; Paivarinta et al., 1993; Rehm et al., 1994; Suuronen, 1993; Thaller et al., 1992; Tsckalaloff et al., 1993; Vasenius et al., 1990).
En odontología, se utilizan desde hace algún tiempo las suturas quirúrgicas y membranas absorbibles preparadas con ácidos PGA y/o PLA para la regeneración guiada de tejidos (Robert et al., 1993; Robert y Frank, 1994). Pero en periodontología, hace tan sólo pocos años que se han utilizado los biopolímeros sintéticos absorbibles como rellenos o empastes óseos, y han demostrado su eficacia para estimular la regeneración ósea en algunos casos (Lundgren et al., 1992; Miyamoto & Takaoka, 1993; Winet y Hollinger, 1993).
Su biocompatibilidad total es una de las ventajas principales que ofrecen estos polímeros: el PLA se degrada hasta convertirse en ácido láctico que, a su vez, se descompone en agua y dióxido de carbono durante el ciclo de Krebs (el ciclo de Krebs abarca una cadena de reacciones bioquímicas que tienen lugar normalmente en el organismo y producen energía mediante los precursores glúcidos, en cambio, PGA se descompone mediante un proceso encimático específico (Bos et al., 1989a; Bos et al., 1989b; Bos et al., 1991; Cutright y Hunsuck, 1971; Leenslang et al., 1987). En 1994, surgió en el mercado italiano un biomaterial nuevo (´), producido a partir de los ácidos poliláctico/poliglicólico polimerizados (PLA-PGA), que se ha utilizado como relleno óseo sintético en la cirugía bucal.
La estructura de células abiertas esponjosas que presenta este polímero permite su colonización por osteoblastos. El tiempo necesario para la reabsorción depende del porcentaje relativo de los componentes y, por su carácter sintético, no origina riesgos desde el punto de vista biológico, como sucede en los productos derivados de seres humanos o animales.
Se puede obtener en forma de esponja, polvo o gel, para utilizarlo en odontología como material de empaste, dependiendo de las necesidades del caso y las características del lugar donde se aplica. La proporción de PLA y PGA es 50/50, aunque hay distintas fórmulas según los excipientes utilizados.
La esponja se produce mediante liofilización del PLA-PGA y dextran. La esponja, caracterizada por su enorme consistencia, se hidrata, en caso necesario, y se ablanda, posteriormente, mediante una solución fisiológica o sangre para introducirla en el lugar correspondiente, sin que haga falta compactarla.
El polvo se obtiene mediante pulverización de la esponja. Polvo y esponja se utilizan normalmente unidos para rellenar bolsas infraóseas, alveolos de extracciones dentales u otros defectos óseos, y se sujeta el material en posición mediante un colgajo.
El gel es una formulación nueva del material sintético de relleno y resulta especialmente adecuado para rellenar cavidades irregulares, que un colgajo no podría cerrar completamente, aunque sí puede hacerlo el gel debido a su gran estabilidad intrínseca en el lugar tratado. El gel se inyecta directamente, mediante la jeringa suministrada con el producto, en el lugar a rellenar.
Nuestra experiencia clínica
Debido a las posibilidades de utilización descritas anteriormente, el Departamento de Periodontología de la Universidad de Bolonia evaluó este biomaterial nuevo en 30 casos clínicos para formar depósitos óseos nuevos.
Aunque no se adoptó un protocolo experimental rígido, los primeros 30 casos tratados constituyeron una investigación clínica, especialmente, para averiguar la flexibilidad y facilidad de manejo de las tres formas como se presenta el producto, y los resultados obtenidos.
 |
El estudio abarcó 17 hombres y 13 mujeres cuyas edades variaban entre 29 y 66 años:
• Dieciocho se sometieron a cirugía periodontal: en 2 casos se utilizó una membrana reabsorbible (Paroguide); en 1 caso se aplicó una membrana no-reabsorbible (Gore).
• En 10 se hizo un empaste posterior a la extracción de la pieza dental: en 1 caso se utilizó una membrana reabsorbible (Vycril).
• En 2 casos se realizaron implantes: en 1 se utilizó una membrana reabsorbible (Paroguide); y en el segundo se utilizó una membrana no-reabsorbible (Gore).
En todos los casos se rellenó la zona afectada con una cantidad adecuada de Fisiograft. En el 9% de los casos se aplicó una fórmula en polvo; en el 27% de los casos, se utilizó la esponja, y el gel en el 64%. En algunos casos, se utilizaron a la vez distintas formas del producto.
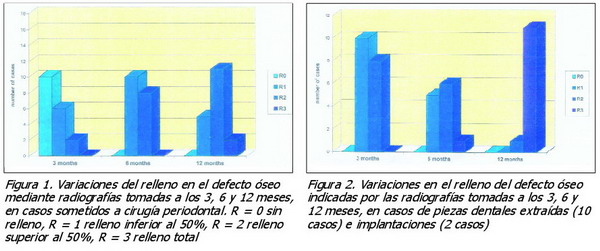
Se tomaron fotografías y se vigilaron los casos durante cierto tiempo, tanto desde el punto de vista clínico como mediante radiografías intraorales. Dentro de los límites consiguientes a la posibilidad de comparar radiografías realizadas en distintos momentos mediante una técnica normalizada, se utilizaron las imágenes radiológicas para clasificar el relleno de la zona afectada como indica la lista siguiente:
R = 0 sin relleno.
R = 1 relleno inferior al 50%.
R = 2 relleno superior al 50%.
R = 3 relleno total.
Las Figuras 1 y 2 muestran los resultados conseguidos: se observa un relleno progresivamente mayor en los casos posteriores a la extracción de piezas dentales y se consideran satisfactorios en ambos casos.
La situación de la reacción fisiológica que surge inmediatamente después de la intervención disminuyó rápidamente durante los días siguientes sin que fuera necesario aplicar un tratamiento antiinflamatorio a ningún paciente. No se presentaron casos de recidivas inflamatorias durante la semana siguiente a la intervención quirúrgica.
Para confirmar los resultados favorables conseguidos por este estudio, se realizó una evaluación objetiva en varios casos de la deposición de materia ósea nueva mediante el examen histológico y muestras del muón recogidas durante la ejecución de los implantes.
Citamos, como ejemplo, a continuación un caso.
 |
Informe de un caso
Las observaciones se refieren a un premolar superior izquierdo en muy malas condiciones. Edad de la paciente: 45 años.
Esta pieza dental se había tratado mediante endodoncia, sin éxito, utilizando un abordaje retrógrado y ortógrado. El examen mediante rayos X indicó una osteolisis periapical de 5 mm, de diámetro, aproximadamente.
Se decidió extraer la pieza e insertar una cantidad adecuada de Fisiograft en la cavidad. Se adoptó la fórmula de la esponja, por su consistencia compacta, que resulta adecuada para rellenar grandes cavidades.
Se preparó un colgajo muco-periosteo para proteger y mantener en posición el biomaterial utilizado como relleno óseo.
Durante la extracción, se realizaron los procedimientos siguientes:
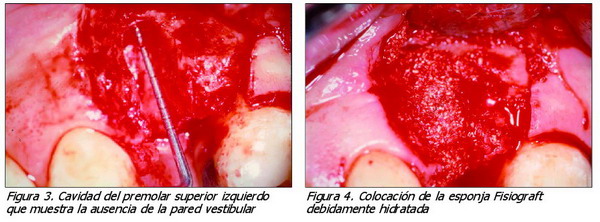
1. Legrado de la cavidad, que permitió comprobar la carencia de pared vestibular (Figura 3).
2. Ejecución de perforaciones inductivas, para favorecer la nueva deposición ósea.
3. Colocación de la esponja, tipo Fisiograft, debidamente hidratada con una solución fisiológica estéril (Figura 4).
4. Se sitúa encima una membrana poliglicólica absorbible (malla Vycril).
5. La cavidad se tapa con el colgajo muco-gingival estabilizado mediante puntos de sutura.
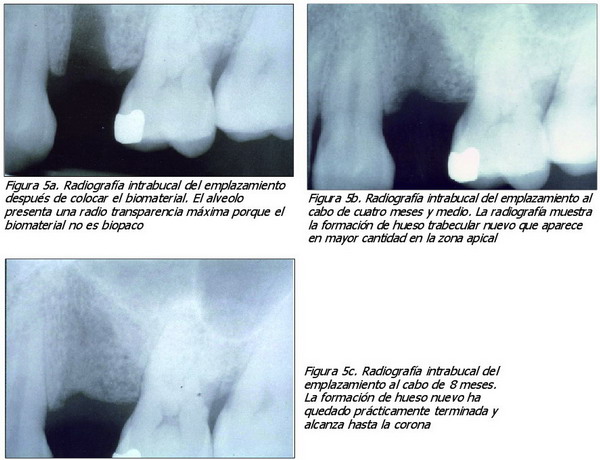
6. Examen inicial del emplazamiento, mediante rayos X, después de instalar el biomaterial (Figura 5a). El alveolo presenta una radiotransparencia máxima, porque el biomaterial no es radiopaco.
 |
Se retiraron los puntos de sutura a los 7 días después de la intervención.
Transcurridos 4,5 meses y 8 meses (figura 5b y 5c), se realizaron controles radiográficos. La radiografía tomada al cabo de 4,5 meses muestra hueso nuevo trabecular, que parece mayor en la parte apical. En la radiografía, al cabo de 8 meses, se ha completado prácticamente la formación del hueso nuevo, y ha alcanzado la corona. Estas secuencias radiográficas muestran la opacidad progresiva del emplazamiento del injerto, que se observa normalmente durante la cicatrización, y un alveolo sano después de la extracción. En este caso, se conservaron solamente tres paredes que, si no se hubiera aplicado el biomaterial, habría originado una reducción drástica de la anchura final bucolingual. En cambio, los resultados parecen óptimos para una prótesis de implante.
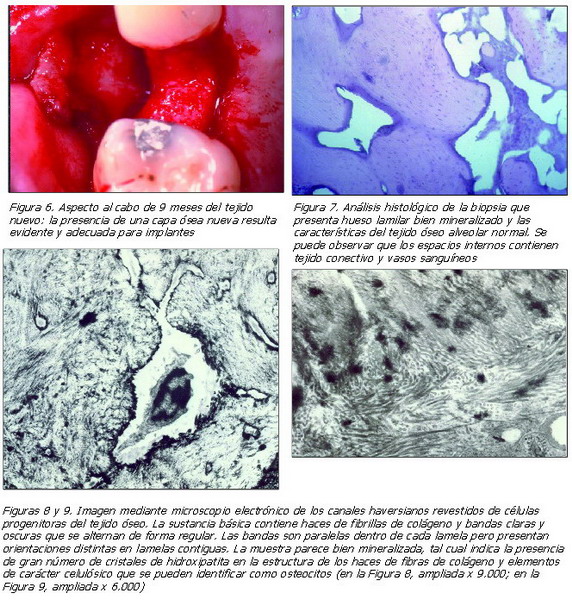
Al cabo de nueve meses, contados desde la intervención, se realizó un colgajo de acceso para dejar al descubierto el tejido mineralizado que se había formado idéntico al tejido óseo (Figura 6). Durante la intervención, se recogió una muestra de tejido del muñón (fijado mediante una solución de formalina tamponada) que se remitió para su examen histológico a fin de confirmar la observación clínica.
 |
Examen histológico
El material recogido para las biopsias consta de hueso laminar bien mineralizado que presenta las características del hueso alveolar normal. Se han observado espacios internos que contienen tejido conectivo y vasos sanguíneos (Figura 7) (demuestran la existencia de fenómenos de reparación y construcción originados por tejido óseo activo).
La presencia de numerosos osteones confirma la situación anatómica normal de la estructura del tejido óseo formada por láminas concéntricas dispuestas alrededor de los canales haversianos. Entre estos, aparecen numerosas cavidades óseas que contienen osteocitos. En varias zonas, la presencia de láminas intersticiales, residuo de generaciones anteriores de osteocitos, indican la reorganización previa del tejido óseo.
La observación microscópica no encuentra trazas del material implantado, infiltrados inflamatorios ni granulomas de cuerpos extraños que demostrarían la incompatibilidad del material.
El examen centró especialmente su atención en averiguar que no había linfocitos, macrófagos, células plamáticas, células gigantes y mastocitos, que aparecen siempre en casos de inflamación crónica.
El análisis mediante el microscopio electrónico de las estructuras finas confirmaron ampliamente las observaciones realizadas por el microscopio óptico (Figuras 8 y 9).
Células progenitoras del tejido óseo revestían los canales haversianos. La sustancia básica contiene haces de fibrillas de colágeno y bandas claras y oscuras que se alternan de forma regular. Las bandas son paralelas dentro de cada lamela, pero presentan orientaciones distintas en lamelas contiguas. La muestra aparece bien mineralizada, según indica la presencia de gran número de cristales de hidroxipatita en la estructura de los haces de fibras de colágeno y elementos de carácter celulósico, que se pueden identificar como osteocitos.
Comentario
Este copolímero sintético, disponible en distintas formas (esponjas, polvo y gel), se ha utilizado en los casos citados y comprobado que resulta muy fácil de manejar, porque se adapta perfectamente a las distintas situaciones que necesitan empastes o rellenos para la formación posterior de material óseo nuevo.
La experiencia indica que al utilizar Fisiograft y membranas reabsorbibles se consiguen resultados óptimos.
Los datos, tanto clínicos como instrumentales de estos casos, indican que este biomaterial nuevo es biocompatible, no produce alergias ni reacción inflamatoria, y confirma los datos señalados en la bibliografía (Hollinger, 1983; Meikle et al., 1994; Vert et al., 1994; Winet y Hollinger, 1993).
Conviene destacar que no existe riesgo biológico, por el origen sintético de este material.
Los resultados histológicos indican que el copolímero permaneció en el lugar del injerto hasta que terminó la cicatrización natural. Simultáneamente, el material óseo trabecular lo penetra hasta que lo sustituye por completo.
Los espacios entre las trabéculas contienen tejido adiposo y células vasculares que indican la formación de médula ósea (Schakenraad y Dijkstra, 1991; Winet & Hollinger, 1993). Estudios realizados anteriormente en seres humanos y animales indican que se produce la absorción total al cabo de cuatro meses, aproximadamente, desde la instalación del injerto (Leghissa et al., 1997; Saitoh et al., 1994) y presenta un perfil histológico comparable al observado en los casos clínicos descritos anteriormente.
Entre los aspectos más prometedores debemos señalar la posibilidad de agregar factores de crecimiento óseo al copolímero de los ácidos poliláctico/ poliglicólico. Los experimentos iniciales (Miyamoto et al., 1992; Miyamoto y Takaoka, 1993; Miyamoto et al., 1993) de muestran que el copolímero actúa como portador excelente de estos factores.
Nuestra experiencia apoya las expectativas optimistas sobre los resultados futuros de este biomaterial sintético, para sustituir al material óseo, que demuestra osteoconductividad, gran flexibilidad en la práctica y biocompatibilidad excelente. Los resultados conseguidos justifican ampliamente estudios futuros para confirmar la eficiencia del producto como estimulante del crecimiento óseo.
Bibliografía
1. Ashman A. (1992) Aplicaciones clínicas del material óseo sintético en odontología. Parte 1 General Dentistry 40. 481-487.
2. Ashman A. (1993a) Aplicaciones clínicas del material óseo sintético en odontología. Parte 2 General Dentistry 41. 37-44.
3. Ashman A. (1993b) Material óseo sintético para utilizar conjuntamente en los implantes endóseos. Dental Implantology Update 4, 17-21.
4. Bos RRM, Rozema FR, Boering G, Nijenhuis AJ, Pennings AJ y Verwey AB. (1989a) Placas y tornillos bioabsorbibles para fijaciones internas de fracturas mandibulares. Estudio en seis perros. International Journal of Oral y Maxillofacial Surgery 18, 365-369.
5. Bos RRM, Rozema FR, Boering G, Nijenhius AJ, Penning AJ y Janshen HWB. (1989b) Placas óseas y tornillos de poli(L-lactida) bioabsorbible: estudio en animales. British Journal of Oral y Maxillofacial Surgery 27, 467-489.
6. Bos RRM, Rozema FR, Boering G, Nijenhuis AJ, Penning AJ, Verwey AB Nieuwenhuis P y Janshen
HWB. (1991) Degradación y reacción del tejido ante un
poli(L-lactida) biodegradable utilizada para fijar internamente fracturas: estudio en ratas. Biomaterials 12, 32-36.
7. Cutright DE y Hunsuck EE. (1971) Reacción del tejido ante la sutura con ácido poliláctico biodegradable. Oral Surgery Oral Medicine Oral Pathology 31, 134-139.
8. Desilets CP, Marden LJ, Patterson AL y Hollinger JO. (1990) Desarrollo de materiales sintéticos para reparación ósea en reconstrucción craneo-facial. Journal of Craniofacial Surgery 1, 150-153.
9. Ewers R y Lieb-Skowron J. (1990) Materiales de osteosíntesis bioabsorbibles. Facial Plastic Surgery 7, 206-214.
10 Giudice M, Colella G y Marra A. (1993) Aplicaciones clínicas de los biomateriales. Minerva Stomatologica 42, 399-342.
11. Hollinger JO. (1983) Informe preliminar sobre la capacidad osteogénica de un copolímero biodegradable de polilactida (PLA) y poliglicólido (PGA). Journal of Biomedical Materials Research 17, 71-82.
12. Hollinger JO y Schmitz JP. (1987) Restauración de discontinuidades óseas en perros mediante implantes biodegradables. Journal of Oral y Maxillofacial Surgery. 45, 594-600.
13. Kulkarny RK, Moore EG, Hegyeli AF y Leonard F. (1971) Polímeros de ácidos polilácticos biodegradables. Journa Biomedical Materials Research 5, 169-181.
14. Leenslang JW, Penning AJ, Bos RRM, Rozema FR y Boering G. (1987) Materiales reabsorbibles de poli(L-lactida). Degradación “in vivo” e “in Vitro”. Biomaterials 8, 70-73.
15. Leghissa GC, Salvatorelli G, Gulinati AM, Anzanel D. y Marchetti MG. (1997) Material nuevo para la regeneración ósea guiada. Dentista Moderno 6, 77-85.
16. Lundgren D, Nyman S, Mathisen T, Isaksson S y Klinge B. (1992) Regeneración ósea guiada, aplicada en defectos craneales, mediante barreras biodegradables: estudio experimental piloto en conejos. Journal of Craniomaxillofacial Surgery 20, 257-260.
17. Majola A. (1991) Fijación de osteotomías experimentales con tornillos de ácido polilácticotal absorbibles. Annales Chirurgiae et Gynaecologiae 80, 274-281.
18. Manninen MJ, Paivarinta U, Taurio R, Tormala P, Suuronen R, Raiha J, Rokkanen P y Patiala H. (1992) Tornillos de polilactida para fijar osteotomías. Estudio mecánico en ovejas. Acta Orthopaedica Scandinavica 63, 437- 442.
19. Meikle MC, Papaioannou S, Ratledge TJ, Speight PM, Watt-Smith SR, Hill PA y Reynolds JJ. (1994) Efecto de los implantes de Poli DL-lactida-co-glicolida y factores del crecimiento de la matriz ósea seudogenéica derivada para reparar material óseo calvárico en conejos. Biomaterials 15, 513-521.
20. Miettinen H, Makela EA, Vainio J, Rokkanen P y Tormala P. (1992) Efecto de un implante intramedular autorreforzado de poli-L-lactida (SR-PLLA) sobre el crecimiento óseo y su relación, especialmente, con las propiedades de fijación. Estudio experimental en conejos en crecimiento. Journal of Biomaterial Science Polymers Ed. 3, 443-450.
21. Miyamoto S, Takaoka K, Okada T, Yoshikawa H, Hashimoto J, Suzuki S y Ono K. (1992) Evaluación de homopolímeros del ácido poliláctico como portadores de proteína morfogenética ósea. Clinical Orthopaedics and Related Research 278. 274-285.
22. Miyamoto S, Takaoka K, Okada T y Yoshikawa H. (1993) Bloques de co-polímero del ácido poliláctico – glicopolietileno. Portador sintético nuevo biodegradable para la proteína morfogénica ósea (BMP). Clinical Orthopaedics and Related Research 294, 333-342.
23. Miyamoto S y Takaoka K. (1993) Inducción y reparación ósea mediante composites de proteina morfogenética ósea y polímeros sintéticos biodegradables. Annales Chirurgiae et Gynaecologiae Suppl. 207, 69-75.
24. Paivarinta U, Bostman O, Toivonen T, Tormala P y Rokkanen P. (1993) Reacción celular intraósea al utilizar tornillos biodegradables de poliglicolido o polilactida para fijar fracturas. Archives Orthopedic Trauma Surgery 112, 71-74.
25. Rehm KE, Helling HJ y Claes L. (1994) Bericht der arbeitsgruppe biodegradable implantate. Aktuelle Traumatologie 24, 70-73.
26. Robert PM y Frank RM. (1994) Regeneración guiada de tejidos periodontales empleando una membrana nueva de ácido poliláctico reabsorbible. Journal of Periodontololgy 65, 414-421.
27. Robert PM, Maudit J, Frank RM y Vert M. (1993) Biocompatibilidad y reasorbabilidad de una membrana de ácido poliláctico reabsorbible para la regeneración guiada de tejidos periodontales. Biomaterials 14, 353-358.
28. Saitoh H, Takata T, Nikau H, Shintani H, Hyon SH y Ikada Y. (1994) Compatibilidad de tejidos de ácidos polilácticos en el emplazamiento en el esqueleto. Journal of Materials Science: Materials in Medicine 5, 194-199.
29. Schakenraad JM y Dijkstra PJ. (1991) Biocompatibilidad de los copolímeros de poli(ácido láctico DL/ glicina). Clinical Materials 7, 253-167.
30. Suuronen R. (1993) Dispositivos biodegradables para fijar fracturas en la cirugía maxilofacial. International Journal of Oral y Maxillofacial Surgery 22, 50-57.
31. Thaller SR, Huang V y Tesluk H. (1992) Utilización de placas y tornillos biodegradables según un modelo de conejos. Journal Craniofacial Surgery 2,168-173.
32. Tsckalaloff A, Losken HW, Lalikos J, Link J, Mooney MP, von Oepen R, Michaeli W y Losken A. (1993) Estudios experimentales sobre placas y tornillos biodegradables de ácido DL-poliláctico en conejos: tomografía informatizada y pérdida de peso molecular. Journal of Craniofacial Surgery 4, 223-227.
33. Vasenius J, Vainionpaa S, Vihtonen K, Mero M, Makela A, Tormala P y Rokkanen P. (1990) Estudio histomorfolótico sobre implantes autorreforzados para la osteosintesis de poliglicolidos (SRPGA) revestidos de polímeros para absorción lenta. Journal of Biomedical Materials Research 24, 1615-1635.
34. Vert M, Li SM y Garreau H. (1994) Planteamientos para caracterizar la estructura y degradación de poliésteres alifáticos derivados de ácidos lácticos y glicólicos. Journal of Biomaterial Science Polymers Ed. 6, 639-649.
35. Winet H y Hollinger JO. (1993) Incorporación de polilactida/poliglicolidos a un defecto cortical: neosteogénesis en una cámara ósea. Journal of Biomedical Materials Research 27, 667-676.