El objetivo de este estudio es evaluar la eficacia de los bloques de aloinjertos de banco de hueso para la reconstrucción de los defectos maxilares previos a la rehabilitación con implantes dentales. En todos los cinco casos se realizó aumento horizontal.
Los controles clínicos y radiológicos se efectuaron hasta los 4-6 meses del posoperatorio cuando se instalaron los implantes dentales. No hubo pérdida de ninguno de los bloques de aloinjertos ni de los implantes dentales colocados. La utilización de bloques y aloinjerto puede considerarse como una alternativa adecuada cuando se comparan con la utilización de autoinjertos. Se reduce el tiempo quirúrgico, se puede realizar el procedimiento con anestesia local, hay un gran volumen de material a injertar y, como consecuencia, se reduce la morbilidad quirúrgica.
Introducción
En casos de maxilares parcial o totalmente edéntulos, el hueso entra en un proceso de reabsorción irreversible de mayor intensidad durante el primer año y medio después de la pérdida de las piezas dentales (1, 2, 3). Como consecuencia, se pierde altura y anchura ósea, con lo que la pérdida de volumen puede llevar a una relación intermaxilar inapropiada. La calidad ósea también se transforma predominando en su estructura la capa cortical.
Es a través del proceso de la osteoinducción por el cual se crea nuevo hueso en los pacientes. Este proceso de diferenciación celular viene coordinado por glicoproteínas como la BMP. Las BMP están presentes en el hueso autólogo y en el aloinjerto. Todo este proceso de osteinducción determina el crecimiento tridimensional de los vasos capilares, el tejido perivascular y de las células osteoprogenitoras desde el hueso del paciente al injerto (4, 5).
Los procedimientos de reconstrucción ósea requieren que el clínico realice una selección adecuada del tipo de injerto y de la técnica quirúrgica entre todas las alternativas que se describen en la literatura (6, 7, 8, 9, 10, 11). Actualmente, el tipo material de elección para procedimientos de aumento óseo es el hueso autólogo de zonas intraorales y/o extraorales (11, 12).
Las técnicas quirúrgicas para la obtención de hueso autólogo precisan de una adecuada formación quirúrgica, conllevan un aumento de la morbilidad por necesitar dos áreas quirúrgicas, pueden ocasionar procesos inflamatorios o dolorosos en el postoperatorio y suelen ser más caras.
Para evitar este listado de problemas se ha ido estudiando diferentes tipos de materiales que nos permitieran poder reconstruir los defectos óseos de manera segura y poco traumática (2, 13, 14, 15, 16, 17, 18, 19). Una de las opciones que se ha ido estudiando fue la de utilizar tejidos humanos transplantados de otra persona (19, 20, 21, 22, 23, 24). Toda esta evolución clínica ha llevado a la aparición de bancos de tejidos humanos y a diferentes tipos de presentación del material a injertar.
El objetivo de este estudio es evaluar la aplicación de los aloinjertos óseos como material a utilizar en la reconstrucción de los maxilares y futura rehabilitación con implantes dentales.
Material y método
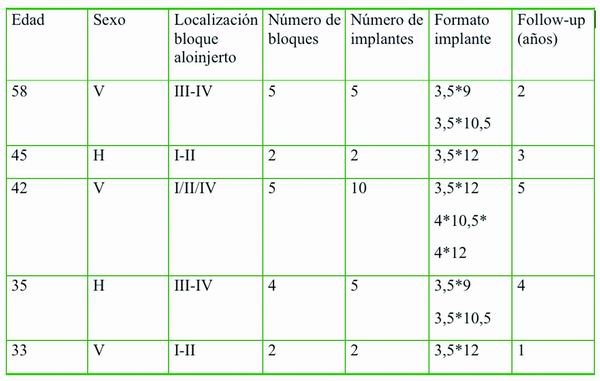
Desde febrero de 2005 hasta septiembre 2009 se han intervenido a cinco pacientes para la reconstrucción de plataforma ósea previa a la colocación de implantes dentales. Los injertos utilizados han sido bloques de aloinjertos procedentes de banco de huesos (TSF. Trasplant Services Foundation. Sant Boi de Llobregat. Barcelona). En dos casos se han utilizado bloques de aloinjerto procedentes de calota craneal y en los otros tres casos procedentes de cresta ilíaca ántero-superior.
El rango de edad de los pacientes estuvo entre los 33 y 58 años con una media de 42,6 años. Dos pacientes mujeres y tres varones. El periodo de follow-up de los pacientes oscila desde los cinco años hasta un año, con todos los implantes y las prótesis implanto-soportadas siendo funcionales durante todo este tiempo.
Los procedimientos quirúrgicos los realizaron dos cirujanos experimentados. En dos procedimientos quirúrgicos se empleó la técnica de anestesia local + sedación consciente.
Todos los aloinjertos se utilizaron para el aumento óseo horizontal.
Procedimiento quirúrgico
Incisión crestal de espesor total, exposición de zona receptora, microperforaciones en cortical para obtener sangrado activo. Se hidrata entre 15 a 30 minutos antes de la utilización del bloque de aloinjerto con solución salina. Se corta el bloque en dos mitades manteniendo en cada uno de ellos la zona córtico-esponjosa. Antes de la fijación de los bloques óseos, se recontornean para adaptarlos a la zona receptora. Los bloques se estabilizan con microtornillos de titanio autorroscantes de diámetro 1,2 mm (Jeil Medical Corporation. Seoul. Korea). Se rellenan las gap entre los bloques con chips de aloinjerto + autólogo y se cubre con membrana de colágeno (Collagene AT. Centro di Odontoiatria operativa. Padova. Italia).
Incisiones de descarga en periostio y sutura con puntos de seda 4/0 (Laboratorio Aragó. Barcelona. Spain). Los puntos de sutura se retiran a los 10-15 días de la intervención.
Durante el periodo de integración de aloinjerto hasta la colocación de los implantes se hicieron visitas de control cada tres semanas para detectar posibles complicaciones como dehiscencia de sutura, infección del aloinjerto, movilidad del bloque. Al mes y medio y a los cuatro meses, mediante ortopantomografía y estudio tomográfico con I-Cat se comprobó la integración del nuevo injerto en la zona receptora y ausencia de radiolucencia del tornillo de fijación.
En un segundo estadio quirúrgico se colocan los implantes dentales por medio de incisón crestal con disección de flap de espesor total. Toma de biopsia de la unión del aloinjerto con el hueso autólogo con trefina de 2 mm de diámetro. Se colocan implantes dentales (Biohorizons. Birmingham. Alabama. USA), se comprueba la estabilidad primaria de los mismos.
Después de cada intervención los pacientes siguen tratamiento médico con amoxicilina+ácido clavulánico 875/125 mg (Laboratotio Normon. Madrid . España), dextroketoprofeno 25 mg (Grupo Menarini. Barcelona. España), colutorio de clorhexidina al 0.12% durante 21 días.
Procesamiento de los aloinjertos:
Para poder utilizar los tejidos de un donante (12, 22, 26, 38, 39, 42, 43) se realiza una selección aplicando unos criterios: historia médico-social del donante, antecedentes patológicos, exploración física y determinaciones de laboratorio. Los parámetros de laboratorio (30) son:
1. Serologías: HIV, hepatitis B, Hepatitis C, sífilis, HLTV I-II y PCRs para VIH-1, VHC y VHB.
2. Hemograma y fórmula leucocitaria.
3. Bioquímica hepática.
4. Grupo sanguíneo y antígeno rhesus (RH(d)).
 |
| Tabla 1. |
Una vez seleccionado el donante, se almacenan los tejidos en un congelador a menos 80ºC. El procesamiento de los tejidos osteotendinosos consta de cuatro fases.
La inicial es la limpieza y manufacturación de los injertos.
Posteriormente, se procede a la descontaminación de los tejidos. Éste proceso consiste en someter a los tejidos a una serie de procesos mecánicos (centrifugación e incubación en cubeta de ultrasonidos) y agentes químicos (inmersión en peróxido de hidrógeno, alcohol, antibióticos). Con esto se consigue los agentes líquidos penetren en la matriz ósea produciendo lisis celular y limpieza de los tejidos.
El siguiente paso es la liofilización que consiste en la reducción de un porcentaje de agua de los injertos hasta valores menores del 5%. La liofilización permite preservar los tejidos a temperatura ambiente, disminuir la posibilidad de transmisión de patología infecciosa y de reacciones inmunes producidas por efectos de la deshidratación de los gérmenes o celular (25, 26, 27).
La fase final es el empaquetamiento de los injertos con blisters que son sellados térmicamente.
Resultados
Se colocó un total de 13 bloques de aloinjerto para el crecimiento horizontal (Tabla 1). Ninguno de los 24 implantes colocados en los bloques de aloinjerto presentó complicaciones de manera inmediata ni durante todo el periodo de seguimiento.
En un paciente varón se observó una pequeña dehiscencia de sutura al cabo de 15 días de la intervención en uno de los bloques instalado en el 4º cuadrante. Se rebajó ligeramente el grosor del bloque y se cerró de nuevo por primera intención sin complicaciones posteriores. Al cabo de dos años, en el mismo paciente, se realizó una cirugía para rebajar grosor óseo en zona más apical de un bloque instalado en la zona posterior del primer cuadrante por fenestración del tejido blando. No tuvo consecuencias en los implantes colocados en la zona del aloinjerto ni en la prótesis implanto-soportda.
Discusión
Desde hace muchos años se ha estudiado la posibilidad de transplantar hueso entre humanos. Con la utilización de este tipo de material se reduce el número de áreas quirúrgicas, la morbilidad intraoperatoria del área donante y el disconfort posoperatorio de dicha zona.
La utilización de aloinjertos ha sido ampliamente estudiada en otras especialidades médicas como la cirugía ortopédica, traumatología y neurocirugía. En la actualidad, los hospitales utilizan los bancos de hueso para el tratamiento de determinados tipos de fracturas óseas, cirugía del raquis y en casos de artroplastias. Este tipo de injerto se encuentra en volúmenes suficientes y actúa de manera segura y eficiente.
Las desventajas del aloinjerto de banco pueden ser la posible capacidad de trasmisión de patógenos o la falta de oseogénesis. Desde 1995 en EUA se han realizado más de 1,5 millones de transplantes de hueso procedente de banco y no se ha detectado en ningún caso transmisión de virus ni priones. Aunque cuando vayan surgiendo nuevos patógenos, se tendrán que comprobar y estudiar los injertos procedentes de los bancos.
Por otro lado, los aloinjertos proporciona con sus propiedades osteoconductivas un esqueleto adecuado para la regeneración del hueso que sustituirá al injerto. La problemática de los aloinjertos viene determinada por su capacidad de remodelarse en el tiempo con la capacidad de formar y estimular la creación de hueso dentro y alrededor del al aloinjerto en hueso esquelético a través de procesos de modificación física y/o química del injerto
Las capacidades osteinductivas de los aloinjertos no quedan bien definidas en la literatura. Recientes estudios como el de Simpson et al. mostraron el crecimiento de células óseas in vitro en muestras de aloinjerto de banco después de un periodo de cuarentena de seis meses. Otros estudios muestran que con las nuevas técnicas de esterilización se preservan la matriz no desmineralizada del hueso y las proteínas morfogenénticas (28, 29). Los nuevos tipos de procedimientos de esterilización mantienen la resistencia biomecánica del aloinjerto con las fuerzas de compresión axial
Los resultados que muestran nuestro estudio nos llevan a obtener un éxito total en la utilización de aloinjertos para la reconstrucción ósea en defectos localizados o extensos en los maxilares, comparables a los resultados obtenidos con los reportados con los injertos autólogos. En los casos iniciales, después de la colocación de los implantes y en las visitas de seguimiento, se observó una tasa de reabsorción del aloinjerto escasa, menor que la esperable en casos de injertos de bloques de hueso autólogo.
Encontramos un caso con fenestración en la mucosa vestibular después de dos años de la colocación de los implantes dentales. No hubo pérdida de implantes dentales en las zonas donde se injertaron bloques de hueso de banco.
En nuestro estudio no nos planteamos la colocación de implantes en el mismo momento de la colocación del bloque de hueso de banco. Sabemos que la cirugía en un solo estadio reduce el tiempo de cicatrización, decidimos colocar los implantes en un segundo tiempo quirúrgico para no interferir con la situación de los tornillos de osteosíntesis que fijan el bloque de hueso y para mejorar la incorporación del aloinjerto en el hueso transplantado al aumentar la revascularización (30, 31).
Conclusiones
La utilización de aloinjertos en bloques de hueso procedente de banco, es una alternativa real a la reconstrucción ósea en maxilares atróficos.
Se reducen las áreas quirúrgicas y la morbilidad quirúrgica. La tasa de éxito de los bloques de aloinjerto es comparable a los resultados obtenidos cuando se utiliza hueso autólogo del paciente.
A medio plazo el grado de reabsorción de los aloinjertos es menor que cuando se utiliza el hueso autólogo como material de relleno. Hay una diferencia del comportamiento del aloinjerto en los maxilares respecto a otras áreas del cuerpo humano donde el proceso de reabsorción es más rápido.
Valorar el biotipo periodontal previo a la cirugía de aumento óseo para evitar posibles complicaciones inmediatas y/o a medio plazo con este tipo de material de relleno.
Se necesitan estudios a más largo plazo para confirmar nuestros resultados.
Texto elaborado por:
Drs. Josep Novell Costa, Ferran Novell Costa / Carlos Ivorra Server, Carlos Martínez / Martínez, Antonio Munilla.
IMOI. Instituto Mediterráneo de Odontología e Implantología. Barcelona.
Bibliografía
1. Pietrokovski J, Massler M. Alveolar ridge reabsortion following Tooth extraction. J Prosthet Dent. 1967;17(1):21-7.
2. Perrot DH, Smith RA, Kaban LB. The use of fresh frozen allogenic bone for maxillary and mandibular reconstruction. Int J Oral Maxillofac Surg. 1992;21:260-265.
3. Marx RE. Bone and bone graft healing. Oral Maxillofac Surg Clin Nort Am. 2007;19(4):455-66.
4. Mulliken JB, Glowacki J, Kaban LB, et al. Use of demineralizaed allogenic bone implants for the correction og maxillocraniofacial deformities. Ann Surg . 1981;194:366.
5. Köndell PA, Mattsson T, Astrand P. Inmunological responses to maxillary on-lay allogenic bone grafos. Clin Oral Implants Res. 1996; 7:373.
6. Jensen J, Sindet-Pedersen S. Autogenous mandibular bone grafts and osseointegradted implants for reconstruction of the severely atrophied maxilla: A preliminary report. J Oral Maxillofac Surg. 1991;49:1277-1287.
7. Breine U, Bränemark P-I: Reconstruction of alveolar jaw bone. An experimental and clinical study of inmediate and preformed autologous bone grafts in combination with osseintegrated implants. Scand J Plast Reconstr Surg. 1980;14(1):23-48
8. Garg AK, Morales MJ, Navarro I, Duarte F. Autogenous mandibular bone grafts in the treatment of the reabsorbed maxillary anterior alveolar ridge: Rationale and approach. Implant Dent. 1998;7(3):169-76.
9. Barone A, Covani U. Maxillary alveolar reconstruction with nonvascularized autogenous block bone: Clinical results. J Oral Maxillofac Surg. 2007;65(10):2039 -46
10. Carlson ER. Mandibular bone grafts: Techniques, placement and evaluation. In:Kelly J. P. (ed). The oral and maxillofacial surgery knowledge update. American association or oral and maxillofacial surgeons. RCN. Rosemont, IL, USA. 1994:35-62
11. Gooldberg MV, Stevenson S. Natural history of autografts and allografts. Clin Orthop Relat Res. 1987;225:7-16.
12. Khan SN, Cammisa FP Jr, Sandhu HS, Diwan AD, Girardi FP, Lane JM. The biology of bone grafting. J Am Acad Orthop Surg. 2005 Jan-Feb;13(1):77-86. Review
13. Stacchi C, Orsini G, Di Iorio, Breschi L, Di Lenarda R. Clinical, histological and histomorphometric analices of regenerated bone in maxillary sinus augmentation using fresh frozen human allografts. J Periodontol. 2008;79 (9): 1789-1796.
14. Barone A, Varanini P, Orlando B, Tonelli P. Deep frozen allogenic onaly bone grafos for reconstruction of atrophic maxillary alveolar ridges: a preliminary study. J Oral maxilllofac Surg. 2009;67:1300-1306.
15. Rochanawutanon S. Long term follow-up of reconstruction of allogenic mandibular bone crib packed with autologous particulate cancellous bone marrow. Cell Tissue Bank. 2002;3:183-197
16. Petrungaro PS, Amar S. Localized ridge augmentation with allogenic block grafts prior to implant placement: Cases reports and histologic evaluations. Implant Dent. 2005;14(2):139-48
17. Pogrel MA. The lower border rib graft for mandibular atrophy. J Oral Maxillofac Surg. 1988;46:95-99
18. Wolfinbarger L Jr, Eisenlohr LM, Ruth K. Demineralized bone matriz: maximizing new bone formation for succesful bone implantation. IN: Pietrzak WS, ed. Musculoeskletal Tissue Regenertaion. Totowa, NJ: Humana Press.2008:93-118
19. MacEwen W. Observations concerning transplantation of bone: illustrated by a case of inter-human osseus transplantation, whereby over two-thirds of the shaft of a humerus was restored. Proc Royal Soc. 1881;32:232-247
20. Maceren. Intrahuman bone grafting and reimplantation of bone. Ann Surg 1909;50:959-963
21. Hyatt GW. Fundamentals in the use and preservation of homogeneous bone. U. S. Armed Forces Medical J. 1950;1:841-852
22. Ilan DI, Ladd AL. Bone graft substitutes. Oper Tech Plast Reconstr Surg. 2003;9:151
23. Albert A, Leemrues T, Druez V,. Are bone autografts still necessary in 2006? A three-year retrospective study of bone grafting. Acta Otrhop Belg. 2006;72(6):734-40
24. Kao ST, Scott DD. A review of bone substitutes. Oral Maxillofac Surg Clin North Am. 2007;19(4):513-21, vi.
25. Hofmann A, Konrad L, Hessmann, K¸chle R, Korner J. Rompe JD, Rommens PM. The influence of bone allograft processing on osetoblast attachment and function. J Orthop Res. 2005;23:846-852
26. Moore M, Linthurst Jones A, Gaskins B et al. Adaptation of ANSI/AAM/ISO 11137 method 2B sterilization validation for medical devices to tissue banking. Prested at : Amrican Association of the Tissue Banks Annual Meeting; Chicago, IL; August 2004
27. Anderson MJ, Keyak JH, Skinner HN. Compressive mechanical properties of humna cancellous bone after gamma irradiation. J Bone Joint Surg Am. 1992;74:747-752.
28. Virolainen P, Hikikila J, Hirn M, Aro HT, Aho AJ. 30 years of bone banking at Turku bone bank. Cell Tissue Bank. 2003;4(1):43-8.
29. Carinci F, Brunelli G, Zollino I, Franco M, Visconi A, Rigo L,Guidi R and Strohmenger L. Mandibles grafted with fresh-frozen bone: an evaluation of implant outcome. Implant Dent. 2009; 18(1):86-9
30. Kalter ES, By TM. Tissue banking in Europe. BR Med Bull. 1997;53:798-816
31. Salai M, Pritsch M, Amit Y, Isareli A, Chechick A. Twenty-five years of clinical experience with bone banking in Israel. Isr Med Assoc J. 1999;1:20-2




