Dra. Carmen Álvarez Quesada. Médico Estomatólogo. Profesora Titular de Materiales Odontológicos. Departamento de Odontología Universidad Europea de Madrid. Miembro del Comité Científico de Gaceta Dental / Dr. José Carrillo Baracaldo. Médico Estomatólogo Profesor Titular de Materiales Odontológicos Departamento de Odontología Universidad Europea de Madrid. Miembro del Comité Científico de Gaceta Dental
Actualmente los implantes dentales y sus materiales están en constante estudio y observación científica con el fin de mejorar sus resultados sobre los pacientes.
Introducción
Los implantes no sólo se diferencian en su diseño y en los materiales constituyentes sino que también difieren en el tratamiento y acabado de la superficie y en la naturaleza de su recubrimiento.
Hoy día la superficie del implante es un tema de alto interés ya que de ella depende la posible osteointegración entre un cuerpo extraño que es el implante y un organismo vivo que es hueso.
Nos conviene recordar algunas ideas al respecto para así lograr una mayor comprensión de la clave del proceso, la interfase formada entre implante y hueso del paciente.
No olvidaremos que a mayor superficie del implante mejor se puede realizar la osteointegración fisiológica, estructural y funcional, asimismo como el concepto biocompatibilidad del implante con el organismo del huésped, que es una respuesta adecuada del biomaterial con el organismo sin ningún tipo de reacción adversa (1-3)
Las capas atómicas más externas de la superficie de un implante son regiones críticas asociadas con interacciones bioquímicas en la interfase implante-tejido.
Por eso influye de forma muy importante el tipo de material de recubrimiento y su acabado, lo que nos interesa es que esos materiales bioinertes sin capacidad osteogénica convertirlos y transformarlos mediante tratamientos adecuados en materiales bioactivos, los cuales sí son capaces de estimular la formación de hueso sobre toda la superficie del implante.
Tratamientos de las superficies para implantes
Los implantes dentales pueden estar recubiertos de materiales diversos, aunque su estructura y composición interior suele ser metálica (predominantemente de titanio y de sus aleaciones y combinaciones), pueden a su vez estar recubiertos de materiales metálicos, cerámicos, poliméricos y otros tipos de recubrimientos.
Existen diferentes tipos de tratamientos que se pueden realizar en las superficies de los implantes con el objetivo de favorecer y mejorar la osteointegración, entre los tratamientos más efectivos de hoy día destacamos:
En las superficies metálicas, se pueden recibir diferentes tipos de tratamientos que tratan de hacerlas más idóneas, para así poder cumplir mejor su objetivo.
Estos tratamientos son:
A) La pasivación
Se logra mediante el recubrimiento de la superficie con una capa de óxido que limpia toda la superficie de restos orgánicos e inorgánicos y evita la liberación de iones metálicos al medio exterior (oxidaciones y corrosiones que producen desestructuración), así se aumenta la biocompatibilidad, también se favorece la resistencia al desgaste y se mejora la dureza de la superficie. Se pueden realizar mediante la inmersión en ácido nítrico al 40 % y también en soluciones de este ácido con ácido fluorhídrico, en pocos segundos (alrededor de 30 g), con lo que se logra una pequeña capa anodizada (4, 5).
B) La anodización
Habitualmente se realiza por medio de una corriente eléctrica que atraviesa el metal (se produce una capa más gruesa de óxido en la superficie del material) lo que logra una mejora en la resistencia a la corrosión del implante (6).
c) La texturización
Aumenta hasta seis veces o más el área de la superficie del implante aumentando así la osteointegración por favorecer el aumente de superficie en contacto con el hueso. Mejora la resistencia a la corrosión y a la fatiga del implante. Para este aumento de superficie y creación de rugosidades y asperezas existen varias técnicas, entre ellas destacamos:
— Ataque a la superficie mediante ácidos: lógicamente dependerá del tipo de titanio o aleación del implante y del tipo y características del ácido. Como inconvenientes destacamos que es un método en el cual no podemos controlar bien el tamaño y la forma de esas rugosidades, ni su disposición, y por otro lado se pueden formar hidruros de Ti que pueden aumentar las posibilidades de fracturas. Actualmente se están llevando a cabo estudios de implantes grabados con ácidos y posteriormente tratados con luz ultravioleta (durante diferentes periodos de tiempo por encima de 48 h) para inducir así de este modo una fotocatalicidad del titanio, lo que se piensa que favorece la capacidad osteoconductiva en hueso de ratas y el proceso catalítico de la absorción de proteínas, más o menos alrededor de las 4 semanas, se cree que las superficies de titanio tratadas con luz UV se les favorece la capacidad osteoinductiva y el proceso de remoción de la superficie del titanio de los hidrocarbunos, realizándose lo que llaman una fotofuncionalización que favorece la unión al hueso (7).
— Ataque a la superficie con sustancias básicas: se han realizado estudios sobre el tratamiento de la superficie del titanio con H2O2 (peróxido de hidrógeno), durante diferentes periodos de tiempo, desde 0-24 horas y hasta 1 o 4 semanas, observándose la superficie con SEM, perfilometría, espectroscopia y difracción de RX y se ha observado un aumento de la rugosidad en la superficie y un máximo grosor de oxidación entre 1 hora a 4 semanas y entre 3 horas a 4 semanas respectivamente, y en la adsorción de proteínas que se asocia al poder de atracción de los osteoblastos y de la mineralización que sería posiblemente beneficioso para la osteointegración (8).
— Ataque a la superficie mediante el chorro de arena (Sand Blasting): se bombardean partículas muy duras sobre la superficie y de esta manera se producen improntas o marcas que dan rugosidad. Los atacados con óxido de titanio presentan menor rugosidad, los bombardeados con CSi obtienen mejores resultados, pero se ha visto que donde se logra mejor superficie es con los de alúmina (Al2 O3) con partículas de tamaño medio se logran rugosidades de 4 micrones, lo que favorece una buena adherencia celular, y además se ha observado un aumento de osteocalcita que indica rapidez y buen desarrollo celular (3).
— Pulverización con plasma spary de titanio: realizadas con el mismo material que el implante. Como desventaja hay a veces alteraciones en la unión y se producen pequeños espacios y pueden quedan partículas de Ti libres en la superficie que se pueden descamar.
— Sinterización de esferas de titanio: realizadas con el mismo material del implante favoreciendo las rugosidades. Inconveniente: que el diseño es muy importante y se podría alterar la resistencia a la corrosión y la fatiga. Hoy día hay recientes investigaciones con superficies de implantes tratadas con presión y sinterización que muestran valores predictivos de comportamiento del implante en hueso, demostradas con estudios nanotopográficos (9, 10) que demuestran que las células del hueso son exquisitamente sensitivas en cuanto a la adaptación a la superficie así tratada y a su posterior crecimiento.
— Tratamiento con plasma spray de hidroxiapatita (HA): o chorro de gas ionizado a altas temperaturas (más de 10.1000 ºC), se depositan partículas en la superficie que se unen y adhieren a la superficie del implante. Como desventajas, sería la aparición de fisuras o grietas y falta de unión y la creación de defectos o espacios que favorecen la anidación de gérmenes favoreciendo así alteraciones periimplatarias.
— Tratamiento de la superficie con Láser: como desventaja el procedimiento es más lento pero se logra una capa homogénea y cristalina por la evaporación de HA y su depósito en capas muy finas de grosor controlado sobre el implante. Hay trabajos recientes que demuestran que las superficies tratadas con Láser de Neodimio mejoran la fatiga, corrosión y biocompatibilidad (11).
— Implantación iónica: obtenida mediante el bombardeo de la superficie con iones de alta energía hasta una profundidad de 0,1 micrones, aumentando así la resistencia a la corrosión debido a que se forma una película superficial de TiN. Estas superficies así tratadas son muy biocompatibles (11).
D) Método termoquímico
Este método sirve para transformar la superficie de bioinerte a bioactivo, formar in vivo o en una solución fisiológica simulada una capa de HA carbonatada, así se pueden incorporar fármacos al recubrimiento, proteínas que favorecen la formación del hueso, o evitar procesos infecciosos. La apatita es el ión de calcio con la misma composición química que la fase mineral del hueso, así el cuerpo la acepta como propia, crece sobre él y no da reacciones inflamatorias, siendo material bioactivo, si está en forma amorfa puede ser reabsorbido por el organismo. Esta reabsorción disminuye con la cristalinidad, así si es cristalina es prácticamente insoluble, se incorpora al hueso y queda como material inerte, sin conjuntivo alrededor, crece sobre la superficie del titanio depositándose con un enlace químico y aumenta así la estabilidad de la capa, evitando las colonizaciones en los espacios, obteniéndose capas homogéneas de espesor controlado. Este tratamiento se puede realizar sobre el metal rugoso, arenado (fijación física) o tratado al ácido (fijación química), con lo que se logra una superficie rugosa que adquiere la capacidad de la bioactividad y así el implante de Ti pasa a ser mejor aceptado e integrado en el tejido óseo de los huéspedes.
Otra forma recientemente aplicada de tratamiento térmico consiste en el llamado tratamiento hidrotermal. Al respecto se están realizando trabajos con superficies de titanio tratadas con agua a altas temperaturas con H3 PO4 como tratamiento para las superficies, observandose los resultados al SEM, difractometría de RX , perfilometrías etc, para posteriormente impantarlas en la tibia de conejo observandose como pasadas 6 semanas, se produce una cristalización del ión fosfato junto con una oxidación del implante en sus capas externas superficiales , formando Ti2O- PO4 – 2H2O2, por lo que ganan estabilidad y humectabilidad (12)
Materiales para implantes
A) Implantes metálicos
Desde que las primeras investigaciones demostraron y aceptaron que el titanio y sus aleaciones pueden considerarse como el material estrella de los implantes actuales gracias a sus propiedades físicas, químicas, biológicas y biomecánicas, ya ampliamente demostradas de forma que dichas propiedades favorecen los procesos de fabricación industrial y de diseño. Siendo este último un factor importante para conseguir buenas formas geométricas que permitan una mejor integración en el hueso y para lograr la optimización de sus propiedades, aunque no existe un diseño único, la gran variedad de formas, terminaciones, combinaciones de estilos y dimensiones en cuanto a calibres y longitudes ayudan a que se puedan adaptar a los múltiples y variados casos en cuanto la morfología microestructural de los diferentes tipos de tejidos óseos de los receptores.
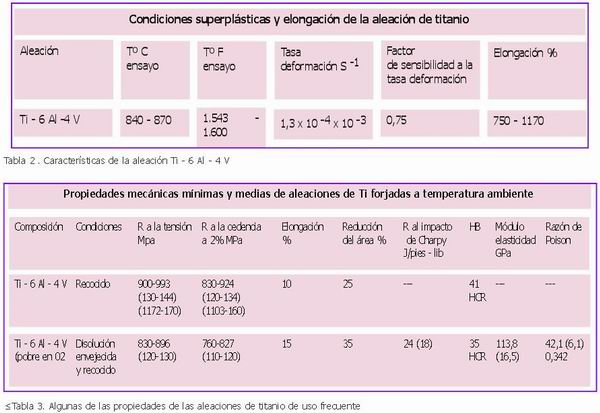
La aleación Ti – 6 Al – 4 V, la Ti 6 – 4 es la aleación de uso más extendida pues constituye alrededor del 50 % del titanio que produce el mundo. Siendo su mayor consumo el de la industria aeroespacial (80%) y alrededor del 3% del mercado es para la confección de prótesis (sector sanitario). También se utiliza para reducir el espesor del equipo automovilístico y marino de alto rendimiento. Su calidad ELI indica que la aleación lleva poco oxígeno y hierro, lo que le hace ser resistente a los daños, en especial a temperaturas criogénicas, si se le añade Pd se consigue una mejor resistencia a la corrosión. Se presenta en forma de productos moldeados, forjados y sinterizados, con diferentes usos industriales; resiste también a los diferentes ambientes naturales y a un buen número de sustancias químicas acuosas, al menos hasta temperaturas de ebullición. Es resistente a la corrosión en general por agua de mar y salmuera, ácidos oxidantes, soluciones acuosas de cloruros, cloro gaseoso húmedo e hipoclorito de sodio a las temperaturas de operación habituales. Sin embargo es vulnerable a los ácidos reductores como los ácidos fluorhídricos, clorhídrico, sulfúrico, oxálico, fórmico y fosfórico (13) (Tablas 1 – 4)
 |
 |
 |
B) Implantes de cerámicas y/o recubiertos de porcelana
Hay diversos materiales sintéticos y biológicos que se han usado para el tratamiento de defectos óseos, aumento de la cresta ósea y lesiones osteoporóticas, y también se utilizan para recubrir implantes metálicos con el fin de reproducir una superficie iónica de porcelana que es hidrófila y estable termodinámicamente, lo que facilita la reinserción al tejido y al hueso y mejora la resistencia mecánica.
Estas porcelanas pueden añadirse pulverizadas o mediante spray plasmático sobre el implante metálico con el fin de producir una superficie bioactiva (materiales inorgánicos que pueda estimular la adhesión y la unión al hueso, ) sin embargo son materiales frágiles y tienen un alto módulo de elasticidad y baja resistencia a la tracción. Estos implantes resisten poco las fuerzas de tracción (cargas oclusales) pero más las compresivas.
Se ha utilizado el Oxido de Aluminio (Al2 O3, alúmina) como patrón de referencia para los implantes de cerámica por ser inerte, y no liberar iones, ni dar reacciones inmunes in vivo, también se ha empleado la Zirconía ( ZrO2) (14-16) es de similar comportamiento, pero la alúmina presenta mayor humectabilidad, no son bioactivos ya que no estimulan, tienen alta resistencia mecánica, rigidez y dureza y son bien tolerados por el organismo aunque no producen formación de tejido óseo (bioinertes).
Entre los materiales de origen sintético, los de mayor éxito son los fosfatos de calcio para el injerto y aumento del hueso ya que el hueso vivo presenta de un 60-70 % de fosfato cálcico, no son materiales inmunogénicos y son biocompatibles con los tejidos del huésped. Los más utilizados son hidroxiapatita (HA) o Ca 10 (PO4) 6 (OH)2 y el fosfato tricálcico (FTC) o Ca 3 (PO4) 2. Se usan como materiales para injertos de hueso (en forma granular o en bloque, siendo materiales menos densos y con poros. Los macroporosos (de mas de 250 nn) derivan del hueso bovino y de hueso humano liofilizado, y los de microporosos derivan del coral (de 5 a 200 nn). Hoy día se está experimentando con superficies tratadas con coral (esqueletos de invertebrados marinos porosos) y se está abriendo un nuevo campo para la investigación (17) ya que están formados por frágiles y finos cristales que forman espacios entre ellos y entre los cuales puede crecer e introducirse las células y desarrollarse, por lo que sirven como sustrato para la formación de nuevo hueso estimulando y realizando una unión directa entre el implante y los tejidos duros, por lo que clasifican como materiales bioactivos.
La biointegración es la aceptación favorable de un cuerpo extraño por los tejidos vivos, la HA y el FTC y otros fosfatos cálcicos son biocompatibles y liberan iones cálcicos y de fosfato a los tejidos, pero la fuerza de inserción de los fosfatos cálcicos está muy por debajo de las de la alúmina y las de zirconía. El FTC se absorbe más rápido que la HA (biorreabsorbibles y biodegradables), dando como resultado un deterioro del material que es sustituido por células mesenquimatosas que son de características similares a las células osteoprogenitoras, ya que a las 4 semanas del implante los osteocitos se acumulan junto a las gránulos de HA lo que indica posibilidad de osteogénesis al utilizar estos implantes, es decir, favorecen una integración gradual.
Los recubrimientos de fosfato de calcio sobre los implantes metálicos se relacionan con la cristalinidad, cuanto más cristalino es el recubrimiento de HA más resistente será a la disolución clínica, un mínimo de 50 % de HA cristalina se considera óptimo para el recubrimiento, hoy día hay recubrimientos desde 85% de HA cristalina y un 15% de FTC hasta un 97% de HA. La disolución del recubrimiento cerámico se da a una tasa mayor cuando se trata de una estructura de HA más amorfa, y se ha demostrado que el tratamiento térmico tras el proceso de deposición, mejora la cristalinidad de la HA.
Hay estudios que dicen que se favorece la adaptación (integración entre hueso e implante) de los cerámicos al hueso más rápido que los metálicos de titanio (de 7 a 3 meses) y otros que dicen que a los 6 meses se igualan (Gottlander y Albereksson, 1992).
Hay experimentación reciente al respecto sobre epífisis de conejos, donde se comparan implantes recubiertos de calcio-fosfato bifásico, con superficies de cerámica y con otras de fosfato octocálcico, con otras de arenado y grabados con ácidos para ver el grado de osteointegración de 2 a 8 semanas, demostrándose que las tratadas con fosfato y calcio presentan similares integraciones que las superficies tratadas con arenado y grabado ácido (18).
Los biovidrios (SiO2 – CaO – Na2O – P2O5 – MgO) constituyen otra forma de cerámicas bioactivas, se sabe que forman una capa de HA carbonatada in vivo, comenzando por la migración del calcio, fosfato, sílice e iones de sodio al tejido; como resultado de las variaciones de pH, se forma una capa de gel rica en sílice sobre la superficie a medida que se liberan y se pierden los elementos. La pérdida de sílice da inicio a la migración de iones de calcio y fosfato hacia la capa de gel de sílice. Desde la superficie del biovidrio como desde los fluidos tisulares, formándose una capa calcio-fósforo que estimula la producción de osteoblastos, produciendo fibrillas de colágeno, que se suman a la capa y que más tarde son fijadas por los cristales de calcio-fósforo, siendo de un espesor de 100 a 200 micrones, formándose de este modo una interfase muy fuerte entre el biovidrio y el hueso (capaces de soportar carga). Son por tanto materiales bioactivos, ya que estimulan la formación del hueso y se usan mucho para injertos, elevación de cresta ósea o defectos más que para el recubrimiento de implantes ya que la unión es débil entre los biovidrios y el metal u otros sustratos cerámicos, son también muy frágiles, por lo que son inapropiados para aguantar todas las tensiones (18).
C) Implantes de polímeros
Se han utilizado desde resinas compuestas y combinadas (composites) para fabricar implantes pero sin éxito, aunque sí servían para la regeneración titular guiada, membranas fijadas al hueso para la regeneración ósea, el colágeno de fácil manipulación, conformado, hemostático y semipermeable y con quimiotaxis celular, los ácidos poliacrílicos y poliglicólicos para la elaboración de membranas no reabsorbibles, hoy día usamos las de teflón (politetrafluoroetileno) PTFE y ahora de teflón expandido (EPTFE) o las de teflón reforzadas con titanio que ayudan a regenerar el hueso donde más tarde se puede colocar un implante.
Pero sus inicios como materiales para la elaboración de implantes con algún resultado fueron realizados hacia la decaída de los 30 (polimetilmetacrilato, politetrafluoroetileno), presentando baja resistencia mecánica, posibilidades de fracturas debido a su bajo módulo de elasticidad, y por otro lado por su composición, los cambios de temperatura o de ambiente le afectaban en cuanto a sus propiedades físicas. Su esterilización se puede realizar mediante rayos gamma o con óxido etilénico y por su tendencia electrostática atraen fácilmente impurezas y contaminación. En la década de los 40 se usó el metil metacrilato como implante provisional para ser posteriormente sustituido por otro metálico. En la actualidad los materiales poliméricos se usan como componentes de los implantes, y pueden a su vez ser recubiertos con plasma de Ti o con HA, llevando a veces un elemento móvil interno de polioximetileno con función biomecánica (para la absorción interna de impactos, liberar tensiones y dar cierta capacidad de movimientos, reducir cargas oclusales, etc.)
D) Otros materiales para implantes
Son el carbono y sus compuestos (C y SiC) aparecen en la década de los 60. El llamado carbono vítreo provoca escasa respuesta en los tejidos del huésped, siendo por esto un material muy biocompatible, con un módulo de elasticidad equivalente al de la dentina y al hueso, con una interfase parecida a la de la HA, por lo que su deformación es muy parecida a estos tejidos, permitiendo una transmisión adecuada de tensiones. Debido a la fragilidad del C, este es susceptible de fracturarse bajo fuerzas de tracción que se generan como componente de tensiones de flexión, presentando una resistencia a la compresión relativamente baja, por lo que se requiere una gran extensión de superficie y geometría correcta del implante para resistir esa fractura, se usan para recubrimiento de implantes cerámicos y metálicos
En resumen
Actualmente la ciencia se encamina con grandes pasos al estudio exhaustivo de las superficies de los implantes y a la nueva tecnología de fabricación. No sólo se pone el énfasis a nivel ultraestructural y a los micrones tratados de ese implante en cuanto al espesor de la rugosidad o la retención en profundidad, sino que nos apoyamos en los estudios a nivel de nanotecnología y las reacciones a nivel atómico e incluso iónico. También se analiza la nanotopografía de la interfase de la osteointegración, a nivel celular como respuesta del huésped al implante, como clave de todo el proceso.
Bibliografía
1. Macchi RL. Materiales Dentales. Ed. Médica Panamericana 4.ª ed. Buenos Aires, 2007. Cap. 35. Implantología, 391-397.
2. Phillips Anusavice. Ciencia de los Materiales Dentales. 11.ª ed. Elservier España, S.A. Madrid, 2004. Cap. 23, pp. 759-781.
3. Gil FJ. Superficies de implantes dentales. Atlas Práctico de Implantología Oral. Gaceta Dental, 2004, 152, 11-20.
4. Sul YT ,Byron E, Wennerberg A. Surface characteristics of electrochemical oxidized implants and acid etched implants: surface chemistry, morphology, pore configurations, oxide thickness crystal structure, and roughness. Int J Oral Maxillofac Implants 2008. Jul-Aug 23 (4): 631-640.
5. Kang BS, Sul YT, Oh SJ, Lee HJ, Albrektsson T. XPS, AES and SEM análisis of recent dental implants. Acta Biomater 2009, Feb 7.
6. Jung UW, Choi JY, Kim CS, Cho KS, Chai JK, Kim CK, Choi SH. Evaluation of mandibular posterior singlr implants with two differents surfaces: a 5 year comparative study. J periodontal 2008, Oct 79 (10): 1857-1863.
7. Aita H, Hori N, Takeuchi M, Suzuki T, Yamada M, Anpo M, Ogada T. The effect of uñltraviolet functionalization of titunium on integration with bone. Biomaterials 2009. Feb 30 (6 ): 1015-1025.
8. Nagassa ME, Daw AE, Rowe WG, Carlev A, Thomas DW, Moselev R. Optimisatioin of the hydrogen peroxide pre-treatment of titanium: surface characterisation and protein adsorption. Clin Oral Implants Res 2008 Dec 19 (12): 1317-1326.
9. Stanford CM. Surface modifications of dental implants. Aust Dent J 2008, Jun 53, Suppl 1: 526-533.
10. Mendonca G, Mendonca DB, Araqao FJ, Cooper LF. Advancing dental implants surface technology from mícron to nanotopography. Biomaterials, 2008, Oct 29 (28): 3822-3835.
11. Wang O, Zhang Y, Zhang S, Zhan DS, Hu JL. Laser surface modification of medical titanium. Hua Xi Kou Qiannnnng Yi Xue Za Zhi 2008, Jun 26 (3): 324-326.
12. Park JW, Jang JH, Lee CS, Hawawa T. Osteoconductivity of hydrophilic microestructured titaniun implants with phosphate ion chemistry. Acta Biomater 2009, Feb 27.
13. Mangonon PL. Ciencia de Materiales: Selección y Diseño. Ed. Pearson Educación. México 2001.
14. Jeger R, Lichtenfeld Y, Peretz H, Shany B, Vago R, Baranes D. Visualizacion of the ultrastructural interface of cells with the outer and inner surface of coral skeletons. J Electron Micros 2009. Apr 58 (2): 47-53.
15. Oliva J, Oliva X, Oliva JD. Ovoid zirconia implants: anatomic for premolar replacement. Int J periodontics Restorative Dent 2008, Dec 28 (6): 609-715.
16. Coelho PG, Granjero JM, Romanos GE, Suzuky M, Silva NB, Cardaropoli G, Thompson VP, Lemons JE. Basic research methods and current trends of dental implants surfaces. J Biomed Mater Res B Appl Biomater 2009, Feb 8 (2): 579-596.
17. Carmagnole D, Abati S, Celestino S, Chiapasco M, Bosshardt D, Lang NP.. Oral implants placed in bone defects treated with Bio-Oss, Ostim-Paste, or Perioglass: an experimental study in the rabbit tibiae. Clin Oral Implants Res 2008, Dec 19 (12): 1246-1253.
18. Le Guehennec L, Goyenvalle E, Lopez-Heredia MA, Weis P, Amourig Y, Layrolle P. Histomorphometric analysis of the osseointegration of four different implants surfaces in the femoral epiphyses of rabbits. Clin Oral Impants Res 2008, Nov 19 (11): 1103-1110.





