Dr. Eduard Molina Mascaró. Médico Odontólogo, Especialista en Cirugía Maxilofacial. Práctica privada en el Instituto Dexeus / Dra. Esther Bellafont Santias Médico Odontólogo, Especialista en Geriatría. Práctica privada en Vic / Dr. Miguel Velilla Bellafont. Odontólogo. Práctica privada en Vic
Resumen
Objetivos
Comprobar la utilidad del hueso de donante, como injerto en bloque en las insuficiencias maxilares.
Diseño
Estudio de 5 casos tratados con injerto en bloque de hueso de banco, asociados a elevación sinusal o no. Pacientes de ambos sexos entre 40 y 70 años.
Resultados
Tras 4 meses de la intervención todos los pacientes incluidos en la estadística presentan un resultado muy favorable y en ninguno de los casos se ha observado reabsorción del injerto al año de evolución, ya una vez cargada la restauración protésica.
Conclusiones
En aquellos pacientes en que sea imprescindible la utilización de un injerto de hueso en bloque, parece claro que la utilización de hueso de donante es viable y mucho menos traumática que la intervención utilizando hueso autógeno.
En ambos casos utilizamos nosotros el concentrado medular como aporte de células madre y el PRP como vehículo.
Palabras clave
Hueso de banco, hueso autólogo, osteoinducción, osteoconducción, médula ósea, injerto en bloque, osteosíntesis.
Summary
Aims (Lenses)
To verify the usefulness of the donor"s bone as graft in block in the maxillary insufficiencies.
Design
Study of 5 cases treated with graft in block of bone of bank, associated with elevation sinusal or not. Patients of both sexes between 40 and 70 years.
Results
After 4 months of the intervention all the patients included in the statistics present a very favorable result and in none of the cases reabsorption of the graft has been observed to the year of evolution, already once loaded the restoration protésica.
Conclusions
In those patients in whom the utilization is indispensable a graft of bone in block, it seems to be clear that the utilization of donor"s bone is viable and great less traumatic than the intervention using bone autógeno.
In both cases we use the fundamental concentrate as contribution of cells mother and the PRP as vehicle.
Key words
Bone of bank, bone autólogo, osteoinducción, osteoconducción, bony(osseous) marrow, I graft in block, osteosíntesis.
Introducción
No obstante los logros alcanzados con las distintas disciplinas de la regeneración tisular guiada, sea con los materiales y métodos clásicos, o con otros más avanzados como la utilización del PRP (1) y más modernamente la incorporación a nuestro arsenal terapéutico de las células madre adultas, bien obtenidas del lipoaspirado, aislamiento y cultivo de mesenquimales, o mediante concentrado medular (2), nos enfrentamos a casos de déficit óseo maxilar extremo, que no podemos resolver sin recurrir a técnicas más agresivas, me estoy refiriendo a la utilización de hueso autólogo en bloque, tanto inlay como onlay dependiendo de la necesidades de cada caso (3).
En estas ocasiones son varias las dificultades con las que ha de enfrentarse el profesional.
La primera dificultad que entraña este tipo de tratamientos y que es común a todos nuestros trabajos, consiste en estar totalmente seguros de la necesidad y viabilidad del tratamiento y, fundamental en nuestra profesión, el trasladar de forma clara y convincente nuestras intenciones y posibles resultados al paciente.
Una vez se ha comprendido y aceptado la necesidad de una doble intervención para solucionar el problema maxilar y para obtener el material óseo necesario para conseguirlo, se le plantea al odontoestomatólogo la segunda adversidad, que no es otra que la consecución de material a injertar, y que se concreta en varios interrogantes: ¿Qué hueso es el más conveniente al caso? ¿De dónde lo obtendré? ¿Estoy capacitado para llevar a cabo la obtención?
En respuesta a la primera pregunta parece demostrado que el hueso donante de la misma procedencia embriológica que la del lecho receptor, es la opción que tiene mayor probabilidad de éxito por su menor tendencia a la reabsorción, percance naturalmente muy grave de cuyo remedio hablaremos más adelante.
En la respuesta a la primera pregunta está obviamente la solución a la segunda cuestión que nos planteamos, si el material idóneo es el del mismo origen embriológico, el área donante podrá ser el macizo craneal y los maxilares, que son zonas relativamente accesibles para el cirujano bucal.
La dificultad y el riesgo de una intervención sobre la calota craneal reduce esta zona donante al contexto de una colaboración con un especialista experimentado, que lleve a cabo el procedimiento de la obtención del injerto con la natural limitación de la cantidad de hueso que puede obtenerse sin lesionar seriamente a nuestro paciente, del que no olvidemos somos los responsables colabore quien colabore con nosotros.
Todo lo anterior prácticamente responde a la tercera pregunta, los maxilares son para el odontoestomatólogo el área donante de referencia, lo que limita la cantidad que es posible obtener tanto del mentón como del trígono o la rama ascendente. La técnica es segura y sencilla y el hueso obtenido es de buena calidad, pero como queda dicho la cantidad es limitada.
En el caso de una mayor necesidad de hueso nos vemos obligados a obtenerlo mediante la apertura de un segundo campo quirúrgico de mayor dimensión y compromiso para acceder a la cresta iliaca.
La intervención quirúrgica para la obtención del hueso a nivel iliaco es dificultosa y precisa del ingreso del paciente en una clínica hospitalaria por llevarse a cabo bajo anestesia general. La intervención ha de ser realizada por un especialista con experiencia, el hueso obtenido es de buena calidad y se consigue en la cantidad que se precisa pero el procedimiento es complejo, el precio elevado, el postoperatorio es largo y doloroso y ya no dependemos de nosotros mismos.
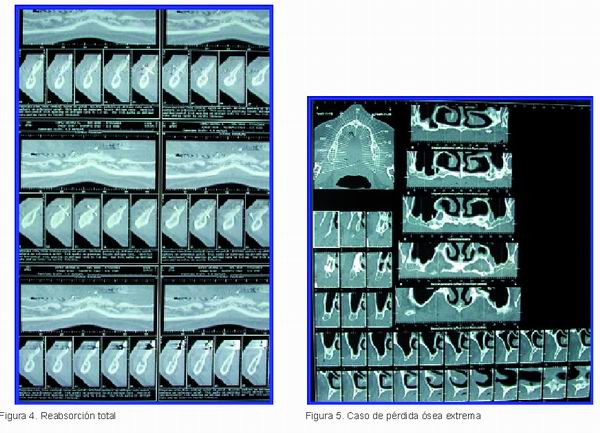
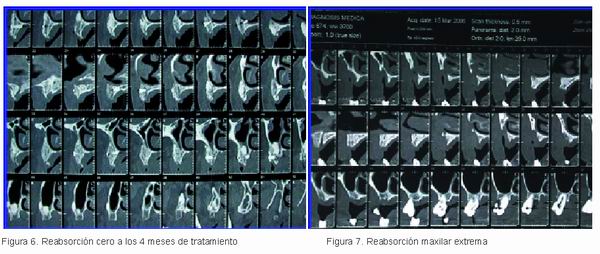
Los resultados del injerto de hueso de la cresta iliaca son estadísticamente positivos pero no totalmente predecibles ya que en el proceso de integración, por no ser del origen idóneo, el hueso puede sufrir reabsorciones que en ocasiones pueden ser totales (Figuras 1-4.) Lo que en estos casos nos deja en una situación arto delicada ante el paciente, que por consejo nuestro, ha sufrido una molesta intervención quirúrgica que no ha tenido el resultado esperado.
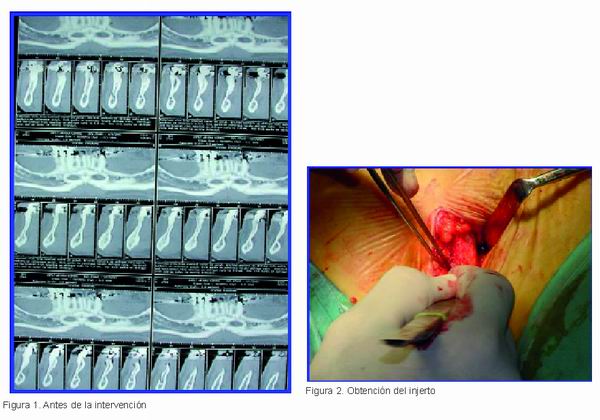 |
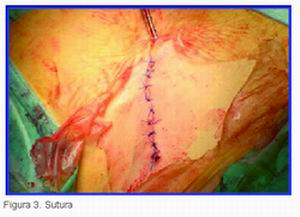 |
Dichas reabsorciones han podido ser controladas por nosotros mediante la obtención de un concentrado de médula ósea y su aplicación tanto en el lecho receptor como en el injerto (2). No obstante, aunque el resultado sea totalmente satisfactorio (Figuras 5 y 6) el procedimiento es, como queda dicho, muy traumático y esta circunstancia hace difícil la decisión de llevarlo a cabo, tanto al profesional como al paciente.
 |
 |
Solamente el hueso autólogo tiene en sí mismo todos los factores necesarios osteoconductores, osteoinductivos y osteogénicos para conseguir la incorporación o integración, esto es el proceso de interdigitación y finalmente ser sustituido por nuevo hueso. Tras el injerto, el proceso comienza de forma autóctona y en una segunda fase se produce la inducción al crecimiento del nuevo hueso, esto es el reclutamiento de las células pluripotenciales desde los tejidos del huésped, que bajo la influencia de las BMP (hormona osteogénica) migrarán hasta la zona del injerto y se diferenciarán en células osteoprogenitoras (4,5), condroblásticas y osteoblásticas que formarán un puente de unión procedente del receptor, seguido de una fase de reabsorción aposición, primero a través de los poros óseos en las zonas de contacto injerto-huésped y más tarde a través de la neovascularización. Este proceso osteoblástico y osteogénico acabará con la formación de nuevo hueso que sustituirá al injerto.
Ante estos datos se comprende que la carga celular y proteínica que llega a nuestro lecho, lo hace por dos vías: a través del injerto y por la aportación del receptor, aunque por descontado también en nuestra técnica influye la aportación de células madre y BMP del concentrado medular.
El injerto autólogo es el patrón oro, pero como hemos dicho su obtención es traumática y queda fuera del alcance técnico del odontoestomatólogo, por lo que decidimos elegir una sola de las vías de aportación de células madre adultas y proteína morfogénica, el receptor, sustituyendo como tejido de sostén osteoconductor el injerto autólogo por el hueso de banco.
Metodología
Estos injertos óseos proceden fundamentalmente de donantes fallecidos, aunque también pueden ser de donantes vivos, casi siempre en este caso cabezas femorales de sustituciones totales de la articulación.
Las condiciones fundamentales para la utilización de los injertos óseos de banco son la ausencia de riesgo de transmisión de enfermedades y la baja antigenicidad.
La seguridad absoluta de la no transmisión de enfermedad no existe, pero nos movemos sin embargo en una cifras de probabilidad de transmisión muy aceptables (la posibilidad de transmisión de enfermedades como el SIDA, por ejemplo, es de 1/1.600.000). Estas cifras se consiguen porque se ha de seguir por parte de los bancos de tejidos el Real Decreto 411/1966 publicado en el BOE el 23/03/1996 que es naturalmente de obligado cumplimiento y en él se especifican las pruebas a realizar tanto al donante como al injerto una vez obtenido y los controles de calidad y fiabilidad a que los Bancos de Tejidos españoles están sometidos.
El tejido se obtiene dentro de las 12 horas tras el paro cardiorrespiratorio, si bien este tiempo puede alargarse hasta las 24 horas en caso de que el cadáver haya comenzado a ser refrigerado en las primeras 3-4 horas tras el fallecimiento.
La obtención se hace en condiciones de quirófano, para conseguir si no un procedimiento estéril, sí al menos limpio que bastará, ya que el injerto obtenido será luego sometido a esterilización.
Una vez obtenido el injerto, pasará a sufrir un proceso de conservación, ya que si el componente mineral se conserva bien en cualquier condición no lo hace así el colágeno que se degrada rápidamente por la acción de las colagenasas, para evitar la acción de éstas el proceso indicado es la congelación hasta los -80 ºC que garantiza su conservación durante 5 años. La congelación no afecta ni altera las propiedades del injerto, no existiendo diferencias entre este hueso congelado y el fresco en cuanto a flexión, módulo de Young y tenacidad.
Sin embargo llevar el hueso hasta los -80 ºC no significa esterilización ya que hay gérmenes y virus que resisten éstas temperaturas, por lo tanto el injerto habrá de esterilizarse y se hace mediante la irradiación gamma procedente del Co60 a dosis seguras en cuanto a efectividad pero que no afectan a las propiedades mecánicas del hueso.
El injerto que a nosotros nos interesa ha de ser del tipo de hueso de banco sin criopreservación, para que no existan células viables tras la congelación, con lo que la inmunogenecidad del tejido tratado está disminuida hasta el punto de no provocar rechazo sin tratamiento inmunodepresor.
En el caso de estos aloinjertos, el proceso de incorporación es fundamentalmente el mismo que hemos descrito para el hueso autólogo, únicamente que es más lento ya que carecen de los componentes biológicos que determinan su integración, que tendrán que ser aportados únicamente por el receptor, siendo así su función, no pretendemos nada más, la de un armazón osteoconductor que reúne las condiciones mecánicas ideales que se precisan. Conseguimos pues el andamiaje sin células viables ni BMP, ambas llegarán desde el receptor cómo hemos dicho, esto conllevará un retraso al principio en la integración, pero con la llegada de las células por parte del receptor, el peligro de reabsorción es similar, aunque algo superior al que pueda sufrir el hueso antólogo, por ello en todos nuestros casos con aloinjertos la aportación tanto de células madre como de BMP se consigue, además, a partir del concentrado medular, más el efecto inductivo que provoca y que se ve reforzado por el del PRP que utilizamos como vehículo, al igual que en los casos en que empleamos hueso autólogo.
Caso clínico
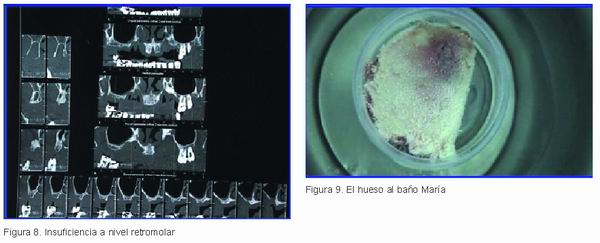
Mujer de 50 años de edad con reabsorción extrema maxilar (Figuras 7 y 8) a la que le habían propuesto la toma de injerto en bloque de cresta iliaca más una doble elevación sinusal. La paciente aceptó la elevación sinusal, pero no la intervención para el injerto en bloque, por lo que fue informada por nosotros de la posibilidad de ser receptora de un injerto procedente de un hueso de donante.
 |
Aceptada la intervención por la paciente se calculó la cantidad de hueso precisa con el estudio del TC. Una vez seguros del tamaño, se solicitó el hueso con 3 días hábiles de tiempo mediante impreso oficial que remite el propio banco.
En dicho impreso se relacionan los datos tanto del profesional como del centro hospitalario donde se hará el injerto, como del paciente, que incluirá la serología de Lues, Hepatitis y SIDA, que nos indicará su estado de salud antes del injerto, y nos evitará posibles reclamaciones.
El injerto se recibió en un doble envase que mantiene la temperatura (por medio de nieve carbónica) durante 48 horas en nevera.
Al comenzar la intervención se destapó y se puso al baño María (Figura 9), descongelándose en unos 30 minutos. Una vez descongelado, y dada la gran cantidad de hueso de que disponíamos, pudimos fragmentarlo (Figura 10) como convenía al caso, se le dio la forma que se necesitaba para adaptarlo al maxilar (Figura 11) y se injertó mediante unos tornillos de osteosíntesis (Figura 12).
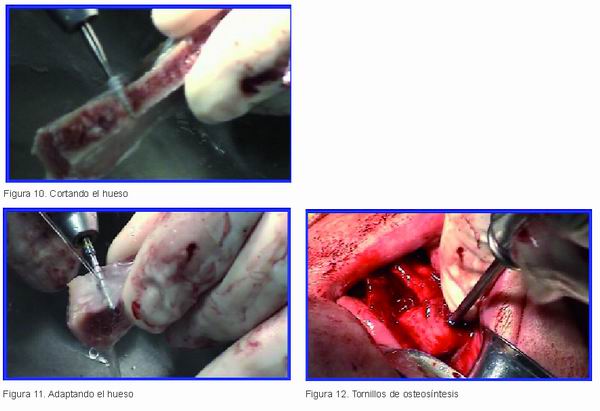 |
Nosotros lo recubrimos todo con el concentrado medular y cerramos el campo con puntos sin tensión. En la misma sesión se realizó la doble elevación sinusal utilizando el resto de concentrado medular y hueso liofilizado. Toda la intervención se realizó exactamente con la misma técnica que hubiéramos utilizado con el hueso autólogo.
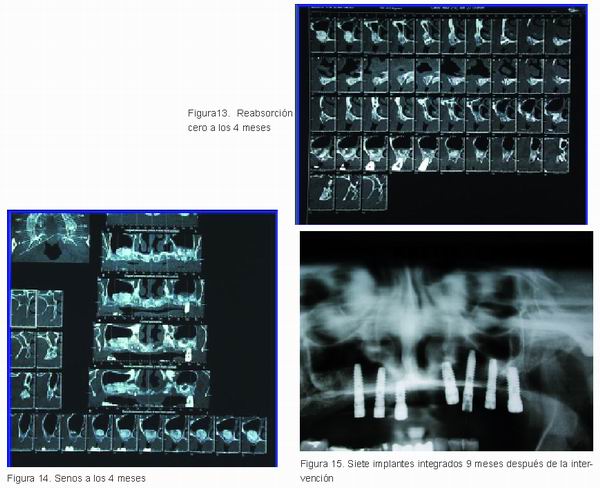
Cuatro meses tras la intervención los injertos tanto en bloque (Figura 13) como particulado para los senos (Figura 14) se habían consolidado sin reabsorción alguna lo que permitió su rehabilitación mediante implantes (Figura 15).
 |
Tenemos en este momento una estadística de 5 casos con más de un año de evolución, todos tratados con la misma técnica y con idénticos resultados (Tabla 1).
 |
Conclusiones
La técnica presentada no pretende resolver el problema de la insuficiencia maxilar que precise de injerto en bloque, porque ya podía abordarse con las técnicas anteriores, aunque de forma más traumática.
La incorporación del hueso de banco a nuestro arsenal terapéutico no hace la intervención ni más predecible ni más segura de lo que sería con el hueso autólogo, pero en muchas ocasiones la hace posible, ya que la obtención del hueso iliaco, por traumática, es rechazada por el paciente muchas veces.
Su uso no está sin embargo exento de peligros porque aunque remota existe la posibilidad de la transmisión de enfermedades, aunque estadísticamente la probabilidad de producir yatrogenia es mucho menor injertando el hueso de donante que en el proceso de obtención del hueso del propio paciente.
En éste como en cualquier otro tratamiento que presente posibilidad de efectos indeseables, y lo son casi todos los nuestros, se debe de estar seguro de que la necesidad de la intervención es absoluta para la consecución del beneficio del paciente. Una vez seguros de ello nos parece una técnica de elección que está, tanto el hueso de banco como la obtención de la médula, al alcance de cualquier profesional de la odontología, tanto técnica como legalmente.
Agradecimientos
A la señorita Mayra Benzal Montes, auxiliar y mecanógrafa ocasional.
Correspondencia
miguelvelilla@telefonica.net
Bibliografía
1. Anitua Aldecoa. Un nuevo enfoque en la regeneración ósea. Plasma rico en factores de crecimiento.
Puesta al dia publicaciones S.L. Vitoria Spain, 2000, pp. 83-145.
2. M. Velilla, E. Molina y Col. Células madres adultas: aplicación al campo de la R.T.G. Gaceta Dental ,173, septiembre. Madrid, 2006, pp. 76-95.
3. Lew, Marino AA. A comparative study of otesointegración of titanyum implants in corticocaucellons block and corticocaucellons chip grafits in canine illium. J.Oralmaxillofacial Surg 52-952,. 1994.
4. Verfaille C. Pluripotencie of mesenquimal Stem Cells derived from adult. Marro Nature. Vol. 417, June 20, 2002.
5. Prosper F. Verfaille C. Adult system Cells An sist Sanit Navarre 2003. Sep-Dec. 26(3), pp. 345-356.
Lectura recomendada
Santiago Suso Vergara. Banco de huesos Sociedad Española de Cirugía Ortopédica y Traumatología. Monografías Secod 4. Ed. Macson. Barcelona, 2002.