Actualmente la rehabilitación de tramos o arcadas edéntulas mediante el uso de implantes dentales, constituye una opción terapéutica de garantía por la alta seguridad y predicibilidad de los resultados clínicos obtenidos. Sin embargo, previamente al correcto posicionamiento del implante dental, el sitio implantológico debe ser configurado para acomodar el diámetro y longitud del implante, y en aquellos casos en los que el volumen óseo es insuficiente tanto en altura como en grosor, se hace imprescindible desarrollar localmente procedimientos reconstructivos de aumento de volumen óseo. El estudio morfológico del defecto óseo resulta crítico en la óptima selección de la técnica quirúrgica a desarrollar en cada caso. Cuanto mayor sea el tamaño del defecto óseo, más importantes van a ser las medidas ósteo-promotoras a desarrollar.
Los recursos regenerativos que podemos emplear para aumentar localmente el volumen en zonas deficitarias son; (i) la regeneración ósea guiada (ROG); (ii) los injertos óseos tanto laterales como en onlay; (iii) los injertos tipo inlay (elevación subsinusal, elevación subnasal, injertos inlay mandibulares, osteotomías Le Fort I con injertos óseos de interposición); (iv) la corticotomía expansiva; (v) la distracción ósea; (vi) y los injertos revascularizados.
Aunque se hayan empleado desde hace tiempo distintos biomateriales substitutivos de hueso en procedimientos ósteo-regenerativos, la superioridad del hueso autólogo empleado en cualquier opción terapéutica, tanto desde el punto de vista biológico como inmunológico, queda constantemente patente. Muchas han sido las zonas donantes descritas en la literatura, como por ejemplo, hueso parietal, tibia, cresta iliaca, tuberosidad maxilar, hueso palatal, torus lingual y palatino, arco cigomático, cresta oblicua externa, rama ascendente mandibular y sínfisis mentoniana. Sin embargo, aunque se hayan empleado de un modo extenso y exitoso, existen referentes que reportan resultados significativamente desfavorables atribuibles a la impredecible reabsorción existente después de la consolidación del injerto óseo, lo que condiciona la estabilidad de los tejidos periimplantarios después de la colocación de implantes y posterior carga protésica.
Desde un punto de vista fisiopatológico, el éxito de cualquier injerto óseo viene directamente definido por la calidad y la intensidad de la revascularización. Cuanto más rápida sea, más satisfactoria resulta la regeneración y más garantizada la supervivencia del injerto óseo. El uso de injertos de hueso autólogo conlleva una más rápida regeneración en las fases iniciales del proceso regenerativo y un mayor grado de maduración ósea en todas las fases de la regeneración. Con el transplante de hueso autólogo, también se trasladan las células osteogénicas y las sustancias osteoinductivas a la zona a tratar, lo cual no sucede con los biomateriales substitutivos de hueso. Sin embargo, los osteoblastos y osteocitos albergados en el seno del injerto óseo únicamente pueden sobrevivir durante poco más de 4 días gracias a sus reservas nutricionales y a los fluidos absorbidos por difusión del entorno, si en estos días no se instaura de forma temprana una red vascular que garantice la viabilidad del tejido injertado, las células óseas mueren y el injerto se reabsorbe. Aunque el autoinjerto óseo es considerado el estándar de oro de los materiales de injerto óseo empleados en procedimientos de regeneración ósea, debido a sus propiedades osteogénicas, osteoinductoras y osteoconductoras, no puede predecirse la reabsorción que van a sufrir. El principal motivo es que debido a que una gran proporción de los injertos corticales contiene un alto número de osteocitos muertos, especialmente los procedentes de zonas mandibulares, dichos injertos óseos mandibulares, principalmente compuestos de hueso cortical con un bajo porcentaje de hueso medular, ofrecen una mayor resistencia a la revascularización y consecuentemente presentan un menor potencial óseo regenerativo, por lo que se reabsorben con mayor facilidad lo cual se traduce en unas tasas de reabsorción que pueden llegar oscilar entre el 30% y el 60%, si estos no se protegen adecuadamente. La protección biológica y biomecánica de dichos injertos autólogos se lleva a cabo mediante la combinación del efecto oclusivo de las membranas regenerativas y la estratificación del injerto en dos capas de diferente comportamiento celular.
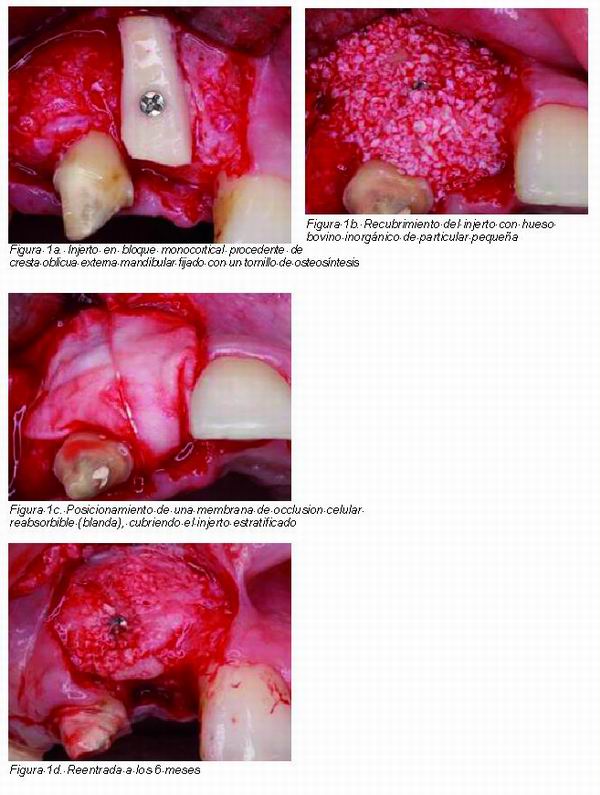 |
Por un lado, la membrana excluye células de tejido blando no deseado, evita la exfoliación del injerto y mejora la estabilidad de la herida para promover una cicatrización sin compliaciones.
Por otro lado, la literatura expone como en procedimientos de aumento de reborde con el uso de partículas de hueso bovino inorgánico aplicados por encima de la superficie del injerto resulta en una mejora del control de la tasa de reabsorción, de modo que en aquellos bloques autógenos no recubiertos por partículas de hueso bovino inorgánico se obtiene una tasa de reabsorción media del 18,3%, frente a una tasa de reabsorción del 9,3% en los bloques autólogos sí recubiertos.
En base a la literatura y a la experiencia clínica se aconseja la estratificación del injerto óseo en dos capas interna y externa. La capa interna compuesta íntegramente de hueso autólogo, es fuente de células osteogénicas viables para regenerar el defecto. La gran proximidad entre el hueso huésped y el autoinjerto (ya sea en bloque o particulado) permite la creación de un óptimo soporte vascular para la migración y proliferación de células osteogénicas, así como el reemplazo posterior del material de injerto por hueso de nueva formación. La capa externa del injerto óseo, formado por una delgada capa de 1-2 mm de hidroxiapatita, proporciona, gracias a su efecto espaciador, la preservación del espacio creado durante el proceso de cicatrización y gracias a sus propiedades osteoconductoras y debido a su nula tasa reabsortiva, no únicamente preserva el substrato óseo subyacente, sino que a la vez ayuda a definir un perfil morfológico alveolar estable en el tiempo. Las áreas injertadas en base al principio de la estratificación del injerto óseo, deben cubrirse con una barrera de oclusión celular, para evitar la entrada de células de tejido blando en la herida (Figuras. 1 y 2).
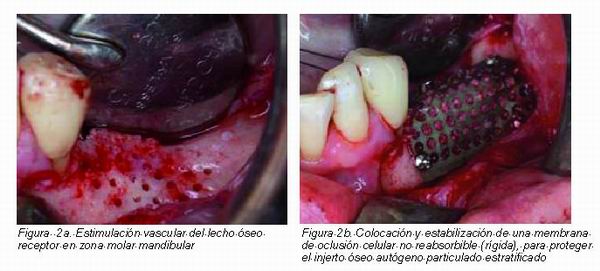 |
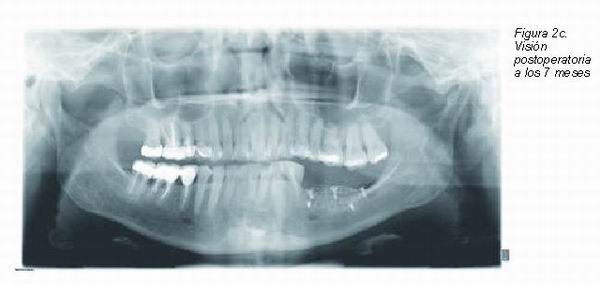 |
El uso de injertos óseos estratificados diseñados como mantenedores de espacio en combinación con membranas tanto irreabsorbibles o como reabsorbibles, puede no únicamente disminuir significativamente la tasa de reabsorción de los injertos óseos, sino que también resulta en una integración completa del injerto óseo en relación al nuevo hueso trabecular formado en el lecho receptor. El empleo de membranas reabsorbibles o no reabsorbibles tiene que estar sujeta no a la posible minimización de las complicaciones postoperatorias derivadas de una pérdida del cierre primario de la herida quirúrgica. Debería selecionarse el tipo de membrana de oclusión celular en función del grado de resistencia al colapso que puede esta ofrecer frente a la fuerza de colapso generada por las inserciones musculares, fuerza masticatoria de compresión, laceraciones accidentales, debido a que independientemente del comportamiento biomecánico propia de toda membrana, ya sea reabsorbible o no reabsorbible (deberían identificarse como membranas blandas o duras), el éxito únicamente es posible si se obtiene y preserva el cierre primario de la herida quirúrgica. De este modo siempre que empleemos un injerto autólogo en bloque, este debería ser cubierto mediante una delgada capa de hidroxiapatita y todo ello recubierto con una membrana de oclusión celular blanda, es decir, compatible con las habituales membranas reabsorbibles. Por otro lado, el empleo de hueso autólogo particulado obliga en procedimientos de aumento transversal y vertical, no únicamente a estratificar con hidroxiapatita, sino a que este quede estable e íntegramente protegido mediante membranas de oclusión celular rígidas, lo cual habitualmente supone el uso de membranas de titanio o bien que llevan una estructura de refuerzo de titanio.
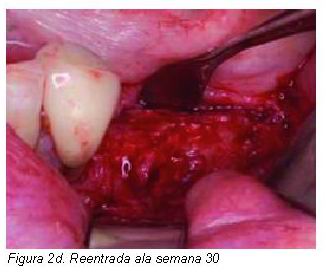 |
Conclusión
El uso de membranas reabsorbibles se asocia a un menor índice de complicaciones en comparación a los procedimientos de aumento óseo en los que se emplean membranas no reabsorbibles reforzadas con titanio, sin embargo la falta de soporte estructural de las membranas reabsorbibles conlleva como consecuencia de la presión gingival y muscular ejercida durante la función, a un colapso parcial del espacio regenerativo subyacente tanto en defectos verticales como horizontales, lo cual obliga a sobrerregenerar cuando empleamos dichas membranas. El uso de membranas de reforzadas con titanio se asocia a la obtención de unos resultados clínicos más predecibles y estables dimensionalmente, caracterizados por una reabsorción ósea significativamente menor, y a la obtención de un tejido óseo neoformado de gran calidad.
Correspondencia
Dr. Marc Rocamora: C/Martí i Julià, 6-8 bajos.
08034 Barcelona
Bibliografía
1. Albrektsson T., Zarb G., Worthington P.M.D. y Eriksson A.R. The long term efficacy of currently used dental implants: a review and proponed criteria of success. Internacional Journal of Oral & Maxillofacial Implants I, 1986; 11-25.
2. Adell R., Eriksson B., Lekholm U., Bränemark P.I., Jemt T. A long-term follow-up study of osseointegrated implants in the treatment of totally edéntulos jaws. Internacional Journal of Oral & Maxillofacial Implants 5, 1990; 347-359.
3. Adell R., Lekholm U., Gröndahl K., Bränemark P.I., Lindström J., Jacobsson M. Reconstruction of severly resorbed edentulous maxillae using osseointegrated fixtures in immediate autogenous bone grafts. International Journal of Oral & Maxillofacial Implants 5, 1990; 233-246.
4. Belser U.C., Mericske-Stern R., Bernard J.P., Taylor T.D. Prosthetic management of the partially dentate patient with fixed implant restorations. Clinical Oral Implant Research. 11, 2000, (Suppl.); 126-145.
5. Buser D, Dula K, Belser UC, Hirt HP, Berhold H. Localized ridge augmentation using guided bone regeneration. II. Surgical procedure in the mandible. Int J Periodontics Restorative Dent 15, 1995;11-29.
6. Buser D., Martin W., Belser U.C. Optimizing sthetics for implant retorations in the anterior maxilla: anatomic and surgical considerations. International Journal & Maxillofacial Implants. 19, 2004 (Suppl.); 855-860.
7. Buser D., von Arx T. Surgical Procedures in partially edentulous patients with ITI implants. Clinical Oral Implants Research. 11, 2000 (Suppl.); 83-100.
8. Chen N.T., Glowacki J., Bucky L.P., Hong H.J., Kim W.K., Yaumchuk M.J. The role of vascularization and resorption on endurance of craniofacial onlay bone grafts in the rabbit. Plastic and Reconstructive Surgery 93, 1994;714-722.
9. Chiapasco M., Zaniboni M., Boisco M. Augmentation procedures for the rehabilitation of deficient edentulous ridges with oral implants. Clin. Oral Impl. Res. 17 (Suppl. 2), 2006;136-159.
10. Chiapasco M., Abati S., Romeo E., Vogel G. Clinical outcom of autogenous bone blocks or guided bone regeneration with e-PTFE membranas for the reconstruction of narrow edentulous ridges. Clinical Oral Implants Research 20, 1999; 278-288.
11. Chiapasco M., Romeo E., Casentini P., Rimondini L. Alveolar distracction osteogenesis vs. Vertical guided bone regeneration for the correction of vertically deficient edentulous ridges: a 1-3 year prospective study on humans. Clinical Oral Implants Research 15, 2004; 82-95.
12. Dahlin C., Andersson L. y Linde A. Bone augmentation at fenestrated implants by an osteopromotive membrana technique. A controlled clinical study. Clinical Oral Implants Research 2, 1991; 159-165.
13. Donos N., Kostopoulos L., Karring T. Augmentation of the mandible with GTR and onlay cortical bone grafting. An experimental study in the rat. Clinical Oral Implants Research 13, 2002; 175-184.
14. Donos N., Kostopoulos L., Karring T. Alveolar ridge augmentation by combining autogenous mandibular bone grafts and non-resorbable membranes. An experimental study in the rat. Clinical Oral Implants Research 13, 2002; 185-191.
15. Leonhardt A., Göndahl K., Bergstom C. y Lekholm U. Long-term follow-up of osseointegrated titanium implants using clinical, radiographic and microbiological parameters. Clinical Oral Implant Research 13, 2002; 127-132.
16. Lioubavina N., Kostopuolos L., Wenzel A., Karting T. Long-term stability of jaw bone tuberosities formed by "guided tissue regeneration". Clinical Oral Implants Research 10, 1999; 477-486.
17. Maiorana C, Beretta M, Salina S, Santero F. Reducción de la reabsorción del injerto de hueso autógeno mediante un recubrimiento de Bio-Oss: Estudio prospectivo. Int J Periodontics Restorative Dent 25, 2005;19-25.
18. Nishimura I, Shimizu Y, Ooya K. Effects of cortical bone perforation on experimental guided bone regeneration. Clin. Oral Impl. Res. 15, 2004;293-300.
19. Nyman S: Bone regeneration using the principle of guided tissue regeneration. J. Clin. Periodontol. 18, 1991; 494-498.
20. Proussaefs P, Lozada J, Kleinman A, Rohrer MD. The use of ramus autogenous bloc grafts for vertical alveolar ridge augmentation and implant placement: a pilot study. International Journal of Oral & Maxillofacial Implants 17, 2002;238-243.
21. Piattelli M, Favero GA, Scarano A, Orsini G, Piattelli A. Bone reactions to anorganic bovine bone (Bio-Oss) used in sinus augmentation procedures: a histologic long-term reporto f 20 cases in humans. Internacional journal of Oral & Maxillofacial Implants. 14, 1999; 835-840.
22. Rocamora M., Padrós A., Pien D., Sanchez D. Cátedra Klockner-UPC: Estudio sobre la tasa de reabsorción del tejido neo-formado mediante la aplicación del principo de ROG I laminas de titanio multiperforadas de 0,1 mm de espesor. 2007-2008.
23. Roccuzzo M, Ramieri G, Bunino M, Berrone S. Autogenous bone graft alone or associated with titanium mesh for vertical alveolar ridge augmentation: a controlled clinical trial. Clin. Oral Impl. Res.18, 2007;286-294.
24. Vermeeren J.I., Wismeijer D., van Waas, M.A. One-steep reconstruction of the severely resorbed mandible with onlay bone grafts and endosteal implants. A 5-year follow-up. International Journal of Oral and Maxillofacial Surgery 25, 1996; 112-115.
25. Von Arx T, Buser D. Horitzontal ridge augmentation using autogenous block grafos and the guided bone regeneration technique with collagen membranas: a clinical study with 42 patients. Clin. Oral Impl. Res. 17, 2006;359-366.
26. Wang H-L, Misch C, Neiva RF. Técnica <
27. Zitzmann N.U., Näf R, Schärer P.Reabsorbable versus nonreabsorbable membranas in combination with Bio-Oss for guided bone regeneration. Internacional Journal of Oral & Maxillofacial Implants.12, 1997;844-852.




