La elevación del seno maxilar es una técnica quirúrgica empleada en cirugía maxilofacial humana para regenerar el hueso atrófico en la zona posterior del maxilar. Se han empleado distintos animales como modelos experimentales en esta técnica quirúrgica para valorar la respuesta biológica de gran variedad de injertos óseos y sustitutos.
Ana Castejón. Doctora en Veterinaria, Dpto. Medicina Veterinaria Escola Universitária Vasco da Gama Coimbra (Portugal).
Pilar Llorens. Doctora en Medicina y Cirugía, Odontóloga Departamento de Medicina y Cirugía Animal Facultad de Veterinaria Universidad Complutense de Madrid.
Ulf Thams. Doctor en Medicina y Cirugía Clínica Odontológica.
Dr. Thams
Gabor Fürst. Departamento de Cirugía Oral Facultad de Odontología de Viena, Austria.
Georg Watzek. Departamento de Cirugía Oral Facultad de Odontología de Viena, Austria.
Fidel San Román. Doctor en Veterinaria. Licenciado en Medicina y Cirugía y en Odontología. Dpto. Medicina y Cirugía Animal. Facultad de Veterinaria. UCM
Madrid.
Objetivo
En este artículo pretendemos exponer claramente el método de trabajo con el cerdo minipig y las consideraciones anatómicas necesarias para emplear distintos animales como modelo experimental en la elevación del seno maxilar en implantología.
Material y métodos
Procedimos a realizar la elevación del seno maxilar derecho e izquierdo en 6 animales. En el seno maxilar izquierdo se colocó autoinjerto de cresta iliaca y un implante dental y en el seno maxilar derecho se implantó autoinjerto corticoesponjoso de cresta iliaca en fragmentos mezclado con hueso bovino deproteinizado en una proporción 1:1 y un implante dental.
Resultados
Los animales presentaban buen aspecto y no tuvieron dificultades para alimentarse durante las 12 semanas de seguimiento.
Discusión
En los últimos años el cerdo minipig ha sido uno de los animales que más se ha empleado en la elevación de seno maxilar junto con el conejo y las ovejas. El minipig presenta unas características óseas, metabólicas, comparables a las del hombre y aunque los primates son los animales que poseen una anatomía más similar al hombre, los problemas éticos y económicos dificultan que se utilicen como modelo experimental.
Conclusión
Actualmente el animal que consideramos de elección para la elevación del seno maxilar es el cerdo mini-pig.
Introducción
La elevación del seno maxilar fue descrita por primera vez por Boyne y James (1) en 1980 para solucionar la pérdida de hueso de la zona posterior del maxilar. En 1986 Tatum (2) describió esta técnica con la inserción de implantes simultáneamente. En medicina humana han sido multitud de estudios los que han descrito la pérdida de hueso maxilar como consecuencia de la pérdida de piezas dentarias (3, 4), de la atrofia progresiva de la vascularización del maxilar con la edad (5), de la neumatización del seno y del aumento de la actividad osteoclástica en la mucosa del seno maxilar (6). Según la clasificación de Lekholm y Zarb (7) (1985), el tipo de hueso característico de la parte posterior del maxilar es un hueso con corticales muy delgadas y hueso esponjoso de densidad reducida. Además se ha comprobado que la mayor incidencia de pérdidas de implantes dentales sucede en el maxilar posterior (8, 9) lo que implica que la densidad y la arquitectura del hueso son extremadamente importantes en la estabilidad de los implantes endoóseos (3). La elevación del seno maxilar consiste en aumentar el hueso verticalmente en la zona lateral del maxilar para conseguir colocar implantes dentales (10) sin reducir la distancia entre arcadas (11).
De forma experimental se ha estudiado la elevación del seno maxilar en distintas especies (conejo, perro, cabra, oveja, cerdo y primates no humanos). En este trabajo exponemos el método de trabajo con cerdo minipig y las consideraciones anatómicas necesarias para emplear otras especies animales como modelo experimental en la elevación del seno maxilar en implantología humana.
Materiales y métodos
Protocolo
[Antes de empezar la parte experimental de la investigación, el proyecto (Madrid, Spain)].
Se procedió a realizar la elevación del seno maxilar derecho e izquierdo en los 6 animales. En el seno maxilar izquierdo se colocó autoinjerto de cresta iliaca y un implante dental (Bränemark System Implant) y en el seno maxilar derecho se implantó autoinjerto corticoesponjoso de cresta iliaca en fragmentos de 1-2 mm mezclado con hueso bovino deproteinizado en una proporción 1:1 y un implante dental (Bränemark System Implant). Se realizó el seguimiento clínico durante 12 semanas y posteriormente el sacrificio de los animales para estudio radiológico e histopatológico.
Anestesia y preparación de los animales
Los animales permanecieron en ayuno de sólidos durante las 18 horas previas a la cirugía y retirándoles el agua 6 horas antes.
 |
La premedicación se realizó con sulfato de atropina (Sulfato de atropina®, Servicios Farmacéuticos de la Defensa, Córdoba, España), carazolol (Suacron®, Farmacéutica Bayer, Barcelona, España) y azaperona (Stresnil®, Esteve Farma, Barcelona, España) por vía intramuscular en el cuello en la misma jeringa. Para la inducción utilizamos una combinación intramuscular de ketamina y midazolam 20 minutos después de la premedicación. Una vez intubados endotraquealmente se mantuvo el plano anestésico adecuado con una mezcla de oxígeno, protóxido de nitrógeno e isofluorano.
Técnica quirúrgica
El abordaje para la realización de esta técnica es extraoral (12-14). Se hace una incisión en la piel en la región infraorbitaria sobre el área de proyección del seno maxilar. Se accede al hueso disecando el tejido subcutáneo y entre el ms. elevador y ms. depresor del labio superior. Se incide el seno maxilar con una fresa de bola de tungsteno, se desplaza la membrana de Schneider hacia el interior del seno con el periostotomo, tras eliminar el fragmento óseo de la pared facial del seno, para no dañarla al colocar los implantes. En posición ventrocaudal a la osteotomía hacemos el orificio para la colocación del implante. Rellenamos la cavidad formada entre la membrana y la pared del hueso con el injerto antes de insertar el implante para asegurarnos de que todo el implante está rodeado por injerto. Por último, terminamos de rellenar el seno con injerto hasta cubrir el orificio de la pared del seno y cerramos la incisión por planos, el subcutáneo con ácido poliglicólico y la piel con seda.
Postquirúrgico
Después de la cirugía se administró como antibioterapia 1,5 g de amoxicilina intramuscular (Clamoxyl®, Pfizer, Madrid, España) y 0,1 mg/kg intravenoso de butorfanol como analgésico (Torbugesic®, Laboratorios Fort Dodge, Gerona, España).
Doce semanas después de la cirugía los animales fueron sacrificados mediante tranquilización y una sobredosis de pentobarbital sódico intracardiaco.
Resultados
Los animales presentaban buen aspecto y no tuvieron dificultades para alimentarse durante las 12 semanas de seguimiento. Durante las 12 semanas de seguimiento las zonas intervenidas cicatrizaron adecuadamente sin complicaciones. En el momento del sacrificio la región infraorbitaria no presentaba inflamación ni alteración alguna.
 |
Discusión
La estructura del hueso maxilar del cerdo minipig es bastante similar a la del hombre (15). Las características estructurales del hueso, de la membrana de Schneider, el tamaño comparable al del hombre y la presencia de áreas de reabsorción ósea (14) hacen que el cerdo minipig sea considerado como modelo experimental para esta técnica en el hombre (12). Además la tasa de regeneración ósea del cerdo (1,2-1,5 mm/día) es similar a la del hombre (16).
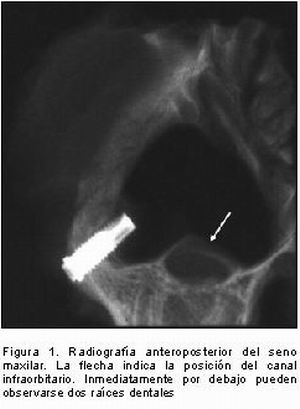
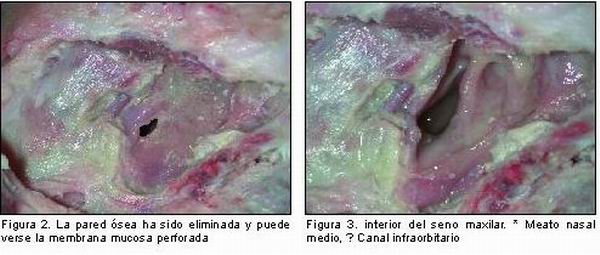
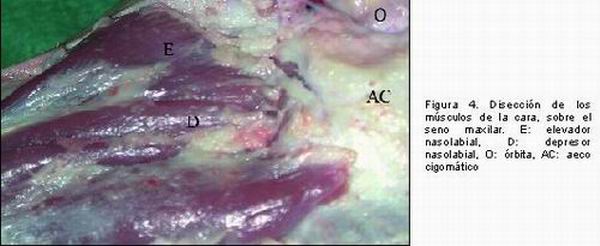
El seno maxilar en el cerdo es muy reducido, se extiende desde el orificio infraorbitario rostralmente, hasta la parte caudal del hueso zigomático. Íntimamente relacionado con este seno se encuentra el canal infraorbitario por cuyo interior van una rama del trigémino (nervio infraorbitario) y la arteria y la vena infraorbitarias. El canal infraorbitario está separado por una lámina ósea del seno maxilar y hace prominencia en éste (17) (Figura 1). El interior del seno está recubierto por una membrana mucosa, la membrana de Schneider, que es muy fina (12, 14) y se comunica con las fosas nasales a través de un orificio, el meato medio, que es relativamente ancho (17) (Figuras 2 y 3). El seno maxilar en el minipig se encuentra neumatizado como en el hombre (13). En posición dorsolateral al seno maxilar se localiza el músculo elevador del labio superior y en posición ventrolateral, el músculo depresor del labio superior (18) (Figura 4). La membrana mucosa está formada por epitelio respiratorio que varía de cuboideo o escamoso a cilíndrico ciliado pseudoestratificado delgado. Se encuentran células caliciformes y glándulas nasales en menor cantidad que en la cavidad nasal. No hay tejido eréctil. El tejido conjuntivo está formado por tejido conjuntivo laxo con fibras colágenas, reticulares y elásticas orientadas al azar, pero las más abundantes son las colágenas. Las células predominantes son los fibroblastos en un 90 por ciento. El componente más importante de la sustancia sustrato es el ácido hialurónico aunque también aparece un poco de condroitín sulfato y dermatán sulfato. Esta combinación de componentes de la matriz le confiere una calidad suave, plegable y elástica. Dada la íntima relación de la mucosa con el hueso subyacente, estas estructuras se denominan en conjunto mucoperiostio (19).
Schlegel y cols. (20) (2003) emplearon el perro en un estudio experimental realizando un abordaje intraoral para llegar al “seno”. Diversas referencias anatómicas describen la presencia de un pequeño receso de las fosas nasales hacia el hueso maxilar (21) pero no la presencia de un seno maxilar como tal. Además el proceso de neumatización que sufre de manera fisiológica el seno maxilar humano no aparece en el perro, por tanto, el pequeño tamaño del receso y la falta de neumatización en el perro impiden que este animal sea considerado un modelo experimental en la elevación del seno.
La localización del seno maxilar en la oveja y en la cabra es similar a la del cerdo. El abordaje al mismo se realiza a través de una incisión en la región infraorbitaria pero con diferencias respecto al minipig. Se expone la pared facial del seno mediante una incisión parasagital ligeramente oblicua de unos 6 cm de longitud y desinserción de 1/3 del músculo masétero (22-26).
Otro modelo experimental que se ha utilizado ha sido el conejo por su fácil manejo. Los estudios realizados han descrito el abordaje directamente sobre el hueso nasal, separando la mucosa antral y rellenando el espacio. Este animal se ha empleado para estudios de materiales y regeneración ósea sin colocación de implantes dentales. La regeneración ósea en esta especie es tres veces más rápida que en el ser humano, por lo tanto permite tiempos de estudio mucho más cortos que en el hombre y que en otras especies; sin embargo, habría que valorar más en profundidad si las condiciones de esta zona quirúrgica es similar a la del hombre.
Los primates no humanos son el mejor modelo experimental para esta técnica quirúrgica puesto que la forma y el tamaño es lo más parecido al hombre (27), el abordaje es intraoral lo que reproduce fielmente todo el proceso. Sin embargo, tanto el manejo, el elevado coste de estos animales y de las instalaciones necesarias para su mantenimiento como las dificultades ético-legales y con sociedades protectoras de animales limitan su utilización en cirugía maxilofacial.
 |
La localización extraoral de los implantes no interfiere con la masticación ni la alimentación de los animales; los implantes no están sometidos a traumatismos (mordisqueo de barrotes y de objetos duros) y es una zona más limpia que la cavidad oral. Sin embargo, esta localización fuera del plano oclusal, evita las cargas durante la masticación. Stevenson (28) dijo que el hueso y el injerto se remodelaban en función de los estímulos mecánicos a los que estaban sometidos. En implantología dental se ha demostrado que es necesaria la carga progresiva de los implantes para permitir el desarrollo y remodelado de un hueso maduro que resista el estrés (29). En la elevación del seno maxilar realizada en minipig, ovejas y cabras no puede estudiarse la formación de hueso después de la carga de los implantes porque en esta localización no es posible. Además, es de esperar que un estudio similar con una inserción de los implantes en la cresta alveolar proporcione una regeneración ósea, integración de los implantes y remodelado óseo distintos (22).
Conclusiones
De todos los modelos experimentales en la técnica de elevación de seno maxilar los más adecuados son el cerdo minipig y los primates. Sin embargo, el manejo complicado, el alto coste y los numerosos permisos necesarios para trabajar con primates deja como primera opción los cerdos minipig.
Bibliografía
1. Boyne PJ, James RA. Grafting of the maxillary sinus floor with autogenous marrow and bone. J Oral Surg 1980; 38: 613-616.
2. Tatum H. Maxillary and sinus implant reconstructions. Dent Clin North Am 1986; 30: 207-209.
3. Ulm C, Kneissel M, Schedle A, Solar P, Matejka M, Schneider B y col. Characteristic features of trabecular bone in edentulous maxillae. Clin Oral Impl Res 1999; 10: 459-467.
4. Schultze-Mosgau S, Keweloh M, Wiltfang J, Kessler P, Neukam W. Histomorphometric and densitometric changes in bone volume and structure after avascular bone grafting in the extremely atrophic maxilla. Brit J Oral Max Surg 2001; 39: 439-447.
5. Solar P, Geyerhofer U, Traxler H, Windisch A, Ulm C, Watzek G. Blood supply to the maxillary sinus relevant to sinus floor elevation procedures. Clin Oral Impl Res 1999; 10: 34-44.
6. Yildrim M, Spiekermann H, Handt S, Edelhof D. Maxillary sinus augmentation with the xenograft Bio-Oss and autogenous intraoral bone for qualitative improvement of the implant site: a histologic and histomorphometric clinical study in humans. Int J Oral Maxillofac Implants 2001; 16: 23-33.
7. Lekholm U, Zarb GA. Patient selection and preparation. En: Bränemark PI, Zarb GA, Albrektsson T, editores: Tissue integrated prostheses. Osseointegration in clinical dentistry. Chicago: Quintessence; 1985, pp. 199-209.
8. Jaffin RA, Bermann C. The excesive loss of Bränemark fixtures in type IV bone: a 5- year analysis. J Periodontol 1991; 62: 2-4.
9. Kopp CD. Oseointegración Bränemark. Pronóstico y bases terapéuticas. Clinicas Odontológicas de Norteamérica 1989; 4: 717-748.
10. Van den Bergh JPA, ten Bruggenkate CM, Disch FJM, Tuinzing DB. Anatomical aspects of sinus floor elevations. Clin Oral Impl Res 2000; 11: 256-265.
11. Raghoebar GM, Vissink A, Reintsema H, Batenburg RHK. Bone grafting of the floor of the maxillary sinus for the placement of endosseous implants. Brit J Oral Maxillof Surg 1997; 35: 119-125.
12. Fuerst G, Tangl S, Gruber R, Gahleitner A, Sanroman F, Watzek G. Bone formation following sinus grafting with autogenous bone-derived cells and bovine bone mineral in minipigs: preliminary findings. Clin Oral Impl Res 2004; 15: 733-740.
13. Fürst G, Gruber R, Tangl S, Zechner W, Haas R, Mailath G y col. Sinus grafting with autogenous platelet-rich plasma and bovine hydroxyapatite. A histomorphometric study in minipigs. Clin Oral Impl Res 2003; 14: 500-508.
14. Terheyden H, Jepsen S, Möller B, Tucker MM, Rueger DC. Sinus floor augmentation with simultaneous placement of dental implants using a combination of deproteinized bone xenografts and recombinant human osteogenic protein-1. A histometric study in miniature pigs. Clin Oral Impl Res 1999; 10: 510-521.
15. Buser H, Hoffmann B, Bernard JP, Lussi A, Mettler D, Schenk RK. Evaluation of filling materials in membrane-protected bone defects. A comparative histomorphometric study in the mandible of miniature pigs. Clin Oral Impl Res 1998; 9: 137-150.
16. Hönig JH, Merten HA. Das Göttinger Miniaturschwein (GMS) als Versuchtier in der humanmedizinnischen osteologischen Grundlagenforschung. Zeitschrift für Zahnärtliche Implantologie 1993; 2: 237-241.
17. Barone R. Anatomie comparée des mammifères domestiques. Vol. 1, Osteologie. 4.ª ed. Paris: Vigot Fueres; 1999.
18. Popesko P. Atlas de anatomía topográfica de los animales domésticos. Vol. 1. Cabeza y cuello. 2.ª ed., Barcelona: Masson, 1998
19. Banks WJ. Applied veterinary histology. 3ª ed. St. Louis: Mosby Year Book, 1993.
20. Schlegel K, Fichtner G, Schultze-Mosgau S, Wiltfang J. Histologic findings in sinus augmentation with autogenous bone chips versus a bovine bone substitute. Int J Oral Maxillofac Implants 2003; 18: 53-58.
21. Evans HE, deLahunta A. Miller´s Disección del perro. 4.ª ed. México: McGraw-Hill Interamericana, 1997.
22. Haas R, Donath K, Födinger M, Watzek G. Bovine hydroxyapatite for maxillary sinus grafting: comparative histomorphometric findings in sheep. Clin Oral Impl Res 1998; 9: 107-116.
23. Haas R, Mailath G, Dörtbudak O, Watzek G. Bovine hydroxyapatite for maxillary sinus augmentation: analysis of interfacial bond strength of dental implants using pull-out test. Clin Oral Impl Res 1998; 9: 117-122.
24. Haas R, Haidvogl D, Donath K, Watzek G. Freeze-dried homogeneous and heterogeneous bone for sinus augmentation in sheep. Part I: Histological findings. Clin Oral Impl Res 2002; 13: 396-404.
25. Haas R, Baron M, Donath K, Zechner W, Watzek G. Porous hydroxyapatite for grafting the maxillary sinus: a comparative histomorphometric study in sheep. Int J Oral Maxillof Implants 2002; 17: 337-346.
26. Jakse N, Tangl S, Gilli R, Berghold A, Lorenzoni M, Eskici A y col. Influence of PRP on autogenous sinus grafts. An experimental study on sheeps. Clin Oral Impl Res 2003; 14: 578-583.
27. McAllister BS, Margolin M, Cogan AG, Buck D, Hollinger JO, Lynch SE. Eighteen month radiographic and histologic evaluation of sinus grafting with anorganic bovine bone in the chimpanzee. Int J Oral Maxillofac Implant 1999; 14: 361-368.
28. Stevenson S. Injerto óseo. En Slatter DH, editor: Texto de cirugía de los pequeños animales. Volumen II. Barcelona: Masson, 1989, pp. 2120-2134.
29. Oh TJ, Yoon J, Misch CE, Wang HL. The causes of early implant bone loss: myth or science? J Periodontol 2002; 73: 322-333.




