Dra. Lucía Gutiérrez Sánchez. Profesora del Máster de Cirugía Bucal, Implantología y Periodoncia. Institución Universitaria Mississippi. Madrid / Dra. Sandra Martínez González. Profesora del Máster de Cirugía Bucal, Implantología y Periodoncia. Institución Universitaria Mississippi. Madrid / Dra. Cristina Barona Delgado. Profesora Asociada de Cirugía Bucal. Universidad Complutense de Madrid/ Dr. FernandoFernández- Cáliz. Profesor Colaborador de Cirugía Bucal. Universidad Complutense de Madrid.
Objetivo: Determinar las bacterias más frecuentes de la enfermedad periodontal mediante el uso de las técnicas de biología molecular más concretamente a través de la PCR.
Diseño del artículo: Se trata de un estudio multicéntrico de 33 pacientes, 20 con enfermedad periodontal agresiva cuyas profundidades de bolsas oscilan entre 10 y 4 mm y 13 con enfermedad periodontal crónica cuyas profundidades de bolsas oscilan entre los 9 y 4 mm. Ambos tipos de enfermedad presentaban una serie de síntomas.
Se rellena una ficha periodontal diseñada por nosotros y posteriormente se tomaron las muestras de PCR.
Resultados: Obtuvimos que las bacterias más frecuentes son: la Tannerella forsythensis (Tf) que se presentó en 29 de los 33 sujetos, seguida de la Prevotella intermedia (Pi) en 26 sujetos, y después la Porphyromona gingivalis (Pg) que fue observada en 25 pacientes. La Treponema denticola se presentó en 21 de los 33 pacientes, seguido del Actinobacillus actinomycetemcomitans (Aa), que se presenta en 7 pacientes, y por último la Fusobacterium nucleatum, que fue de la menor presencia, detectándolos en 5 pacientes.
Conclusión: Llegamos a la conclusión de que las bacterias más frecuentes en la enfermedad periodontal son: la Tannerella forsythensis, la Porphyroma gingivalis, la Treponema denticola y la Actinobacillus actinomycetemcomitans.
Palabras clave
PCR. Bacterias. Enfermedad periodontal.
Introducción
La periodontitis se define como “una enfermedad inflamatoria de los tejidos soporte de los dientes causada por microorganismos o grupos de microorganismos específicos que producen la destrucción progresiva del ligamento periodontal y el hueso alveolar con formación de bolsa, recesión o ambas” (1).
El World Workshop del Clinical Periodontics en 1996 describe Actinobacillus actinomycetemcomitans (Aa), Porphyromonas gingivalis (Pg) y Tannarella forsythensis (Tf) (Bacteroides forsythus) como microorganismos relevantes asociados con la enfermedad periodontal (2). Desde luego existen otras bacterias como Prevotella intermedia (Pi), Treponema denticola (Td), Fusobacterium nucleatum (Fn) o Eikenella corrodens (Ei), que han sido aceptadas también como bacterias periodontopatógenas. Son bacterias Gram (-) que necesitan requisitos anaerobios ( 3).
Moore y Moore, Haffajee y Socransky (4), en 1994, sugieren que existen diferencias entre la microflora de la enfermedad periodontal de inicio temprano y la del adulto. Los estudios realizados por Zambon y cols. (5, 6) en 1983 y 1985, otro realizado por Haffajee y cols. (7) en 1984, Slots (8) en el 90 y Savitt y cols. (9) en el 91, vieron que Aa se localizaba en aquellos pacientes con enfermedad periodontal de inicio temprano localizada (actualmente enfermedad periodontal agresiva localizada), y por otro lado también ha sido detectada en pacientes con enfermedad periodontal de inicio temprano generalizada (actualmente enfermedad periodontal agresiva generalizada) en los estudios realizados por Kamma y cols. (10), 1995; Van Winkelhoff y cols. (11), 1989; Slots y cols. (8), 1990; Rodenberg y cols. (12), en el 1990, vieron que esta bacteria también se presenta en ciertas lesiones de la enfermedad periodontal del adulto, pero con menos frecuencia y en menor número que otros microorganismos que son más prevalentes y están en mayor número.
Aunque el diagnóstico clínico y radiológico han sido durante mucho tiempo las técnicas rutinarias para plantear el manejo de los pacientes con periodontitis, la posibilidad de que los tejidos periodontales estén colonizados por bacterias de origen exógeno cambia mucho el plan de tratamiento, ya que introduce la necesidad de combinar el tratamiento mecánico con el tratamiento antibiótico, lo cual hace necesaria la incorporación de las técnicas de diagnóstico microbiológico para así saber a qué especies bacterianas vamos a enfrentarnos.
En los últimos tiempos se han desarrollado varios métodos para el diagnóstico microbiológico. Sin embargo, el objetivo perseguido por ellos puede variar en algunos casos, ya que en ocasiones se emplean exclusivamente con finalidad investigadora mientras que, en otros casos, han sido modificados y adaptados a las necesidades clínicas, entre ellos se encuentra: el cultivo bacteriano, métodos de diagnóstico inmunológico (la inmunofluorescencia directa, la inmunofluorescencia indirecta, la citometría de lujo, la aglutinación por látex y el test de E.L.I.S.A.), métodos de detección enzimática (BANA), técnicas de biología molecular.
Los principios de las técnicas de biología molecular es que se basan en el análisis del DNA o el RNA. Se aísla la cadena de DNA de una muestra de placa y se amplifica. Tras su extracción y purificación, pueden emplearse diferentes técnicas para su identificación (sondas, checkerboard DNADNA, PCR), para lo cual es necesario identificar la especie bacteriana que posee el DNA aislado.
Dentro de estas técnicas, la más importante es la PCR, que permite amplificar las cadenas de DNA. Para ello, lo primero es aislar el DNA de la muestra y posteriormente aplicarle calor para separar ambas cadenas. Tras esto, utilizando DNA polimerasa y un primer o una secuencia conocida de nucleótidos, la muestra es amplificada y posteriormente visualizada.
Pacientes y metodología
Se ha realizado un estudio multicéntrico de 33 pacientes, de edades comprendidas desde los 15 años hasta los 40 años de edad.
De esos 33 pacientes 20 presentaban enfermedad periodontal agresiva y 13 con enfermedad periodontal crónica.
Ambos tipos de enfermedad periodontal venían precedidos por una serie de síntomas, tales como gingivitis, traumatismo oclusal, halitosis e inflamación.
Las profundidades de bolsa de aquellos sujetos con enfermedad periodontal agresiva oscilaba entre un máximo de 9 mm y un mínimo de 4 mm. Así como los pacientes con enfermedad periodontal crónica cuyas profundidades de bolsa estaban entre 10 y 4 mm.
El primer paso consistió en rellenar la ficha periodontal diseñada y posteriormente se tomaron las muestras para realizar la prueba de la PCR, con el siguiente procedimiento:
1. Eliminación de la placa de la zona.
2. Secado y aislamiento de la zona con algodones para evitar la contaminación de la saliva.
3. Introducción de 5 puntas de papel estéril en aquellos dientes que tenían mayor profundidad de sondaje, presentaban supuración y/o sangrado durante 20-30 segundos y por último se guardaron en un bote estéril.
Resultados
La distribución según el sexo, en nuestro estudio fue de un 61% de mujeres frente a un 39% de hombres.
En cuanto los antecedentes clínicos los más comunes fueron el sangrado que se presentó en un 67% y la inflamación en un 24%. No existen diferencias si dividimos esta muestra por sexos, ya que siguen predominando los mismos antecedentes (Figura 1).
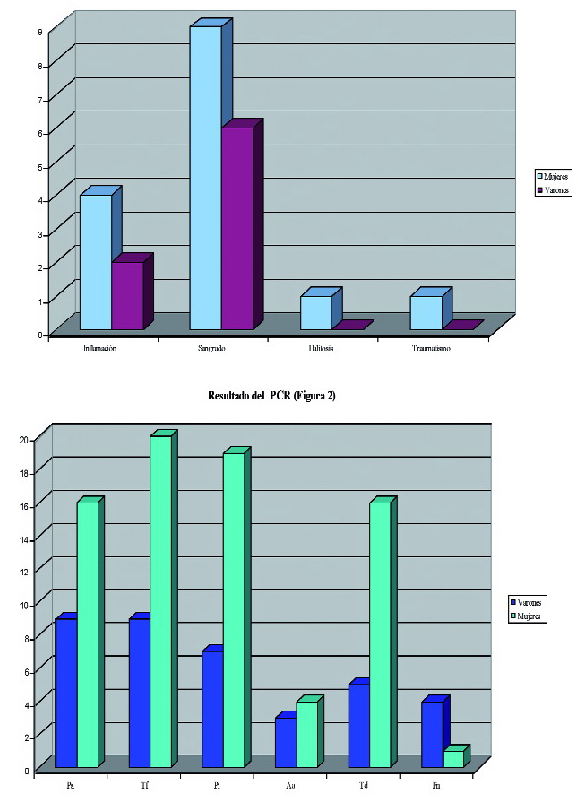 |
Una vez obtenidos los resultados de la prueba del PCR que se realizó a cada sujeto observamos que la bacteria más frecuente fue la Tannerella forsythensis (Tf) que se presentó en 29 de los 33 sujetos, seguida de la Prevotella intermedia (Pi) en 26 sujetos, y después la Porphyromona gingivalis (Pg) que fue observada en 25 pacientes.
La Treponema denticola se presentó en 21 de los 33 pacientes, seguido del Actinobacillus actinomycetemcomitans (Aa) se presenta en 7 pacientes, y por último la Fusobacterium nucleatum, que fue de la menor presencia, detectándolos en 5 pacientes.
En el análisis de correlación, en cuanto al sexo que la bacteria más frecuente en las mujeres fue la Tf seguida de la Pi. Sin embargo, en los varones la Pg y la Tf estuvieron en igual proporción mientras que la Pi se situó en valores menores.
Por último, el Aa se encontró en una proporción similar en ambos sexos (Figura 2).
Discusión
Cientos de diversas especies han sido aisladas en la cavidad bucal, pero sólo unas pocas han sido asociadas como bacterias periodontopatógenas. Entre estas, la Porphyromona gingivalis, Tannerella forsythensis (Bacteroides forshytus) y el Actinobacillus actinomycetemcomitans aunque también existen otras bacterias Gram (-) que son causantes de las periodontitis crónicas y agresivas.
Se necesita tener un método o una prueba para el diagnóstico y/o el planteamiento sobre el tratamiento, dando como resultado una mejor planificación sobre el tratamiento y proporcionando un claro beneficio para el paciente.
Existen varios métodos para enumerar el número de bacterias que hay en la placa subgingival. Entre estos métodos encontramos el cultivo bacteriano, que ha sido el método clásico por excelencia en la detección y enumeración de los microorganismos periodontopatógenos (13, 14); del microscopio inmunofluorenceste y la sonda DNA. Desafortunadamente estos métodos tienen ciertas limitaciones, como por ejemplo la falta de especificidad y una limitada sensibilidad.
Por otro lado está la PCR, que es una técnica simple que replica fragmentos de RNA o DNA y que ha venido desarrollándose tras los estudios recientes, realizados por Watanabe(15) en 1993, Lin y cols. (16) en 1995 y Meurman y cols. (17) en 1997. Es un método rápido, relativamente simple y se pueden detectar bacterias aunque estén en bajo número. Este método no requiere células vivas (18). Es un método que ofrece una alta sensibilidad y especificidad en la detección de bacterias en muestras biológicas. Se detectan entre 25 a 100 células (15, 19, 20).
Sin embargo la PCR tiene sus limitaciones, esto incluye la posibilidad de que dé unos resultados falso-positivos debidos a la contaminación. (21)
La utilización de test microbiológicos para el diagnóstico de las diferentes formas destructivas de enfermedad periodontal queda controvertida. Las limitaciones de este test, para la presencia o ausencia de Pg y Aa, el propósito de distinguir sujetos con enfermedad periodontal agresiva de sujetos con enfermedad periodontal crónica, estaba claramente expuesto en una revisión publicada recientemente por Mombelli y cols. (22) en el 2002.
A la hora de diagnosticar la enfermedad periodontal agresiva, muchas veces se nos puede pasar por alto por qué no se ha detectado el Aa que es un claro parámetro de que el sujeto presenta este tipo de enfermedad periodontal. Para realizar un correcto diagnóstico microbiológico, necesitamos una prueba con una alta especificidad y sensibilidad como es la prueba del PCR. Aunque la presencia de esta bacteria sea baja, no hay que discriminar porque su mera presencia es un claro indicador de enfermedad periodontal agresiva.
Los datos obtenidos en cuanto a los antecedentes clínicos, vemos que los más frecuentes son el sangrado en un 67% y la inflamación en un 25%. Sin embargo en el estudio realizado por Darby IB y cols. (3), en el cual compara dos grupos, unos con enfermedad periodontal agresiva y otros con enfermedad periodontal crónica donde sacó en conclusión con respecto a los antecedentes que la enfermedad periodontal agresiva presenta menor inflamación y menor sangrado pero el fluido crevicular es similar al de la enfermedad periodontal crónica.
En cuanto al resultado de la prueba del PCR donde la toma de muestras las realizamos en bolsas de 4 mm o mayores, obtuvimos que había presencia de diversas bacterias: Actinobacillus actinomycetemcomitans (Aa), Tannerella forsythensis (Tf), Prevotella intermedia (Pi), Porphyroma gingivalis (Pg), Treponema denticola (Td) y Fusobacterium nucleatum (Fn).
En los estudios realizados por Zambon y cols. (5) en 1983, Zambon(6) en 1985, Haffajee y cols. (7) en 1984 , Slots (8) y cols. 1990, Savitt y cols. (9) en 1991, Kamma y cols. (10) en 1995, Van Winkeholff y cols. (11) en 1989 sacaron como conclusión que la Aa es una bacteria típica de la enfermedad periodontal agresiva.
La Pg, aún siendo más típica de la enfermedad periodontal crónica, se ha visto que se encuentra en aquellos pacientes con enfermedad periodontal agresiva tal y como se corrobora en los estudios realizados por Kamma y cols. (10) en 1995, Sasaki y cols. (23) en 1989, Kamagata y cols. (24) en 1989 y Vandesteen y cols. (25) en 1984.
La Pi, según los estudios realizados por Vandesteen y cols. (25) en 1984, Kamma y cols. (26) en el 94, Slots y Genco (27) en 1984 y Slots y cols. (8) en 1986.
En cuanto a la Tf (antes Bf) también existe en ambos tipos de enfermedad, tal como vieron Gimur y cols. (28) en 1989, Haffajee y cols. en 1997, Kamma y cols. (10) en 1995, Kamagata (24) Lisgarten (29) en el 1995 en los estudios que realizaron.
Sin embargo, según el estudio realizado por Riviere y cols. (30) en 1992, observarón que la Td sólo se encuentra en aquellos sujetos con enfermedad periodontal crónica.
En nuestro estudio aparece en prácticamente todos los sujetos estudiados y en los diversos rangos de edad estudiados en mayor o menor proporción, aunque en los varones sólo aparece en el rango de edad comprendido entre 30-39 años.
En los estudios realizados por Darby (3) y Takeuchi y cols. (31) también vieron que existe presencia de T.d en pacientes con enfermedad periodontal agresiva.
Darby y cols. (3) en su estudio, cuya muestra es de 24 pacientes presenta los siguientes resultados: Bf en un 97,1%, Pi en un 79,2 %, P.g 62,5%, Td 45,8% y Aa 3%.
En nuestro estudio obtenemos los siguientes resultados: Tf en un 87,8%, Pi en un 75,7%, Pg en un 75,7%, Td en un 63,6%, Aa en un 21,2%, Fn en un 15,1%. Son unos resultados similares al estudio realizado por Darby (3). Kakamatsu (31) y cols. también detectaron como bacteria más frecuente la Tf y la Pg, aunque estos autores utilizaron como prueba microbiológica la sonda DNA y no tuvieron resultados en cuanto la Aa ya que esta prueba no la detecta.
Sin embargo, en el estudio realizado por Kamma y cols. (10) en 1994, el cual obtuvo los siguientes resultados: P.g en un 97,1%, B.f en un 53,4% y Aa en un 10,9%. Estos datos se obtuvieron mediante la técnica de cultivo y se recogieron las muestras en bolsas mayores de 6 mm.
En el estudio realizado por Takeuchi y cols. (30) se detectó la Pg y Td que, aunque son más típicas de la enfermedad periodontal crónica, también puede aparecer en la enfermedad periodontal agresiva.
Por otro lado, Zambon (2) sugiere que la T.f, la P.g y la A.A están íntimamente relacionadas con la patogenia de la enfermedad periodontal agresiva.
Según los datos que obtuvimos en este estudio, nos inclinamos a pensar a que las siguientes bacterias: Pg, Tf, Pi son bastantes frecuentes en aquellos pacientes con enfermedad periodontal, así que coinciden con las conclusiones de Zambon (2,5) y Yasue (30).
Bibliografía
1. Carranza F, Newman M, Takei H. Periodontología clínica. Edit Mc Graw Hill, México, 2004, 66- 97.
2. Zambon, J.J. American Academy of Periodontology Consensus repot periodontal disease. Microbial factors. Annals Periondontol 1996; 67: 879- 925.
3. Darby IB, Hodge PJ, Riggio P. Microbial comparison of smoker and non smoker adult and early-onset periodontitis patients by polymerase chain reaction. J Clin Periodont 2000; 27: 417-24.
4. Haffajee, AD y Socransky, SS. Microbial etiological agents of destructive periodontal diseases. Periodontol 2000; 5: 78-111.
5. Zambon, JJ, Slots, J, Christersson, LA. Actinobacillus actinomycetemcomitans in human periodontal disease. Prevalence in patient groups and distributions of biotypes and serotypes in familias. J Periodontol 1983; 54: 707-11.
6. Zambon, JJ. Actinobacillus actinomycetemcomitans in human periodontal disease. J Clin Periodontol 1985; 12: 1-20.
7. Haffajee, AD, Socransky, SS, Ebersole, JL, Smith, DJ. Clinical, microbiological and immunological features associated with treatment of active periodontosis lesions. J Clin Periodontol 1984; 11: 600-18.
8. Slots, J, Feik, D, Rams , TE. Actinobacillus actinomycetemcomitans and Bacteroides intermedia in human periodontitis: age relationship and mutual association. J Clin Periodontol 1990; 17: 659- 62.
9. Savitt, ED, Kent RL. Distribution of Actinobacillus actinomycetemcomitans and Porphyromona gingivalis by subject age. J Periodontol 1991; 62: 490-4.
10. Kamma, JJ, Nakau, M, Manti, FA. Predominant microflora of severe, moderate, and minimal periodontal lesions in young adults with rapidly progressive periodontitis. J Periodont Res 1995; 30: 66-72.
11. Van Winkelhoff, AJ, Rodenberg, JP, Goene, RJ, Abbas, F, Winkel, EG, dee Graaff, J. Metronidazole plus amoxycillin in the treatment Actinobacillus actinomycetemcomitans associated periodontitis. J Clin Periodontol 1989; 23: 212-9.
12. Rodenberg, JP, van Winkelhoff, AJ, Winkel, EG, Goene, RJ, Abbas, E, De Graaff, J. Ocurrente of Bacteroides gingivalis, Bacteroides intermedius and Actinobacillus actinomycetemcomitans in severe periodontitis in relation toa ge and treatment history. J Clin Periodontol 1990; 17: 392-9.
13. Greenstein, G. Microbiologic assessments to enhance periodontal diagnosis. J Periodontol 1988; 59: 508-15.
14. Lamster, IB, Celenti , RS, Jans , HH, Fine, JB, Grbic, JT. Current status of tests for periodontal disease. Adv Dent Res 1993; 7: 182-90.
15. Watanabe, K, Frommel TO. Porphyromonas gingivalis, Actinobacillus actinomycetemcomitans and Treponema denticola detection in oral plaque samples using the polymerase chain reaction. J Clin Periodontol 1996; 23: 212-9.
16. Lin, C -Y,Wong, M-Y., Jeng , J-H., Chang, W-K., Kuo, M Y- P. Rapid and specific detection of leukotoxine sequences of Actinobacillus actinomycetemcomitans from periodontal pockets by the polimerase chain reaction. J Form Med Assoc 1997; 93: 289-93.
17. Meurman, JH, Wahlfors, J, Korhonen, A, Alakuijala, P, Väisänen, P, Torkko, H, Jaén, J. Identificatio of Bacteroides forshytus in subgingival dental plaque withthe aid of a rapid PCR method. J Dent Res 1997; 76: 1376-80.
18. Morillo JM, Lau L, Sanz M. Quantitative real-time polymerase chaín reaction base don single copy gene sequence for detection of periodontal pathogens. J Clin Periodontol 2004; 31: 1054- 60.
19. Slots, J, Ashimoto, A, Flynn, MJ, Li, G, Chen, C. Detection of putative periodontal pathogensin subgingival specimen by 16S ribosomal DNA amplification with the polymerase chain reaction. Clin Infect Dis 1995; 20 (suppl 2): S304-S7.
20. Wahlfors J, Meurman, JH, Väisänen, P et al. Simultaneus detection of Actinobacillus actinomycetemcomitans and Porphyromona gingivalis by a rapid PCR method. J Dent Res 1995; 74: 1796-801.
21. Sanz M, Lau L, Herrera D. Methods of detection of Actinobacillus actinomycetemcomintans, Porphyromona gingivalis and Tannerella forsythensis in periondontal microbiology, with special emphasis on advanced molecular techniques: a review. J Clin Periodontol 2004; 31:1034- 47.
22. Mombelli, A, Casagni, F, Madianos, PN. Can presence or absence of periodontal pathogens distinguís between subjects with chronic and aggressive periodontitis? A systematic review. J Clin Periodontol 2002; 29: 10-21.
23. Sasaki, N, Okuda, K, Ishihara, K, Seida, K, Nakagawa, T. Clinical microbiological and inmunological studies of post-juvenile periodontitis. Bulletin Tok Dent Coll 1989; 30: 205-11.
24. Kammagata, Y, Iida, M, Susuki, K, Saito, K, Yazawa, H. Pathophysiological análisis of rapidly progressive periodontitis. Ohu Daigaku Shigakushi 1995; 16: 7-12.
25. Vandensteen, GE, Page, RC, Altman, LC, Ebersole, JL, William, BL. Clinical, microbiological and immunological studies of a family with high prevalence of early onset periodontitis. J Clin Periodontol 1984; 55: 159-69.
26. Kamma, JJ, Nakau, M, Manti, FA. Microbiota of rapidly progressive periodontitis lesions in association with clinical parameters. J Periodontol 1994; 65: 1073-8.
27. Slots, J, Genco, RJ. Black – pigmented Bacteroides species , Capnocytophaga species, and Actinomyces actinomycetemcomitans in human periodontal diseases: virulence factors in colonization survival , and in tissue destruction. J Dent Res 1984; 63: 412-21.
28. Gmur, R, Strub, JR, Guggenenheim, B. Prevalence of Bacteroiodes forshytus and Bacteoides gingivalis in subgingival plaque prosthodontically treated patients on short recall. J Periodont Res 1989; 24: 113-20.
29. Listgarten, MA, Lai C-H Wong, MY. Detection of Actinobacillus actinomycetemcomitans, Porphyromona gingivalis and Bacteroides forshytus in an Actinobacillus actinomycetemcomitans positive population. J Periodontol 1995; 66: 158-64.
30. Riviere, GR, Elliot, KS, Adams, DF, Simonson, LG, Forgas, LB, Nilius, AM, Lukeheart, SA. Relative proportionsof pathogen- relatedoral spirochetes (PROS) and treponema denticola in supragingival and subgingival plaque from patients with periodontitis. J Periodontol 1992; 63: 131-6.
31. Takeuchi Y, Umeda M, Sakamoto M. Treponema socranskii, Treponema denticola, and Porphyromonas gingivalis are associated with severety of periodontal tissue destruction. J Periodontol 2001; 72: 1354- 63.