Dr. Eduardo Anitua /Dr. Mikel Sánchez/Dr. Gorka Orive/Dra. Isabel And’a/Biotechnology Institute I MAS D/Vitoria
Introducción
El progresivo aumento de las patologías óseas, lesiones musculares, tendinosas, cartilaginosas y en general alteraciones tisulares está repercutiendo muy negativamente en nuestra sociedad tanto a nivel sanitario como socioeconómico.
La necesidad de encontrar nuevas formulaciones y tratamientos que ofrezcan soluciones terapéuticas a los problemas sociosanitarios actuales está impulsando y estimulando la investigación y desarrollo de nuevos preparados biomédicos así como la optimización de protocolos quirúrgicos.
A lo largo de los últimos años, el estudio detallado de las plaquetas, de los mediadores biológicos contenidos en las mismas y de las formulaciones encaminadas a permitir la administración y uso terapéutico de los factores de crecimiento y biomateriales autólogos ha permitido avanzar y aumentar muy significativamente la versatilidad y posibilidades terapéuticas de la tecnología del PRGF (plasma rico en factores de crecimiento) (1-5). El interés creciente que suscita la tecnología del PRGF se basa principalmente en su gran versatilidad, eficacia y bioseguridad, ya que el uso y aplicación local de proteínas con actividad biológica en las zonas tisulares dañadas permite acelerar la reparación y/o regeneración de un gran número de tejidos sin efecto secundario alguno.
Este artículo de revisión pretende describir los principales fundamentos y características específicas de la tecnología del PRGF, así como dar a conocer los trabajos científicos más recientes en los que se ha demostrado la eficacia y bioseguridad del PRGF no sólo en el área dental e implantología oral sino también en otras áreas de la medicina. En concreto, repasaremos los resultados obtenidos en el tratamiento de lesiones tendinosas, ligamentosas, musculares y condrogénicas, tratamiento de úlceras crónicas y los últimos avances obtenidos en regeneración dérmica.
Investigación y desarrollo de la tecnolog’a del PRGF
La tecnología del PRGF se fundamenta en el estudio, utilización, formulación y activación de un preparado autólogo rico en plaquetas (PRGF). El estudio detallado de las propiedades intrínsecas de las plaquetas, junto con un protocolo optimizado para su concentración, activación y cinética de liberación, ha permitido el desarrollo de una tecnología de enorme versatilidad y potencial terapéutico.
El uso de productos ricos en plaquetas y por lo tanto en factores de crecimiento está asociado a cierta controversia, muchas veces provocada de forma interesada e injustificada, lo que sin duda genera una confusión generalizada acerca del potencial terapéutico de la tecnología. Si bien todo el conjunto de preparados ricos en plaquetas descritos siguen una filosofía similar y pretenden objetivos comunes, los protocolos empleados, las condiciones de elaboración, los términos utilizados para definir los productos, la composición cualitativa y cuantitativa de los preparados plaquetarios finales y por ende sus efectos biológicos son en muchos casos totalmente diferentes e incluso antagónicos. Es por ello necesario hacer un ejercicio de reflexión para poder distinguir entre la jungla de términos que identifican productos plaquetarios (PRP, PRF, PRG, FC, gel rico en plaquetas…) y provocan controversia (6). De igual forma, es igualmente importante destacar que el PRGF es un producto plaquetario 100% autólogo, que si bien sigue una filosofía y busca objetivos similares al de otros productos, presenta propiedades exclusivas que lo convierten en un producto optimizado de gran eficacia biológica y bioseguridad (7, 8).
Existe un conjunto de propiedades y características que diferencian al PRGF frente a otros productos plaquetarios y que en base a las evidencias científicas disponibles son fundamentales a la hora de entender el potencial terapéutico de la tecnología del PRGF. En primer lugar, el PRGF es un producto 100% autólogo y biocompatible. Además, debido a su versatilidad, sería más preciso hablar de Tecnología del PRGF, ya que no se trata de un preparado único, sino más bien de un conjunto de formulaciones con actividad terapéutica que se obtienen fácilmente de la sangre del paciente (4). Entre las formulaciones que constituyen la tecnología PRGF destacan (Figura 1):
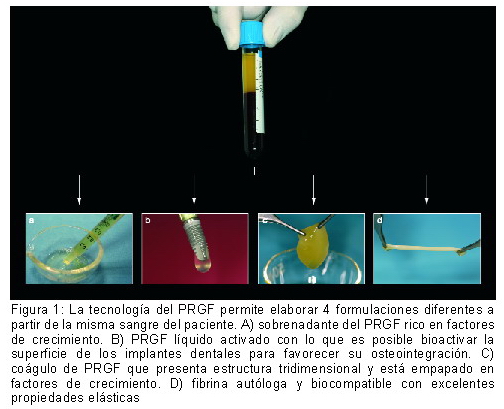 |
— Sobrenadante PRGF: Constituye un excelente medio de cultivo para mantener células primarias y hueso autólogo ya que contiene un elevado número de factores de crecimiento (9).
— PRGF líquido activado: La activación del PRGF mediante cloruro cálcico permite liberar el contenido de proteínas y factores de crecimiento dando lugar a una formulación líquida repleta de señales con la que podremos crear una superficie bioactiva en los implantes dentales que acelere la osteointegración de los mismos (10).
— Coágulo de PRGF: En apenas 5-7 minutos, el PRGF líquido activado se convertirá en una matriz tridimensional de fibrina y componentes celulares empapada en factores de crecimiento que puede ser empleada en múltiples aplicaciones, desde la regeneración de un alveolo post-extracción hasta el tratamiento de patologías musculoesqueléticas, dérmicas o vasculares.
— Fibrina autóloga: La retracción del coágulo de PRGF permite obtener una fibrina densa, elástica y totalmente biocompatible que podrá ser empleada en numerosas ocasiones como membrana aislante.
La tecnología del PRGF requiere pequeños volúmenes de sangre del paciente. Dependiendo de la cirugía que vayamos a realizar necesitaremos un mayor o menor volumen de PRGF (20-70 cm3) pero siempre empleando el mismo protocolo de elaboración. Este hecho tiene especial relevancia teniendo en cuenta que otros productos plaquetarios necesitan hasta 500 cm3 de sangre. Además, sólo se necesita una etapa de centrifugación lo que simplifica enormemente el protocolo. El citrato sódico se emplea como anticoagulante con el fin de no dañar ni alterar las propiedades de las plaquetas, mientras que la activación del PRGF se realiza con una dosis estándar de cloruro cálcico de forma que se aprovecha la propia trombina generada por el paciente. En ningún caso se emplea trombina bovina, lo que permite no sólo evitar riesgos de bioseguridad para el paciente (11) sino además una cesión más controlada de los mediadores biológicos.
Otro aspecto diferencial del PRGF frente a otros productos plaquetarios es la ausencia de la serie blanca en su composición. La presencia de leucocitos y neutrófilos puede repercutir negativamente en la formación de la fibrina autóloga, además de interferir en la agregación plaquetaria. Es conocido que las células de la serie blanca y en especial los leucocitos contienen citoquinas pro-inflamatorias y expresan metaloproteinasas (MMP-8 y -9) capaces de degradar la matriz extracelular. Además de los efectos mitogénicos, diferenciadores y angiogénicos del PRGF demostrados en diversos artículos científicos, las plaquetas expresan moléculas con efecto antibacteriano frente a Staphylococcus aureus y Escherichia coli e incluso, anti-inflamatorio, mediado por el bloqueo de la proteína MCP-1 y la generación de lipoxina A4 (12, 13).
Aplicaciones terapéuticas de la tecnolog’a del PRGF
Avances en el campo dental y en implantología oral
El uso del PRGF tanto de forma individual como asociado y/o combinado a diferentes biomateriales acelera la formación de hueso en los defectos óseos y estimula la regeneración del tejido blando adyacente. En un trabajo reciente, se estudió la capacidad del PRGF de acelerar la regeneración ósea en alvéolos artificiales creados en un modelo experimental de cabra. Los resultados demostraron que los alvéolos tratados con PRGF presentaban un tejido denso y compacto formado por trabéculas con osteocitos en su interior y flanqueado por cavidades medulares (14). En cambio, las biopsias tomadas del grupo control estaban parcialmente rellenas de tejido conectivo y en algún caso de tejido adiposo.
La tecnología del PRGF, debido a su potencial y versatilidad, ha sido aplicada con éxito en implantología oral, ya que la combinación del PRGF y la superficie de titanio exclusiva de los implantes dentales BTI (Biotechnology Institute) ha dado lugar a una superficie bioactivable y biológicamente activa, lo que ha representado un hito en el campo dental (10). Bioactivar implica humectar la superficie de titanio de los implantes con la formulación líquida de PRGF, de forma que la superficie quede cubierta por una red de fibrina impregnada en factores de crecimiento y proteínas con actividad biológica, lo que en conjunto mejora la osteointegración de los implantes. Este hecho ha sido recientemente demostrado en un trabajo de investigación, en el que comprobamos que la bioactivación de los implantes con PRGF aumentaba el contacto hueso-implante en más de un 85%, favoreciendo que la totalidad del implante apareciese rodeada de hueso duro cortical, haciéndose indistinguible la cortical de la medular en todas las muestras analizadas (14).
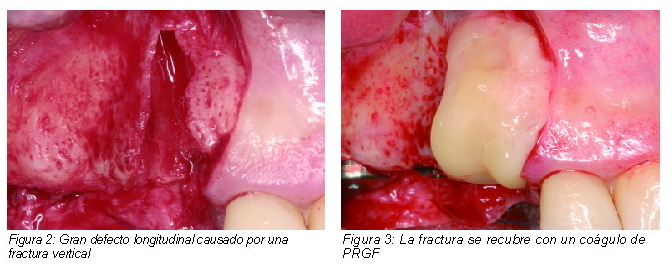 |
El potencial que ofrece la tecnología del PRGF desde un punto de vista clínico es muy significativo. La Figura 2 resume a modo de ejemplo la aplicación del PRGF en el tratamiento de un alveolo postextracción, en el que además del coágulo del PRGF, se empleará la fibrina autóloga y el PRGF líquido sobre la superficie de los implantes en caso de requerir su colocación inmediata. En trabajos sucesivos se ha evaluado la predictibilidad y seguridad de los implantes dentales BTI bioactivados con PRGF. Precisamente, en uno de estos trabajos se estudió la supervivencia durante 5 años de 5.787 implantes dentales BTI colocados en diferentes localizaciones anatómicas y bajo diferentes procedimientos en más de 1.000 pacientes (15). Los resultados reflejaron supervivencias globales del 99,2%, 96,4% y 96% asumiendo un análisis basado en el implante, en la cirugía o en el paciente respectivamente y únicamente 28 fracasos (0,48%). El análisis de los resultados nos permitió comprobar que la colocación de implantes en dos fases y la utilización de técnicas especiales (elevación de seno, expansión de cresta, etc.) eran factores de riesgo para el fracaso del implante. Otros trabajos más recientes han demostrado niveles de éxito similares en el caso de implantes cortos bioactivados (16) (supervivencia del 99,2%) e incluso superiores (supervivencia del 99,3%) en el caso de implantes colocados tras carga inmediata (17).
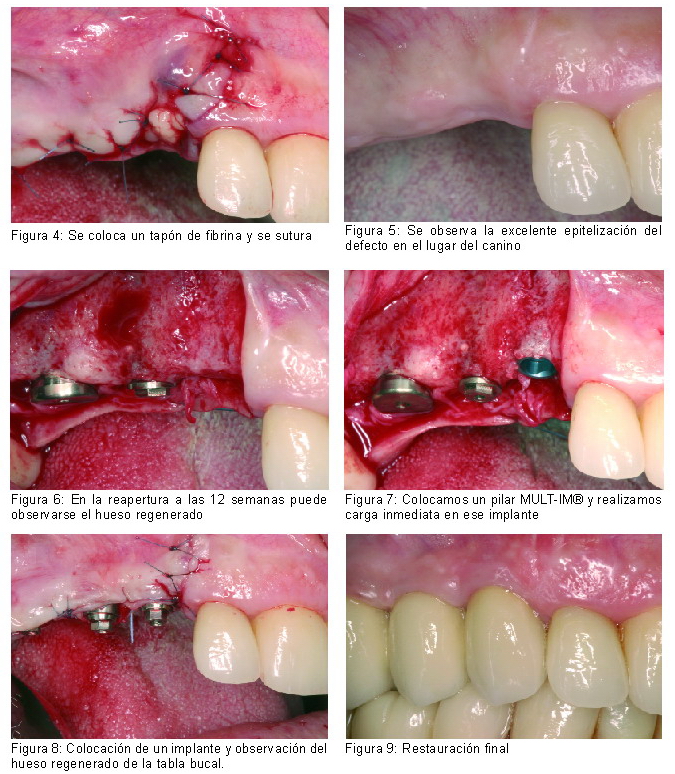 |
Otro hito interesante en implantología oral ha sido emplear la tecnología PRGF en diferentes protocolos quirúrgicos de forma que se facilite, simplifique y mejoren los resultados globales de los mismos (18). Además del uso de PRGF en técnicas de expansión de cresta (19, 20), split o crecimiento vertical, se han empleado con éxito las diferentes formulaciones en la técnica de elevación de seno (Figura 3). Por una parte, la utilización de PRGF facilita la aglutinación y administración del biomaterial óseo, al mismo tiempo que evita su dispersión incontrolada por el seno. La mezcla PRGF-biomaterial se empleará como injerto con el que rellenaremos la cavidad del seno. Además, según hemos demostrado en un estudio bilateral de seno, el PRGF permite expandir significativamente el volumen del injerto en más de un 25%. La ventana ósea retirada del seno mediante ultrasonidos quirúrgico se mantendrá en PRGF líquido con el fin de preservar su viabilidad y propiedades biológicas, y posteriormente se colocará en su posición anatómica original. No menos importante resulta el hecho de que la ventana la cerraremos con el mejor biomaterial autólogo existente, la fibrina autóloga, elástica y homeostática obtenida del propio paciente. Esta misma fibrina podremos emplearla en caso de producirse una pequeña perforación en la membrana de Schneider.
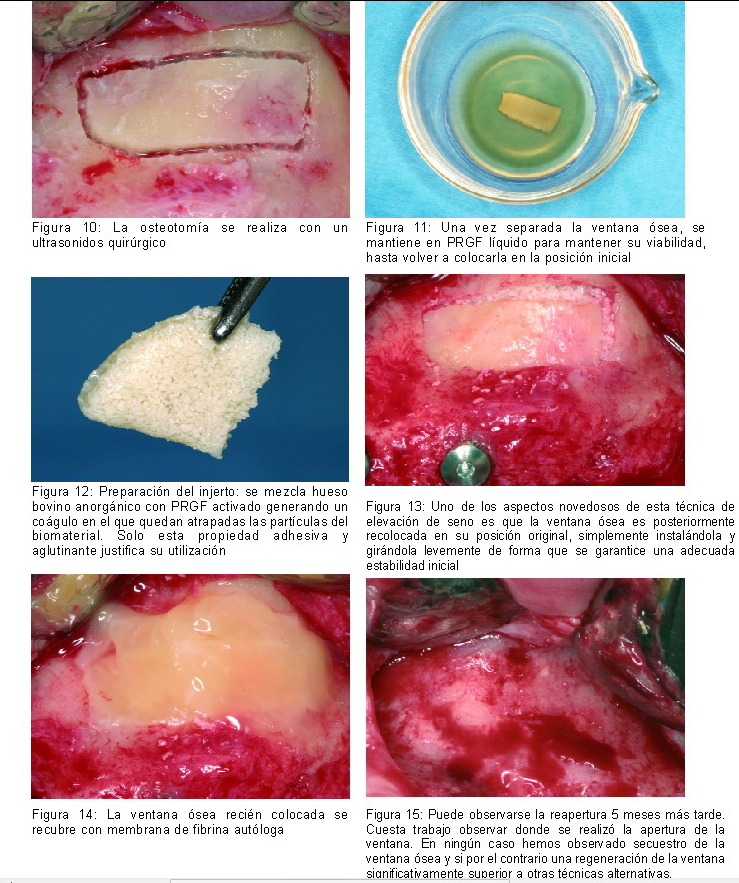 |
Ulceras crónicas
Las ulceraciones de las extremidades inferiores son una complicación común en un amplio abanico de patologías y tienen un impacto negativo en la calidad de vida de los pacientes afectados. La administración controlada de factores de crecimiento autólogos implicados directamente en la regulación de estos procesos biológicos representaría una nueva aproximación terapéutica al tratamiento de estas lesiones crónicas. Los resultados esperanzadores obtenidos en diferentes casos aislados que avalaban el potencial terapéutico del PRGF propiciaron la puesta en marcha de un ensayo clínico en 14 pacientes que sufrían ulceras crónicas y que fueron aleatoriamente asignados al grupo de tratamiento con PRGF y al grupo control (tratamiento convencional). Los resultados demostraron que la aplicación tópica de la matriz tridimensional de fibrina sobre la zona ulcerada permitió en tan sólo 8 semanas aumentar la superficie regenerada hasta un 73% frente al 22% del grupo control (21).
Medicina deportiva
La posibilidad de utilizar PRGF como alternativa terapéutica en el tratamiento de lesiones deportivas ha supuesto una revolución para los cirujanos y especialistas en el campo (22). Los prometedores resultados iniciales en deportistas de élite han dado lugar a numerosos y muy variados estudios poblacionales en los que se demuestra el potencial y seguridad del PRGF a la hora de tratar diversas patologías y acelerar de forma general la recuperación funcional del paciente con un menor grado de dolor y mayor satisfacción.
En el caso de las lesiones tendinosas, nuestra investigación comenzó analizando el efecto de los factores de crecimiento del PRGF en tenocitos humanos. Para tal fin, se empleó una doble estrategia, el cultivo de los tenocitos en un sobrenadante rico en factores y la inclusión de las células en el coágulo de PRGF simulando una estrategia de ingeniería de tejidos (tissue engineering) (23-25). En ambos casos los resultados fueron prometedores, ya que el PRGF estimuló muy significativamente la proliferación celular y dio lugar a la expresión paracrina de dos factores de crecimiento de especial importancia y beneficio para el tratamiento de lesiones tendinosas como son el VEGF (factor de crecimiento del endotelio vascular) y el HGF (factor de crecimiento hepatocítico). De hecho, el primero de ellos es un potente agente angiogénico mientras que el segundo es un agente anti-fibrótico. Además, se pudo demostrar que la administración de PRGF en ovejas aumentaba la densidad celular y la neovascularización sin que se observaran efectos secundarios ni fibrosis.
En una fase posterior se llevó a cabo un ensayo clínico con el que se evaluó la eficacia y seguridad del PRGF durante la reconstrucción quirúrgica de roturas del tendón de Aquiles (26). Para tal fin, un total de doce atletas se sometieron a una reparación de sutura abierta tras una rotura completa. Se realizó en seis de los atletas una reparación con sutura abierta aplicando PRGF y se comparó retrospectivamente con un grupo de pacientes sometidos al procedimiento quirúrgico convencional. Se evaluaron parámetros como el rango de movilidad, recuperación funcional y complicaciones a la vez que se valoraba la morfología del tendón mediante ultrasonidos. Los atletas que fueron tratados con PRGF recuperaron el rango de movilidad antes, no mostrando ninguna complicación en la herida y sí en cambio una más rápida recuperación a la hora de correr y retomar las actividades de entrenamiento. Además, las muestras de los tendones tratados con PRGF mostraron un menor incremento, lo que reflejaba una reparación más fisiológica.
La tecnología del PRGF ha sido aplicada con éxito durante la cirugía artroscópica para la reconstrucción del ligamento cruzado anterior. Representa un nuevo y prometedor protocolo quirúrgico y supone toda una revolución tanto por su sencillez y seguridad como por su eficacia (27, 28). La innovación consiste en tratar dicho injerto tendinoso con PRGF, con el fin de favorecer el proceso de ligamentización del tendón una vez colocado en la articulación. Para determinar el potencial terapéutico de este nuevo protocolo quirúrgico con PRGF, se comparó la evolución clínica en dos grupos de pacientes, 50 pacientes tratados mediante la técnica convencional y 50 pacientes a los que se había aplicado PRGF. Los resultados obtenidos no pudieron ser más prometedores ya que además de reducir las complicaciones habituales e inflamaciones postoperatorias, en el grupo tratado con PRGF se logró un remodelado biológico óptimo y la incorporación del injerto del tendón en el interior del túnel. Asimismo, el grupo tratado con PRGF presentaba mayor número de rodillas estables y una mejor consolidación radiográfica de los túneles óseos.
 |
Otra aplicación del PRGF que ha tenido especial relevancia y que es original del grupo de investigación, es su uso en cirugía artroscópica de una avulsión del cartílago articular de la rodilla. El estudio realizado en un futbolista adolescente demostró que la reinserción artroscópica del cuerpo condral perdido en su cráter y la inyección de PRGF en la zona, permitieron acelerar la cicatrización y recuperación del cartílago articular cuya prognosis inicial era extremadamente pobre (28).
Conclusiones
La tecnología del PRGF representa un nuevo hito en la estimulación y regeneración de un gran número de tejidos. A lo largo de los últimos años hemos podido comprobar cómo la eficacia y seguridad del PRGF a la hora de estimular la reparación y regeneración tisular no sólo se circunscribe al hueso sino, además, a otro gran conjunto de tejidos lo que indudablemente abre innumerables opciones terapéuticas. El PRGF favorece la proliferación celular, la diferenciación y la neovacularización del tejido así como la síntesis paracrina de factores de crecimiento. Este hallazgo ha sido demostrado en diferentes tipos celulares como los tenocitos, fibroblastos (29) o células sinoviales (30). En este artículo hemos presentado algunas de las aplicaciones del PRGF más novedosas y recientes. Estamos convencidos de que en los próximos años surgirán nuevas y prometedoras aplicaciones terapéuticas que permitirán expandir más aún el abanico de opciones de este preparado biotecnológico.
Bibliografía
1. Anitua E. The use of plasma rich growth factors in oral surgery. Pract Proced Aesthet Dent 2001; 13: 487-493.
2. Anitua E, And’a I, S‡nchez M. PRGF (Plasma Rico en factores de crecimiento). Dental Dialogue 2004; 3: 6-19.
3. Anitua E, S‡nchez M, Nurden AT, Nurden P, Orive G, And’a I. New insights into and novel applications for platelet-rich fibrin therapies. Trends Biotechnol 2006; 5: 227-234.
4. Anitua E, S‡nchez M, Orive G, And’a I. The potential impact of the preparation rich in growth factors (PRGF) in different medical fields. Biomaterials 2007; 28: 4551-4560.
5. Anitua E, S‡nchez M, Orive G, And’a I. Delivering growth factors for therapeutics. Trends Pharmacol Sci 2008, 29: 37-41.
6. Anitua E, S‡nchez M, Orive G, And’a I. Shedding light in the controversial terminology for platelet rich products. J Biomed Mater Res A 2008 (In Press).
7. Anitua E, And’a I, Ardanza B, Nurden P, Nurden AT. Autologous platelets as a source of proteins for healing and tissue regeneration. Thromb Haemost 2004; 91: 4-15.
8. Nurden AT, Nurden P, S‡nchez M, And’a I, Anitua E. Platelets and wound healing. Frontiers Biosci 2008; 13: 3532-3548.
9. Anitua E, Carda C, Andia I. A novel drilling procedure and subsequent bone autograft preparation: a technical note. Int J Oral Maxillofac Implants 2007; 22: 138-145.
10. Anitua E. Enhancement of osseointegration by generating a dynamic implant surface. J Oral Implant 2006; 32: 72-76.
11. Zehnder JL, Leung LLK. Development of antibodies to thrombin and factor V with recurrent bleeding in a patient exposed to topical bovine
thrombin. Blood 1990; 76: 2011-2016.
12. Bielecki TM, Gazdzik TS, Arendt J, Szczepanski T, Krol W, Wielkoszynski T. Antibacterial effect of autologous platelet gel enriched with growth factors and other active substances. J Bone Joint Surg 2007; 89: 417-420.
13. El-Sharkawy H, Kantarci A, Deady J, Hasturk H, Liu H, Alshahat M, Van Dyke TE. Platelet rich plasma: growth factors and pro and anti-inflammatory properties. J Periodontol 2007; 78: 661-669.
14. Anitua E, Orive G, Pl‡ R, Rom‡n P, Serrano V, And’a I. The effects of PRGF on bone regeneration and on titanium osseointegration in goats: a histologic and histomorphometric study. J Biomed Mater Res A 2008 (In Press).
15. Anitua E, Orive G, Aguirre JJ, Ardanza B, And’a I. 5-year clinical experience with BTI dental implants: risk factors for implant failure. J Clin Periodontology 2008 (In press).
16. Anitua E, Orive G, Aguirre JJ, And’a I. 5 year clinical evaluation of short dental implants placed in posterior areas: a retrospective study. J Periodontology 2008; 79: 42-48.
17. Anitua E, Orive G, Aguirre JJ, And’a I. Clinical outcome of immediately loaded BTI dental implants: a 5-year retrospective study. J Periodontology 2008 (In press).
18. Anitua E. Novel protocols for a predictable implantology. Pract Proced Aesthet Dent 2008; 20(2): 123-128.
19. Torrella F, Pitarch J, Cabanes G, Anitua E. Ultrasonic osteotomy for the surgical approach of the maxillary sinus: a technical note. Int J Oral Maxillofac Implants 1998; 13: 697-700.
20. Lee E, Anitua E. Atraumatic ridge expansion and implant site preparation with motorized bone expanders. Pract Proced Aesthet 2006; 18: 17-22.
21. Anitua E, Aguirre JJ, Algorta J, Ayerdi E, Cabezas AI, Orive G, Andia I. Effectiveness of autologous preparation rich in growth factors for the treatment of chronic cutaneous ulcers. J Biomed Mater Res B 2008; 84: 415-421.
22. S‡nchez M, Anitua E, Orive G, And’a I. Platelet-Rich therapies in the treatment of sport injuries. Sports Med 2008 (In Press).
23. Anitua E, Andia, Sanchez M, Azofra J, del Mar Zalduendo M, de la Fuente M, Nurden P, Nurden AT. Autologous preparations rich in growth factors promote proliferation and induce VEGF and HGF production by human tendon cells in culture. J Orthopaedic Res 2005; 23: 281-286
24. Anitua E, Sanchez M, Nurden AT, Zalduendo M, de la Fuente M, Orive G, Azofra J, And’a I. Autologous fibrin matrices: a potential source of biological mediators that modulate tendon cell activities. J Biomed Mat Res A 2006; 77: 285-293
25. Anitua E, Sanchez M, Nurden AT, Zalduendo M, de la Fuente M, Azofra J, Andia I. Reciprocal actions of platelet-secreted TGF-b1 on the production of VEGF and HGF by human tendon cells. Plastic Reconstruct Surg 2007; 119: 950-959.
26. S‡nchez M, Anitua E, Azofra J, And’a I, Padilla S, Mujika I. Comparison of surgically repaired achilles tendon tears using platelet-rich fibrin matrices. Am J Sports Med 2007; 35: 245-251.
27. S‡nchez M, Azofra J, Aizpurœa B, Elorriaga R, Anitua E, And’a I. Use of autologous plasma rich in growth factors in Arthroscopic surgery. Cuadernos de Artroscopia 2003; 10: 12-19.
28. SanchŽz M, Azofra J, Anitua E, And’a I, Padilla S, Santisteban J, Mujika I. Plasma rich in growth factors to treat an articular cartilage Avulsion: A Case Report. Med Sci Sports Exer 2003; 35: 1648-1652.
29. Anitua E, Sanchez M, Zalduendo M, de la Fuente M, Prado R, Orive G, And’a I. Fibroblastic response to treatment with platelet rich preparations. Cell Proliferation 2008 (In press).
30. Anitua E, S‡nchez M, Nurden AT, Zalduendo M, de la Fuente M, Azofra J, And’a I. Platelet-released growth factors enhance the secretion of hyaluronic acid and induce hepatocyte growth factor production by sinovial fibroblasts from arthritic patients. Reumathology 2007; 46: 1769-1772.




