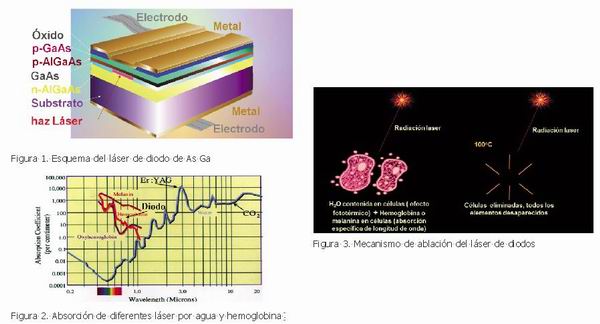
Los láser de diodos pertenecen a la serie de láser de estado sólido y de emisión continua, formados por un diodo de Arseniuro de Galio (As Ga), que emite en una longitud de onda en el infrarrojo cercano entre los 804 y los 980 nm, por lo que no puede ser visto por el ojo humano y, en muchas ocasiones, va acompañado de un láser marcador de He Ne (1, 2). Se trata de un láser de contacto, por lo que es preciso emplear como medio de transmisión una fibra de vidrio con pieza de mano específica, de diferentes diámetros, según aplicaciones, si bien para su uso en Cirugía e Implantología se recomienda la fibra de 400 µm, ya que permite la liberación de la radiación láser sin alterar su morfología y sin perder la elasticidad necesaria (3).
La potencia de uso del láser de diodo varía, pudiendo llegar hasta los 10 W, si bien no suele ser necesario emplear potencias de más de 3 -4 W. Su forma de aplicación puede ser en forma de onda continua, si bien la forma de superpulso (frecuencia ≥ 1000 Hz) es de elección, ya que su expresión clínica es la de una onda continua, pero el efecto térmico tisular es menor (4.)
Los efectos del láser de diodo sobre los tejidos son los de ablación fototérmica, y por longitud de onda específica (máxima absorción por el color rosa), y los efectos de bioestimulación. Por lo tanto, también tiene efectos de esterilización del área irradiada, al vaporizar las estructuras bacterianas presentes en la zona; también hace un efecto barrera en la zona, al crear un área de proteínas hialinizadas en su zona de aplicación, lo que dificulta la colonización de los tejidos. Produce coagulación de pequeños vasos de la zona, pero por un efecto de termocoagulación, y no por isquemia selectiva de los mismos, a diferencia del láser de CO2 (1,3).
 |
Sus efectos patológicos vienen dados por el exceso de irradiación aplicada (mayor energía depositada), que producen un aumento de temperatura, debido al sobrecalentamiento del agua de los tejidos, ya que al tener una absorción no completa por el tejido rico en hemoglobina, el exceso de energía es absorbida por el agua intersticial y provoca el calentamiento de esta, con el consiguiente daño secundario (4).
Su uso requiere de protección ocular, al tratarse de un láser que puede afectar por su longitud de onda a la coroides, produciendo lesiones de difícil evolución. Sus indicaciones varían, y pueden ser aplicados tanto en técnicas de blanqueamiento como en hiperestesias dentinales, halitosis, endodoncia, o periodoncia, si bien alcanzan su máxima expresión en Cirugía y en Implantología, al ser los tejidos blandos de la cavidad bucal los que mejor absorben las longitudes de onda de estos láser
Selección del tipo de láser
Según se ha señalado, la gama de longitudes de onda (l) que abarca el espectro de los diferentes láser de diodo está entre los 804 y los 980 nm. La significación clínica de estos depende de, precisamente, la l de emsión del láser. Como se puede ver en la Figura 4, longitudes más cercanas a los 1.000 nm tienen una mayor absorción por el agua (casi el doble que la de los más cercanos a los 800 nm), por lo que su efecto térmico es mayor (3.)
La forma de emisión depende de la aplicación que se le quiera dar al láser. En el caso de implantología, será variada, ya que se puede aplicar desde la bioestimulación (forma continua, con lente focalizadora específica), descontaminación (forma discontinua sin contacto tisular) hasta el corte (ablación de tejidos), siendo esta la aplicación más frecuente.
 |
En corte, se puede emplear la forma de emsión continua o la de superpulso. La primera, deposita más energía en los tejidos, por lo que es más fácil producir efectos fototérmicos, mientras que la de superpulso no deposita tanta energía (on/off de 1000 veces por segundo), y la expresión clínica es similar, por lo que parece ser la forma de elección, si bien no todas las máquinas presentes en el mercado pueden proporcionarla.
La potencia de trabajo no parece ser necesario que sea mayor a 3 W en la mayoría de los casos, pudiéndose trabajar a menores potencias, y minimizando así los efectos fototérmicos del láser. En cuanto al diámetro de la fibra a emplear, la de 400 µm parece ser la más adecuada, y se debe activar en todos los casos con el fin de dirigir el rayo de luz focalizadamente hacia la zona en cuestión (3.)
El uso de anestesia en estos casos puede llegar a ser selectivo, ya que el síntoma dolor tiende a aparecer en aquellos casos en los que el efecto térmico es mayor, por lo que al minimizar este, también se reduce el uso de anestesia. En principio, la aplicación de un gel anestésico incoloro (para permitir la transmisión de la luz sin pérdidas por absorción) puede ser suficiente, aunque en otros casos se requiere anestesia infiltrativa con los fármacos habituales.
Aplicaciones en implantología
Resulta complicado establecer cuáles son las indicaciones precisas, ya que diferentes autores no han alcanzado un consenso sobre la utilización del láser de diodo en Implantología. Esto se debe tanto a las series de casos con la longitud insuficiente o con datos y resultados no homogéneos, como a los diferentes sistemas de láser empleados en los estudios. (1,4-7)
Esta última es la principal causa de discrepancia en los resultados, por lo que resulta imprescindible señalar cuál es el sistema empleado en cada caso, y ver así la posibilidad de estandarizar los resultados. En nuestro caso, nos referiremos a un sistema de láser de diodo de AsGa, con una longitud de onda de 810 nm, trabajando con transmisión por fibra de vidrio de 400 µm, y con posibilidad de frecuencias de superpulso de hasta 2000 Hz (Creation©, Verona, Italia) (1-3).
Las aplicaciones las podemos clasificar en:
1. Aplicaciones de corte.
2. Aplicaciones de desinfección.
3. Aplicaciones de bioestimulación.
1. Aplicaciones de corte
1. Segunda fase quirúrgica
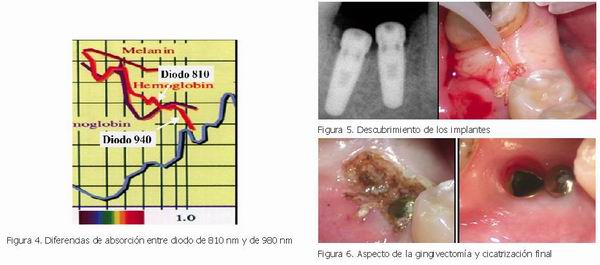
La utilización del láser de diodo en la exposición de los implantes, presenta una serie de ventajas importantes frente a la utilización de las técnicas convencionales de escisión con bisturí frío (4, 10).
La rapidez de la realización de la técnica, la coagulación de los tejidos escindidos, la desinfección del área quirúrgica y el uso selectivo de anestesia son algunos de los argumentos empleados para proponer su aplicación de manera estándar.
La principal contraindicación está en aquellos casos en los que el implante no tiene suficiente encía queratinizada alrededor de él, en los que se debe hacer técnicas de colgajo con desplazamiento de tejidos.
Uno de los inconvenientes reflejados en la literatura, es el sobrecalentamiento del hueso y tejidos periimplantarios, pero es más frecuente cuando se emplean láser con longitud de onda más cercana a los 1.000 nm, si bien hay que tener cuidado y trabajar siempre pincelando el tejido a escindir y sin presionar ni detenerse en ningún punto específico, a fin de concentrar la energía en él.
No hay referencias sobre la lesión a la estructura de los implantes tras su contacto con este láser.
La cicatrización es más rápida, y habitualmente no es necesario el uso de antibioterapia postoperatoria, ni de anestesia en los casos con tejido más queratinizado.
La potencia de uso oscila entre los 2 y los 4 W, en función de la cantidad de tejido a escindir, trabajando con la fibra de 400 µm y se puede usar tanto en onda continua como en superpulso, si bien este último es de elección.
2. Gingivectomía y recontorneado estético
La gingivectomía periimplantaria es un tema complicado de tratar, ya que se puede referir tanto a los fenómenos inflamatorios periimplantarios, cuyo tratamiento sería la exéresis y desinfección de los mismos, como al perfilado estético de las áreas periimplantarias con objeto de mantener un perfil de emergencia lo más natural posible (3,8).
En principio, esta gingivectomía de recontorneado se realiza en la primera fase quirúrgica, y la finalidad es la de adaptar los tejidos blandos periimplantarias al perfil de emergencia de los pilares, para crear o mejorar el aspecto de las papilas y de la emergencia de los dientes.
La aplicación del láser de diodo tiene indicación por sus funciones hemostáticas y por la precisión de su manejo, al tratarse de un láser de contacto que permite cortar sólo el área de interés (8).
Se emplea a bajas potencias (1-2 W), de preferencia en modo superpulsado y con fibra de 200 o de 400 µm, y siempre pincelando la zona y en intervalos breves de tiempo para no producir sobrecalentamiento ni retracción tisular.
Figura 10. Ajuste de prótesis
3. Tratamiento de complicaciones:
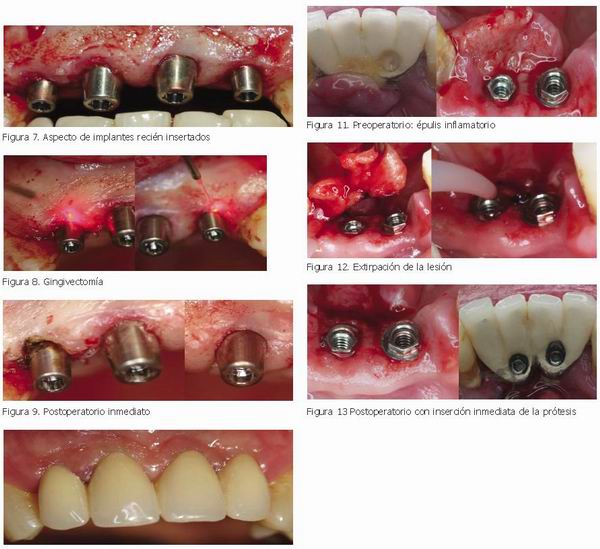
épulis inflamatorios
No es infrecuente la aparición de tejidos inflamatorios en relación con prótesis sobre implantes con mala higiene o con falta de ajustes de los componentes.
La eliminación de estos tejidos es laboriosa e ingrata, y es necesario recurrir a técnicas quirúrgicas complejas que impiden al paciente portar de manera inmediata su prótesis, aparte de los problemas relativos al sangrado residual y a la necesidad de eliminar por completo el tejido inflamatorio de la zona, para evitar la recidiva.
El uso de láser de diodo con potencias entre 1 y 4 W, tanto en onda continua como en superpulso, elimina estos problemas, al producir extirpación completa de la lesión, hemostasia de la zona y desinfección del área quirúrgica, lo que permite insertar la prótesis de manera inmediata (3,5).
 |
Aplicaciones de desinfección
Las aplicaciones de desinfección del láser de diodo comprenden un amplio rango de ellas, entre las que incluimos el tratamiento de la enfermedad periimplantaria, ya que la eliminación del componente infeccioso es condición fundamental para la correcta evolución del cuadro.
La potencia de trabajo y el tiempo que se puede emplear es fundamental, ya que en todo caso trabajamos con energías subablativas: no buscamos eliminar tejidos, sino esterilizar la zona afecta para facilitar la curación y regeneración de la lesión así como bioestimular las células de la zona para facilitar el proceso regenerativo
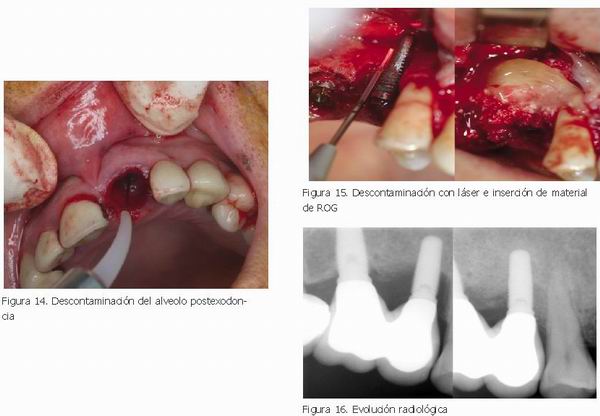
1. Desinfección prequirúrgica de los alveolos
Se trabaja con el láser de diodo de 810 nm, a una potencia de 2,5 W y en modo discontinuo a 50 Hz. Se aplica por todas las paredes del alveolo, realizando un movimiento espiroideo, y de apical hacia coronal .
Se realiza en aquellos casos en los que se va a realizar la inserción inmediata de implantes, sobre todo en aquellos casos de exodoncias de dientes periodontales o de dientes con abcesos (9)
 |
2. Periimplantitis
La aplicación del láser de diodo en enfermedad periimplantaria es novedosa y sus efectos todavía no están plenamente demostrados, si bien los primeros resultados parecen prometedores. (5,6,11)
Se puede aplicar en todos los casos de enfrermeda periodontal y en todas las técnicas de tratamiento, pero con una serie de requisitos básicos:
•Limpieza de la zona: se debe eliminar el sarro subgingival, a fin de que la luz penetre en toda la zona.
•Aplicación del láser: se puede hacer cada 4 días, y a una velocidad de 1 segundo por mm2, con los ajustes de desinfección antes señalados: potencia de 2,5 W y en modo discontinuo a 50 Hz
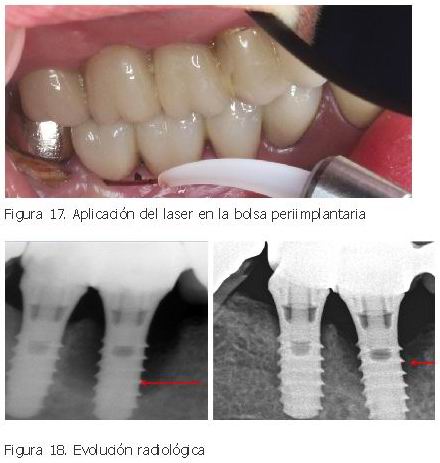 |
Los efectos que se pueden conseguir son:
•Descontaminación del área afecta.
•Estimulación de los osteoblastos.
•Tiempo de intervención y cirugía reducido: o sea, menor dolor y malestar para el paciente.
Sin embargo, hay que señalar que el láser no resuelve por completo el problema, y la mala higiene puede conducir al estado original.
a) Osteítis periimplantaria
Descontaminación a cielo abierto y con técnicas de ROG (12).
En estos casos se procede a la apertura de colgajo y a la eliminación de los tejidos afectados, y, finalmente, a la descontaminación de la superficie del implante y aplicación de técnicas de ROG.
b) Descontaminación cerrada
Cuando la bolsa periimplantaria es menor de 5mm, se puede acceder a descontaminar la bolsa, previa eliminación del sarro subgingival.
Los parámetros de aplicación son los ya indicados, y los resultados son buenos si se mantiene una higiene correcta.
c) Mucositis periimplantaria
La mucositis periimplantaria requiere tanto la descontaminación como la eliminación de los tejidos hiperplásicos, por lo que la aplicación del láser se debe hacer en dos fases: la primera consiste en la ablación de los tejidos infectados, y se puede hacer en modo de onda continua o de superpulso, con potencias entre 1-3 W. En segundo lugar, se procede a la descontaminación de la pseudobolsa con los parámetros ya expuestos.
3. Abceso periimplantario
Se puede trabajar con el láser de diodo en modo de descontaminación con el fin de eliminar tanto el trayecto fistuloso como el foco infectado.
Hay que tener cuidado por el efecto térmico del láser: la liberación excesiva de calor puede afectar al hueso subyacente.
La aplicación del diodo debe ser suave "pincelando" los tejidos, pero se debe llegar en todos los casos a eliminar el trayecto fistuloso, y dejar totalmente descubierta la cabeza del implante.
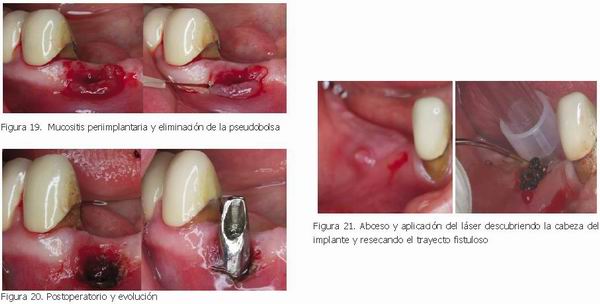 |
Aplicaciones de bioestimulación
El láser de diodo también puede emplearse para funciones de bioestimulación, si bien creemos que esta es no separable de las otras aplicaciones, aunque se puede aplicar el láser para realizar sólo esta, mediante el uso de piezas de manos específicas que mantiene una distancia focal constante, y, en todo caso, sin contacto (13, 17).
Se trata de una aplicación de soft láser o de LLLT (Low Level láser Therapy) por lo que la potencia a emplear es de 1-2 W, con fibra de 600 µm y pieza de mano específica sin contacto con el tejido a irradiar.
La expresión biológica del láser terapéutico es diversa, planteándose en general una acción reparadora sobre los tejidos. Desde el punto de vista bioquímico su acción fundamental radica en la modulación de la fosforilación oxidativa en la mitocondria donde estimula la síntesis del ATP, forma fundamental de la energía biológicamente disponible.
El mecanismo por el cual ejerce su efecto sobre los tejidos parece determinado por la acción de los rayos sobre la membrana plasmática de las células, basando principalmente su monocromaticidad que desencadena a partir del efecto sobre determinados fotorreceptores una cascada metabólica que culmina entre otras cosas con la estimulación mitocondrial (14).
La forma intrínseca de la membrana plasmática se reporta por la estimulación de la enzima adenil ciclasa con el consiguiente aumento del AMPc el cual actúa como segundo mensajero estimulando la biología celular, lo cual favorece la acción de varias hormonas y factores de crecimiento. Si la acción del láser terapéutico es cambiar la polaridad y/o fluidez de la membrana en función y composición de la misma.
Otros sistemas de segundos mensajeros deben estimularse junto con el AMPc como son el calcio que ejerce sus funciones sobre la mitocondria, el retículo endoplasmatico y diversos sistemas proteicos citoplasmáticos, modulando entre otras cosas la fisiología de los microtubulos, miofibrillas y el aparato de Golgi donde se determina la mayor parte de la actividad secretora de las células.
Efectos biológicos del láser terapéutico a nivel celular
La absorción de fotones de determinada longitud de onda por los fotorreceptores provoca la transformación de la actividad funcional y metabólica de la célula y así se generan una serie de efectos:
Efecto bioenergético: se basa en la necesidad de reservas energéticas (ATP) en la célula, para poder desarrollar su actividad. Cuando la célula se encuentra dañada, estas reservas disminuyen, y por lo tanto su actividad se altera. La radiación láser de baja o media potencia actúa directamente sobre los fotorreceptores de la cadena respiratoria, activa y facilita el paso de ADP a ATP y aumenta la reserva de energía en el interior de las mitocondrias. Las reservas energéticas facilitan la reacciones ínterestructurales y la activación del aparato nuclear (15).
Efecto bioeléctrico: los fotorreceptores presentes en la membrana celular absorben la energía proveniente de la radiación láser; esta actividad fotoeléctrico en la membrana contribuye a normalizar la situación iónica a ambos lados de la misma, ayudada por la energía que extrae de la hidrólisis de ATP. Se restablece así el potencial de membrana y con ello, la vitalidad celular y sus funciones (16,17.)
Efecto bioquímico: El aumento en las reservas energéticas (ATP) facilita las reacciones interestructurales, así como los ciclos metabólicos intracelulares de gran consumo de oxigeno y dan lugar a la activación general del metabolismo celular.
Efecto bioestimulante: La función celular parte de la activación de los genes contenidos en el núcleo. El DNA es activado por el ATP y comienza la síntesis proteica que tiene como resultado final la formación de proteínas estructurales, enzimas que intervienen en los procesos extracelulares o tisulares. Al actuar la radiación láser como activadora de la síntesis proteica y por lo tanto de la función celular, se aceleran los procesos de división y multiplicación celular. (18)
Efecto inhibitorio: existen investigaciones que demuestran un efecto contrario a la bioestimulación que se produce en la depresión de los procesos intracelulares que dan lugar a la inhibición de la multiplicación celular.
La activación en la síntesis de proteína conlleva al incremento de las proteínas que forman parte de la estructura celular y de las enzimas proteínas que intervienen en la defensa tisular (lizosima, interferón y otras).
El incremento en la síntesis proteica, junto con el potencial energético y el incremento en los ciclos metabólicos, aceleran el proceso de mitosis, y por lo tanto, la multiplicación celular.
Por otro lado el incremento en la producción de enzimas y proteínas de defensa permite al tejido afectado disponer de un potencial defensivo mucho mayor.
Agradecimientos
Al profesor Alfred Resch, por su colaboración y la cesión de fotografías y esquemas del láser de diodos
Correspondencia:
Doctor. A. Bowen
Clínica Bowen. Madrid – www.clinicabowen.com
Bibliografía
1 Gutknecht N. Proceedings of the 1st international workshop of evidence based dentistry on lasers in dentistry. Ed Quintessence.2007.
2 España-Tost AJ, Arnabat-Domínguez J, Berini-Aytés L, Gay-Escoda C. Aplicaciones del láser en Odontología. RCOE 2004;9(5):497-511.
3 Moritz A. Oral laser application.Ed. Quitessence. 2006.
4 Arnabat-Domínguez,J., Espana-tost, AJ., Berini-Aytes,l., Gay-Escoda, C. (2003) erbium:yag laser application in the second phase of implant surgery¨:a pilot study in 20 patients.int j oral maxillofac implants 18(1),104-12.
5 Aoki,A.,Sasaki,km.,Watanabeh.,Ishikawal. (2004)lasers in nonsurgical periodontal therapy.periodontol 2000 36,59-97.
6. Bach G, Neckel C ,mall C, krekeler G.(2000) conventional versus laser assisted therapy of periimplantis:a five-year comparative study.implant dent 9,247-51.
7 Clayman l, kuo PC. (1997)soft tissue excision techniques.in:clayman,l.,kuo,p.,lasers inmaxillofacial surgery and dentistry.thieme publ.,stuttgart,63-19983.
8 Clayman, l (1994) management of mucosal premalignant lesions.oral maxillofac clin north am 6,431-443.
9 Dörbudak o,Haas R, Bernhart T, Maliath-Pokorny G.(2001)Lethal photosensitization for decontamination of implant surfaces in the treatment of periimplantritis.Clin Oral Implants Res 12,104-108.
10 Goharkhay K, Moritz A, Wilder -Smith P, Schoop U, Kluger W, Jakolitsch S, Sperr W.(1978) Effects on oral soft tissue produced by a diode laser in vitro.J Oral Surg 36,932-7.
11 Hayek RR, Araujo,NS, Gioso, MA, Ferreira J, Bapista SobrinhoCA, Yamada AM, Riberio MS. (2005) Comparative study between the effects of photodynamic therapy andconvetional therapy on microbial reduction in ligature -induced peri-implants in dogs.J.Periondontal 76,1275-81.
12 Pinheiro AL, Limeira Júnior, FA, Gerbi MEM, Ramlho LMP. (2003) Effect of 830-nm Laser Light on the repair of bone defects graft with inorganic Bovine bone and decalcified cortical Osseous membrane.J Clin laser med surg 21(6),383-388.
13 Bruguera A. Atlas of laser therapy applied to clinical dentistry.Ed Quintessence. 2006.
14 Karu T. 1999. Primary and secondary mechanisms of action of visible to near-IR radiation on cells. J Photochem Photobiol B 49(1):1-17.
15 Passarella S, Perlino E, Quagliriello E. 1983. Evidence of changes, induced by HeNe laser irradiation, in the optical and biochemical properties of rat liver mitochondria. Bioelectrochem. Bioenerg 10:185-198.
16 Passarella S, Casamassima E, Molinari S, Pastore D, Quagliariello E, Catalano IM, Cingolani A. 1984. Increase of proton electrochemical potential and ATP synthesis in rat livermitochondria irradiated in vitro by helium-neon laser. FEBS Lett 175(1):95-99.
17 Bagis S, Comelekoglu U, Sahin G, Buyukakilli B, Erdogan C, Kanik A. 2002. Acuteelectrophysiologic effect of pulsed gallium-arsenide low energy laser irradiation on configuration of compound nerve action potential and nerve excitability. Lasers Surg Med 30(5):376-380.
18 Karu T. 1999. Primary and secondary mechanisms of action of visible to near-IRradiation on cells. J Photochem Photobiol B 49(1):1-17.




