Las roncopatías son una manifestación del Síndrome de la Apnea-Hipopnea del Sueño (SAHS), el cual se caracteriza por una oclusión repetitiva total o parcial de las vías aéreas superiores durante el sueño, lo que genera una desaturación de oxígeno. Se ha descrito una relación significativa entre el SAHS y el incremento en la tasa de morbi-mortalidad debido a problemas cardio y cerebro-vasculares y aumento del riesgo de accidentes de tráfico y laborales.
El SAHS y el ronquido aparecen frecuentemente asociados al sexo masculino, obesidad y hábitos como el tabaquismo o el consumo de alcohol.
Al margen de la reciente eclosión de diversas propuestas terapéuticas basadas eminentemente en pruebas empíricas, actualmente no se ha establecido un protocolo sistemático con pautas claras e inequívocas para el tratamiento del SAHS.
En el presente artículo proponemos un esquema de tratamiento desde el punto de vista odontológico, basado en la fabricación de placas intraorales que combinan protrusión mandibular y depresión lingual para favorecer la apertura del istmo de las fauces, lo que, previsiblemente, mejorará el paso del aire y dificultará la vibración del paladar blando sobre la pared posterior de la faringe.
Palabras clave:
Roncopatía, Apnea, Hipopnea, SAHS, dispositivo de avance mandibular.
Introducción:
Actualización sobre diagnóstico y tratamiento del SAHS
El síndrome de la Apnea Hipopnea del Sueño (SAHS) consiste en un cuadro patológico de origen multifactorial caracterizado por la aparición de episodios repetidos de obstrucción de las vías aéreas superiores. Se denomina Apnea a la obstrucción completa de las vías respiratorias que conlleva una interrupción momentánea de la respiración e Hipopnea a la obstrucción parcial de dichas vías. En ambos casos, ocurre un colapso del velo del paladar y/o lengua, que chocan contra la pared posterior de la faringe, originando la oclusión durante el sueño que se traduce en el ronquido al forzar la entrada de aire durante la inspiración siendo éste la manifestación más evidente del SAHS.
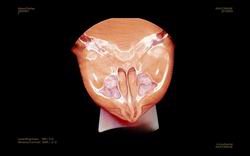 |
| Figura 1. Sección craneal horizontal en la que se aprecian los tejidos blandos a nivel de vías aéreas superiores. |
Otro dato revelador de SAHS es el cansancio y micro-sueños durante el día, causante de un mayor riesgo de accidentes laborales y/o domésticos en los pacientes que presentan este síndrome. Dicha somnolencia se debe a la ausencia de un sueño nocturno suficientemente reparador, consecuencia, a su vez, de la desaturación de oxígeno originada por las interrupciones repetidas de la respiración, que oscilan entre 10 segundos y un minuto, dependiendo del cuadro, pudiendo alcanzar una frecuencia de cientos de veces cada noche (1).
El SAHS afecta al 4-6% de los varones y al 2-4% de las mujeres entre 30-50 años (1,2) aumentando su incidencia con la edad1. Se ha documentado que el SAHS puede causar hipertensión arterial (3,4), diabetes tipo II (5), enfermedades cardiovasculares (2, 6) y accidentes cerebrovasculares, aumentar el riesgo de muerte (7) y favorecer accidentes de tráfico debido a los micro-sueños diurnos que sufren estos pacientes (8, 12), además de los mencionados altercados laborales y domésticos.
1.1. Diagnóstico del SAHS
El primer indicador de SAHS es la existencia del ronquido. Cuando un paciente ronca, es importante efectuar un diagnóstico adecuado del alcance del síndrome. Por ello el odontólogo deberá incluir la pregunta ¿usted ronca? en la Historia Clínica que realiza de modo rutinario a sus pacientes. En caso de respuesta afirmativa, proseguirá con la anamnesis, exploración y monitorización que permita la identificación de SAHS.
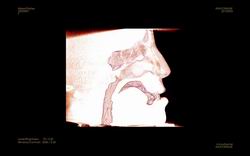 |
| Figura 2. Corte craneal sagital en el que se visualizan las vías respiratorias superiores. |
Para diagnosticar el SAHS resulta esencial comenzar con una anamnesis completa a fin de detectar co-morbilidad cardiovascular, cerebrovascular y posibles implicaciones neuropsiquiátricas. En caso de identificar la presencia de alguna de estas alteraciones, el paciente será derivado al neumólogo para que sea monitorizado y atendido en medio hospitalario. El odontólogo tan sólo tratará casos leves a moderados sin complicaciones como las mencionadas.
A continuación, se procederá a una anamnesis centrada en la propia sintomatología del SAHS para realizar un primer screening en la detección del cuadro. En primer lugar, preguntaremos por la existencia de ronquidos nocturnos, que será el dato revelador. El paciente suele referir que las personas que conviven con él se quejan de su roncopatía. Del mismo modo, nos informará si alguien que duerma con él le ha dicho que hace pausas respiratorias nocturnas. Preguntaremos por la facilidad para quedarse dormido durante el día, por la sensación de ahogo nocturno, movimientos involuntarios de extremidades mientras duerme, nicturia (más de dos veces por noche), pesadillas, impotencia sexual, dolor de cabeza al despertar, fatiga, cansancio, pérdida de memoria y falta de concentración.
Seguidamente es preciso completar una Escala de Somnolencia de Epworth (ESE) para detectar una excesiva somnolencia, lo que constituye el principal síntoma diurno identificable asociado al SAHS. Ante un ESE>10 y una sintomatología específica del SAHS identificada con las preguntas formuladas en la anamnesis dirigida, está indicado continuar con el estudio del paciente, incluyendo la monitorización cardiorrespiratoria. Una puntuación superior a 10 en la Escala de Epworth, es reveladora de SAHS por sí sola (10, 13).
A continuación se realizan fotografías de cara y boca para identificar la presencia de micrognacia y clasificar la tipología facial (en dólico, braqui- o mesofacial). A partir de las fotografías tomadas con el paciente sentado y la boca completamente abierta, se clasificará al paciente de acuerdo a los grados de Mallampati mediante la visualización de las estructuras faríngeas. Los grados de Mallampati van de I a IV de menor a mayor gravedad: Grado I (se pueden ver el paladar blando, istmo de las fauces, úvula y pilares amigdalinos); Grado II (son observables el paladar blando, el istmo de las fauces y la úvula); Grado III (tan sólo identificamos el paladar blando y la base de la úvula); y Grado IV (no se ve el paladar blando) (14).
 |
| Figura 3. Unidad portátil del Sueño (Apnea-Link®). Detalle del pulxiosímetro. |
En función de la clasificación expuesta, en caso de observar obstrucción de las vías aéreas por las características anatómicas del paciente, éste será remitido al otorrinolaringólogo.
Se realizarán también pruebas radiográficas como la Telerradiografía lateral de cráneo o ICAT cuando exista sospecha de desviación septal, o cualquier otra alteración anatómica nasal o amigdalar, como pólipos nasales, hipertrofia de cornetes, hipertrofia adenoidea y/o amigdalar. Ante la aparición de alguna de estas alteraciones en la ICAT, el paciente será remitido al especialista (Figuras 1 y 2).
Por último, es de gran utilidad que el odontólogo disponga de una unidad portátil del sueño (como Apnea-Link®), para prescribir una monitorización cardiorrespiratoria domiciliaria al paciente que ha revelado a través de la anamnesis y exploración la presencia de ronquido, una vez descartados los casos que deben remitirse al especialista.
El empleo del Apnea-Link® está muy documentado en la literatura científica para la determinación del Índice de Apneas e Hipopneas (IAH) a partir de una cánula nasal y un pulsioxímetro (15, 21) (Figura 3). Mediante este aparato puede confirmarse, de forma sencilla y cómoda, la presencia y gravedad del SAHS. El Apnea-Link® incluye un pequeño ordenador que registra, entre otros datos, los episodios de apnea, la frecuencia e intensidad de los ronquidos del paciente, que tan sólo debe pulsar un botón tras colocar correctamente la unidad portátil del sueño antes de dormir. Más allá de estos datos, el Apnea- Link® permite el estudio, durante el sueño, de parámetros respiratorios (apneas, hipopneas, respiración de Cheyne-Stokes, limitación de flujo, ronquidos, flujo inspiratorio, limitación de flujo asociada a ronquido) y cardíacos (saturación de oxigeno y pulso) y con ello determinar la presencia del SAHS y clasificar a los pacientes según la gravedad de los resultados. Por tanto, al volcar los datos a un ordenador externo, el Apnea-Link® emite un IAH a partir del cual el clínico podrá emitir un diagnóstico teniendo en cuenta la siguiente clasificación:
• IAH > 5 y ≤ 15: SAHS leve,
• IAH ≥ 15 y ≤ 30: SAHS moderado,
• IAH > 30: SAHS severo.
Tendremos en cuenta que, en principio, el campo de actuación del odontólogo se circunscribirá a los casos leves y moderados. Los casos severos deberán ser derivados al especialista.
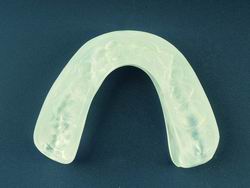 |
| Figura 4. Dispositivo DAM. |
Finalmente, para completar la Historia Clínica, teniendo en cuenta que los pacientes que padecen SAHS suelen ser varones, obesos (con índice de masa corporal superior a 30), cuello ancho (más de 40 cm) y con deficiencia mandibular; registraremos todos estos datos antropométricos.
1.2. Alternativas terapéuticas del SAHS
Actualmente existen varias modalidades para el tratamiento del SAHS. En primer lugar, el cambio de ciertos hábitos del estilo de vida, como el control del peso, la disminución de la ingesta de bebidas alcohólicas, y del tabaquismo, especialmente antes de acostarse. Del mismo modo, se recomienda al paciente que no duerma boca arriba (1,22).
Hasta que comenzó a desarrollarse el tratamiento del SAHS desde el punto de vista odontológico, la ventilación bajo presión continua positiva por vía nasal (CPAP) durante el sueño era el tratamiento de elección para el SAHS (22, 25).
Esta modalidad terapéutica actualmente continúa estando indicada en los casos más severos (22), junto a la cirugía otorrinolaringológica y/o maxilofacial, cuando el especialista correspondiente lo estima oportuno.
En los últimos años, la Odontología ha comenzado a involucrarse en el tratamiento del SAHS en casos leves y moderados. Con este propósito, se han diseñado diversos aparatos intraorales para dilatar las vías aéreas superiores y evitar la obstrucción y/o colapso que aparece durante el sueño en los pacientes afectados (26, 30).
Pese a la gran variedad de diseños propuestos, todos ellos tratan de responder al objetivo común de abrir el istmo de las fauces para hacer posible que medie un espacio entre el paladar blando y la pared posterior de la faringe, evitando su cierre o vibración mientras el paciente respira durante el sueño. Esencialmente los aparatos intraorales pueden dividirse en tres grandes grupos:
a). Elevadores del paladar blando: Equalizer (Equalizer Airway Device®) y ASPL (Adjustable Soft Palate Lifter®) (23, 31).
b). Retenedores linguales (24, 31, 32): TLD (Tongue Locking Device®) y TOPS (Tepper Oral Propioceptive Stimulator®) (23, 31), TRD (Tongue Retaining Device®) (31).
c). Dispositivos de avance mandibular (DAM) (23, 24, 31, 32). NAPA (Nocturnal Airway Patency Appliance), Snore-Guard, Herbst, IST-Herner (IST: Intraoral Snoring Treatment), SNOAR (Sleep and Nocturnal Obstructive Apnea Reducer), SAS de Zurich, Bionator, Twin-Block, Jasper-Jumper. Klearway, Silencer, MRD elásticos, Silensor. PPP (Pistas Posteriores Planas). Posicionadores elásticos de avance mandibular (31).
Los aparatos del último grupo son los más utilizados en la actualidad y como su nombre indica (DAM), generan una protrusión mandibular que abre el complejo anatómico paladar blando/faringe, con el fin de dejar libre un espacio para la circulación aérea previniendo el colapso de las vías respiratorias superiores durante el sueño. Estos aparatos pueden realizar una protrusión fija o variable, ya que en la mayor parte de las ocasiones se trata de aparatos articulados, que constan de varias piezas y permiten modificar la protrusión final. Los elevadores del paladar blando apenas se emplean, mientras los retenedores linguales han demostrado cierta eficacia.
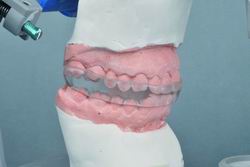 |
| Figura 5. Dispositivo DAM+DL colocado en el articulador. Se aprecia la protrusión generada. |
Justificación y objetivos del protocolo desarrollado en el Departamento de Prótesis Bucofacial de la Facultad de Odontología de la UCM y el Centro Europeo de Ortodocia, S. A. (CEOSA) para el tratamiento del SAHS
Debido a que no existe un tratamiento protocolizado para el Síndrome de la Apnea-Hipopnea del Sueño en los casos leves a moderados, consideramos que la actuación del odontólogo en este grupo de pacientes es fundamental de cara a permeabilizar las vías aéreas superiores previniendo la aparición de patologías asociadas y evitar el ronquido, que dificulta el descanso nocturno no sólo del propio paciente, sino de las personas que le rodean.
Pensamos que el problema comienza por realizar una clasificación certera de los pacientes según la gravedad del trastorno, ya que el odontólogo podrá actuar en los casos leves y moderados que no requieran ventilación asistida y/o intervenciones quirúrgicas.
Además, y como aportación, queremos ensayar aparatos monobloques, protrusiones mínimas eficaces para permeabilizar vía aérea, el posible efecto de la contención lingual y el empleo de materiales elásticos para su confección.
Por tanto, planteamos la realización un estudio clínico con los siguientes objetivos:
1. Realizar una selección inicial para la detección de pacientes con SAHS mediante un formulario que recoge varios ítems con los síntomas más comunes.
2. Clasificar a los pacientes que padecen SAHS mediante el test de Epworth y el Apnea-Link® (AL) según el registro basal inicial en casos leves, moderados y severos.
3. Investigar si existe correlación entre las clasificaciones obtenidas mediante el test y la interpretación los registros del AL.
4. Estudiar la respuesta a las siguientes terapias odontológicas de los casos leves y moderados:
a. Dispositivo de Avance Mandibular tipo Posicionador.
b. Dispositivo de Avance Mandibular con depresor lingual.
5. Analizar qué tratamiento es el más indicado en los casos leves de SAHS
6. Identificar qué tratamiento es el más eficaz en los casos moderados de SAHS.
7. Identificar factores que condicionen la terapia.
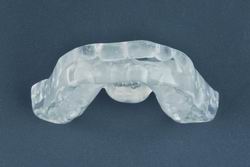 |
| Figura 6. Dispositivo DAM+DL. Visión frontal. Se aprecia el Depresor Lingual (DL) que parte del paladar y llega aproximadamente a la altura del plano oclusal superior del paciente. |
Material y método
Tras una exhaustiva revisión bibliográfica y puesta al día sobre el tema objeto de estudio, y basándonos en los resultados publicados en la literatura, hemos diseñado y comenzado a aplicar el siguiente protocolo para el diagnóstico y tratamiento del Síndrome de la Apnea-Hipopnea en casos leves a moderados, en el Departamento de Prótesis Bucofacial de la Facultad de Odontología de la UCM y la Clínica Cervera.
Por tanto, todo paciente participante en el estudio pasará por el siguiente protocolo:
1. Historia clínica. Screening inicial mediante un test de somnolencia de creación propia y aplicación del test de Epworth. Explicación de la secuencia clínica a seguir, así como de las posibles complicaciones o efectos secundarios. Solicitud de firma de un consentimiento informado.
2. Toma de impresiones, registro de arco facial y ceras en relación céntrica y protrusiva. Montaje de modelos en articulador semiajustable e individualización de Trayectorias Condíleas. Programación de una protrusiva de 5mm en el articulador. Colocación del pin incisal a +3mm, que será la altura de los dispositivos en todos los casos.
3. Registro basal ambulatorio de parámetros iniciales del paciente con Apnea Link®.
4. Fabricación del DAM (Fig. 4) con 5mm de protrusión.
5. Prueba y entrega del DAM. Se revisará la adaptación. En caso de detectar zonas de presión, se desbastarán con las fresas apropiadas montadas en pieza de mano. El paciente portará el DAM todas las noches durante un mes. Se le indican al paciente consejos de conservación y limpieza.
6. Al finalizar este período, se tomará un nuevo registro de Apnea Link® con el DAM colocado en la boca.
7. Tras este primer mes, el paciente dormirá sin el aparato durante una semana (período de aclaramiento).
8. Nueva monitorización con Apnea Link® sin ningún dispositivo bucal durante la noche (segundo registro basal).
9. Fabricación del DAM+DL con 5mm de protrusión (Figs. 5-7).
10. Prueba y entrega del DAM+DL. Se revisará la adaptación. En caso de detectar zonas de presión, se devastarán con las fresas apropiadas montadas en pieza de mano. El paciente portará el DAM+DL todas las noches durante un mes. Se le indican al paciente consejos de conservación y limpieza.
11. Al finalizar este período, se tomará un nuevo registro de Apnea Link® con el DAM+DL colocado en la boca.
12. Recogida y análisis de datos.
Resultados
Con los registros recogidos por la unidad del sueño portátil podremos evaluar:
a) La gravedad del cuadro de SAHS en leve, moderado o grave;
b) La efectividad objetiva de cada placa y su utilidad.
Cuando el estudio haya finalizado, se realizará un análisis estadístico de los resultados obtenidos, teniendo en cuenta diversos factores de los sujetos involucrados en el estudio, como la edad, sexo, nivel basal de apnea-hipopnea, características maxilofaciales, etc., a fin de extrapolar los resultados y encontrar el fundamento científico del empleo de estos aparatos, que hasta la fecha, se han comercializado en muchas ocasiones de forma empírica a través de modelos estandarizados o universales en principio válidos para cualquier paciente.
Debido a la gran cantidad de factores que influyen en la aparición del síndrome (sobrepeso, tabaquismo, hábitos, etc.), es por lo que nos ha parecido interesante incluir el objetivo de describir los factores que hayan sucedido durante el experimento, que aunque previsiblemente no tendrán valor estadístico, sí podrán aportar experiencia clínica.
Discusión y conclusiones iniciales del estudio
En el desarrollo del protocolo hemos hecho especial hincapié en los siguientes puntos.
1. Monitorizar al paciente antes y después de la aplicación de cada tratamiento mediante el Apnea-Link®.
2. Fabricar y colocar un Dispositivo de Avance Mandibular (DAM), que genere un cierre en protrusiva de 5mm, siguiendo la “Ley del mínimo esfuerzo eficaz”, en Fisiología.
3. Contrastar el efecto de esta placa, con otro dispositivo intraoral que junto a la protrusión mandibular incorpora la depresión lingual (DAM+DL), para favorecer la apertura de las vías aéreas superiores.
4. Ambas férulas (DAM y DAM+DL), se fabrican en un dispositivo único o monobloque, empleando dos materiales elásticos para su confección (goma EVA y metacrilato respectivamente).
Con los parámetros recogidos, analizaremos que dispositivo arroja mejores resultados tras la monitorización con el Apnea-Link®. En los casos en que la evolución no fuese la deseada o apareciesen efectos secundarios relevantes a nivel articular o dentario, habría que plantear posibles modificaciones en el diseño de las placas intraorales o bien derivar al paciente al neumólogo para valorar la necesidad de una máquina de CPAP.
A la espera del aumento de la población de estudio para un análisis estadístico más riguroso, los resultados iniciales son prometedores con ambos dispositivos testados.
Los primeros datos revelan que las características basales de los pacientes pueden ser clave en la elección del diseño apropiado para el tratamiento de las roncopatías.
Se repite como indicador frecuente la satisfacción de las personas que conviven con el paciente, que refieren que han dejado de escuchar los ronquidos con el uso de estos dispositivos.
Una vez concluido el estudio, estableceremos una comparativa con los resultados de los estudios publicados hasta la fecha sobre el particular, teniendo en cuenta las diferencias en cuanto a metodología, diseño de los aparatos y criterios de inclusión y exclusión aplicados en cada caso.
Correspondencia
Mónica Simón Pardell
Clínica Cervera. C/ Juan Montalvo, 8. 28040 Madrid.
Departamento de Prótesis. Facultad de Odontología UCM.
(Srta. Mª José).
Artículo realizado por:
Mónica Simón Pardell
Doctoranda UCM
Práctica exclusiva en Ortodoncia.
Clínica Cervera, Madrid.
Raquel Castillo de Oyagüe
Profesora Asociada. Departamento de Prótesis Bucofacial.
Facultad de Odontología, Universidad Complutense de Madrid, U.C.M.
Alberto Cervera Sabater
Director del Departamento de Ortodoncia.
Clínica Cervera, Madrid.
Jaime del Río Highsmith
Catedrático. Departamento de Prótesis Bucofacial.
Facultad de Odontología, Universidad Complutense de Madrid, UCM
Bibliografía
1. León Miranda V, Sánchez Armengol A, Ruiz García A, Carmona Bernal C, Botebol Benhamou G, Capote Gil F. Severe obstructive sleep apnea syndrome in a toddler. Arch Bronconeumol 2007;43(5):289-291.
2. Stradling JR, Davies RJ. Sleep. 1: Obstructive sleep apnoea/hypopnoea syndrome: definitions, epidemiology, and natural history. Thorax 2004; 59 (1): 73-78.
3. Durán Cantollá J, Puertas FP, Pin-Arboledas G, Santa María J y Grupo Español de Sueño (GES). Documento de Consenso Nacional sobre el Síndrome de Apneas-Hipoapneas del sueño. Arch Bronconeumol 2005; 41 Supl 4: 12-29.
4. Young T, Palta M, Dempsey J, Skatrud J, Weber S, Badr S. The occurrence of sleep-disordered breathing among middle-aged adults. N Engl J Med 1993; 328: 1230-1235.
5. Mendelson WB. The Relationship of Sleepiness and Blood Pressure to Respiratory Variables in obstructive Sleep Apnea. Chest 1995; 108: 966-972.
6. Hla KM et al. Sleep apnea and hypertension. A population-based study. An Intern Med 1994; 120: 382-388.
7. Cappuccio FP et al. Quantity and quality sleep and incidence of type 2 diabetes. A systematic review and meta-analysis. Diabetes Cae 2010; 33: 414-420.
8. Guilleminault C, Tilkian A, Dement WC. The sleep apnea syn¬dromes. Anu Rev Med 1976; 27: 465-484.
9. He J, Kryger MH, ZorickFJ, Conway W, Roth T. Mortality and apnea index in obstructive sleep apnea. Experience in385 male patients. Chest 1988; 94: 9-14.
10. Findley LJ, Unverzagt ME, Suratt PM. Automobile accidents involving patients with obstructive sleep apnea. Am Rev Respir Dis 1988; 138: 337-340.
11. Barbé F, Pericás J, Muñoz A, Findley L, Antó JM, Agustí AGM etal. Automobile accidents in patients with sleep apnea syndrome: An epidemiological and mechanistic study. Am J Respir Crit Care Med 1998; 158: 18-22.
12. Findley LJ, Weiss JW, Jabour ER. Drivers with untreated sleep apnea: a cause of death and serious injury. Arch Intern Med 1991; 151: 1451-1452.
13. Strollo PJ Jr., Rogers RM. Obstructive sleep apnea. N Engl J Med 1996; 334: 99-104.
14. Terán Santos J, Jiménez Gómez AJ, Cordero Guevara JC. The Cooperative Group Burgos-Santander. The association between sleep apnea and the risk of traffic accidents. N Engl J Med 1999; 340: 847-851.
15. Uribe Echevarría EM, Alvarez D, Giobellina R, Uribe Echevarría AM. Valor de la escala de somnolencia de Epworth en el diagnostico del síndrome de apneas obstructivas del sueño. Medicina (Buenos Aires) 2000; 60 (6): 902-906.
16. Carlos-Villafranca F, Cobo-Plana J, Macías-Escalada E, Martínez J. Vía aérea difícil: interacciones entre ortodoncia y anestesiología. RCOE 2005; 10 (1): 187-192.
17. Ng, SS; Chan TO; To KW; Ngai J, Tung A, Ko FW; Hui DS. Validation of a portable recording device (ApneaLink) for identifying patients with suspected obstructive sleep apnoea syndrome. Intern Med J 2009; 39 (11): 757-762.
18. Milton K, Erman MD, Stewart D, Einhorn D, Gordon N, Casal E. Validation of the ApneaLink™ for the Screening of Sleep Apnea: a Novel and Simple Single-Channel Recording Device. J Clin Sleep Med 2007; 3 (4): 387-392.
19. Weinreich G, Armitstead J, Töpfer V, Wang YM, Wang Y, Teschler H. Validation of ApneaLink as Screening Device for Cheyne-Stokes Respiration. Sleep 2009; 32 (4): 553-557.
20. Clark AL, Crabbe S, Aziz A, Reddy P, Greenstone M. Use of a screening tool for detection of sleep-disordered breathing. J Laryngol Otol 2009; 123 (7): 746-749.
21. Erman MK, Stewart D, Einhorn D, Gordon N, Casal E. Validation of the ApneaLink for the screening of sleep apnea: a novel and simple single-channel recording device. J Clin Sleep Med 2007; 3 (4): 387-392.
22. Chen H, Lowe AA, Bai Y, Hamilton P, Fleetham JA, Almeida FR. Evaluation of a portable recording device (ApneaLink) for case selection of obstructive sleep apnea. Sleep Breath 2009; 13 (3): 213-219.
23. Ragette R, Wang Y, Weinreich G, Teschler H. Diagnostic performance of single airflow channel recording (ApneaLink) in home diagnosis of sleep apnea. Sleep Breath 2009 Aug 28 (Epub ahead of print).
24. Abad Fernández A, De Miguel Díez J, Jara Chinarro B. Dispositivos orales en el tratamiento del síndrome de apnea-hipopnea del sueño. Rev Patol Respir 2007; 10 (1): 16-21.
25. Hoffstein V. Review of oral appliances for treatment of sleep-disordered breathing- Sleep Breath 2007; 11: 1-22.
26. Schimdt-Nowara W, Lowe AA, Wiegand L et al. Oral appliances for the treatment of snoring and obstructive sleep apnea: a review. Sleep 1995; 18: 501-10.
27. Cartwright RD. Predicting response to the tongue retaining device for sleep apnea síndrome. Arch Otolaryngol 1985; 111: 385-9.
28. Hammond RJ, Gotsopoulos H, Shen G, Petocz P, Cistulli PA, Darendeliler MA. A follow-up study of dental and skeletal changes associated with mandibular advancement splint use in obstructive sleep apnea. Am J Orthod Dentofacial Orthop 2007; 132: 806-14.
29. Lozano FJR, Yuguero MRS, Tovar EL, Fenoll AB. Sleep apnea and mandibular advancement device. Revision of the literature. Med Oral Patol Oral Cir Bucal 2008; 13: E549-54.
30. Gauthier L, Laberge L, Beaudry M, Laforte M, Rompré PH, Lavigne GJ. Efficacy of two mandibular advancement appliances in the management of snoring and mild-moderate sleep apnea: A cross-over randomized study. Sleep Med 2009; 10: 329-36.
31. Chan ASL, Lee RWW, Cistulli PA. Dental appliance treatment for obstructive sleep apnea. Chest 2007; 132: 693-699.
32. Rodríguez Lozano FJ, Sáez Yuguero MR, Linares Tovar E, Bermejo Fenoll A. Sleep Apnea and mandibular advancement device. Revision of the literature. Med Oral Patol Oral Cir Bucal 2008; 13 (9): E549-54.





