Francisco Benet Iranzo. Médico odontólogo. Director Curso Superior / Joaquín Carmona Rodríguez. Médico odontólogo. Profesor Curso Superior / Ramiro Mallagray Martínez. Médico especialista en Estomatología y Cirugía maxilofacial. Doctor en Medicina y Cirugía. Profesor Curso Superior / José Juan Ortega López / Alfonso González de Vega y Pomar. Médico especialista en Estomatología. Profesor Curso Superior. Curso superior de Implantología Oral y Prótesis sobre implantes. Instituto de Estudios Superiores Fundación Universitaria San Pablo CEU. Madrid
Resumen
Los tratamientos con implantes osteointegrados requieren una cantidad y calidad de hueso no presente en todos los casos, por lo que se han descrito clásicamente múltiples técnicas para poder conseguirlas, destacando entre ellas, por su desarrollo en la última década, la de Regeneración Ósea Guiada.
Los principios en los que se basa dicha técnica son los desarrollados a partir de las primitivas técnicas de regeneración tisular guiada iniciadas en la década de los ochenta, y su actual evolución con la inclusión del plasma rico en factores de crecimiento, de los nuevos materiales de injerto a base de hidroxiapatitas reabsorbibles y la aparición de técnicas de barrera cada vez más eficaces, han hecho que sea la técnica de elección y de máxima aplicación en la mayor parte de los casos en los que hay que aplicar regeneración ósea periimplantaria.
En este artículo describimos la realización de la técnica de ROG con la utilización de plasma rico en factores de crecimiento y de Pepgen-P15©, en aquellos casos en los que esté indicado para su aplicación en implantología.
Introducción
El trabajo de Nyman et al 1 fue el pionero en aplicar el concepto de membranas para lograr una nueva inserción de epitelio. En un principio se aplicaron los filtros millipore que excluían el epitelio gingival y el tejido conectivo logrando así la creación de nuevas fibras de colágeno insertadas en el cemento de los dientes en cuestión. Así se fundamentó la regeneración tisular guiada en base al principio de exclusión celular, en el que se demostraba cómo las células de cada línea podían proliferar de forma independiente (Gottlow2).
La aplicación de los fundamentos de la RTG para el incremento del reborde óseo fue introducida por Dahlin 3 a principio de los ochenta, y se basa también en el principio de exclusión celular, pero en este caso el único tejido a regenerar es el tejido óseo. Numerosos autores obtuvieron resultados que hicieron considerar viable esta técnica4, 5 6, 7.
En su trabajo original, Dahlin3 establece cinco condiciones para la predictibilidad de la formación de tejido óseo aplicando las técnicas de R.O.G.
1. Presencia de células osteogénicas.
2. Adecuada vascularización.
3. Estabilidad mecánica de la zona de la herida.
4. Mantenimiento del espacio a regenerar.
5. Exclusión del tejido blando.
Estas condiciones han sido las que han dirigido los tratamientos e indicaciones de las técnicas de R.O.G. durante la pasada década, si bien la investigación en fisiología ósea y en materiales de injerto óseo han permitido que los resultados que se habían obtenido hayan sido rebasados y superados, con una eficacia indiscutible en los últimos años.
Conceptos actuales en regeneración ósea
Ante una agresión que supone una pérdida de sustancia, el organismo responde con un proceso de restauración del tejido afectado. Básicamente, el proceso se inicia con la aparición de un coágulo sanguíneo, que se va diferenciando en un tejido fibroso, el cual rellena el defecto: así, este tejido dañado no conserva ni su arquitectura ni su función original, y sus propiedades y características no se corresponden con las que previamente existían; en este caso se ha producido una reparación del tejido.
En algunos casos, el proceso de restauración tiende hacia la creación de un tejido similar al original y no hay diferencia alguna con el tejido circundante: en este caso se habla de regeneración del tejido (Robin8).
Es precisamente esta diferencia entre reparación y regeneración lo que nos lleva a estudiar cuál es la fisiología de los tejidos óseos para conseguir la regeneración, y ha sido lo que llevó a definir a Langer9 el concepto de Ingeniería Tisular.
Siguiendo a Anitua10 y a Lynch11, al igual que la regeneración de los demás tejidos del organismo, la regeneración del tejido óseo se basa en tres vértices:
— Existencia de células competentes.
— Presencia de matriz celular insoluble.
— Moléculas reguladoras de la función celular.
En el caso particular del tejido óseo también debemos considerar unos factores locales importantes, tal y como son el mecánico12 13 y el vascular3 10 11, tanto por el efecto adverso de las fuerzas que pueden incidir sobre el hueso como por la comprometida y, en ocasiones, difícil vascularización ósea.
Basándonos en los tres vértices anteriores, podemos definir en el tejido óseo tres mecanismos relacionados con la regeneración del tejido óseo:
— Osteogénesis: depende de las células competentes, en este caso los osteoblastos, cuya fuente son los injertos óseos autólogos.
— Osteoconducción: depende de la matriz celular insoluble, en este caso son los materiales que hacen de guía para el crecimiento óseo y que permiten que se deposite hueso nuevo: es el caso del hueso autólogo, las hidroxiapatitas, las cerámicas de calcio, sulfato de calcio, fosfatos de calcio, fibrinas, hueso desmineralizado y también las nuevas superficies de los implantes.
— Osteoinducción: depende de las moléculas reguladoras del metabolismo óseo, que son un grupo importante de moléculas cuyo estudio ha ocupado y ocupa una gran parte de las actuales líneas de investigación.
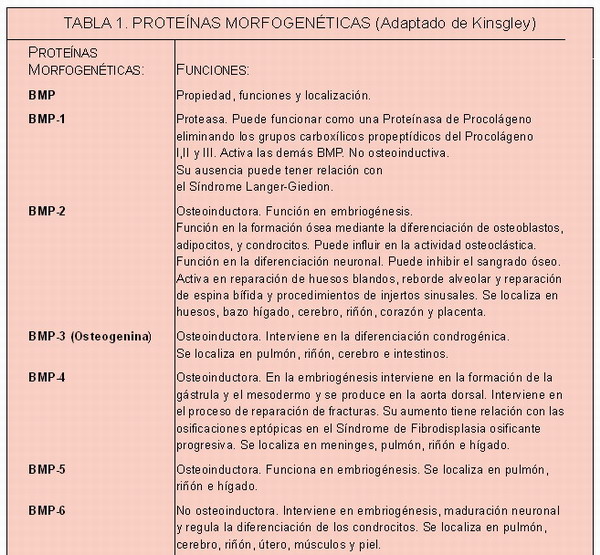

Dentro de estas moléculas cabe destacar el grupo de las proteínas morfogenéticas (BMP) —Tabla11, 14, 15— pero también hay otra serie de proteínas que están implicadas en el metabolismo óseo, como son el PDGF16, 17, FGF18, 19 , IGF20, 21, 22, 23, 24, 25 , EGF26, 27, TGF14, 15 y VEGF15 (Tabla 2).
La fuente de estas proteínas son los injertos autólogos, el plasma rico en factores de crecimiento y las BMP obtenidas mediante técnicas de ingeniería genética.

Técnicas actuales de regeneración ósea
La técnica que utilizamos actualmente para los procesos de regeneración ósea incorpora tanto los principios de Dahlin como los nuevos conceptos de regeneración ósea.
Numerosos autores han observado y comentado los resultados así obtenidos10, 11 14, 15, 20-27, en los que los resultados han sido satisfactorios.
De esta manera, el protocolo que seguimos se basa en el principio de exclusión celular y en la incorporación de los materiales necesarios para conseguir el crecimiento óseo en la zona deseada, previa preparación de un área quirúrgica con los adecuados componentes locales de estabilidad mecánica y vascular que permitan obtener el éxito requerido en los tratamientos de R.O.G.
En base a esto, describiremos la técnica a emplear en tres apartados:
- Preparación del área de trabajo.
- Exclusión celular.
- Incorporación de material de regeneración.
1. Preparación del área de trabajo
Tres son los factores locales que consideraremos:
a)Vascularización adecuada, que dependerá de:
— Diseño del colgajo, siguiendo las indicaciones típicas en cirugía, que facilitan la irrigación correcta de los tejidos.
— Localización de incisiones, que se realizarán con un margen lo suficientemente amplio, y siempre alejadas no menos de 5 mm de la zona a regenerar.
— Osteotomía atraumática, con la adecuada refrigeración y con fresas o instrumentos que no liberen metabolitos ajenos o tóxicos al medio y respetando y buscando áreas sanas de tejido óseo, en las que el sangrado sea adecuado, ya que este tejido óseo remanente será el aporte primario de células óseas.
— Asegurar cierre primario de la herida, que dependerá tanto del adecuado diseño del colgajo como de la disección realizada, ya que el cierre facilita la nutrición celular por los vasos del tejido conectivo subyacente.
b) Mantenimiento del espacio a regenerar, fundamental para obtener el volumen de hueso deseado, y que conseguiremos mediante varios métodos:
— Tornillos para crear efecto “tienda de campaña”, técnica ampliamente conocida, pero que en ocasiones resulta complicada llevar a la práctica.
— Automantenimiento por la morfología del defecto, lo que ocurre fácilmente en fenestraciones periimplantarias y en la regeneración de las áreas postextracción.
— Mantenimiento por el material de injerto, técnica simple y eficaz, que muchas veces se solapa, o, mejor, complementa a la anterior.
— Mallas de titanio adaptables, que empleamos en los casos de injertos tipo onlay, en los que por sus características el colapso de área a regenerar por los tejidos sería inevitable.
c) Prevención de las complicaciones de origen local.
— Asegurar área desbridada convenientemente, sin restos de tejidos blandos ni inflamatorios.
— Eliminar cualquier microorganismo patógeno con tratamiento antibiótico previo, evitando realizar técnicas de ROG si no hay constancia de que el área está completamente estéril.
— Tratamiento postoperatorio adecuado, que debe incluir: cuidados postoperatorios:
- Tratamiento antibiótico SIEMPRE.
- Utilización de colutorios y geles de Clorhexidina.
- Aplicación de compresas frías localmente.
- Utilizar tratamiento antiinflamatorio con corticoides si es necesario.
- Mantener una exquisita higiene oral.
- No fumar.
2. Exclusión celular
Se basa en la utilización de membranas oclusivas al paso de las células, perfectamente adaptadas y estables en el área del defecto a cubrir.
Los requisitos que deben cumplir las membranas o barreras que se empleen para las técnicas de Regeneración fueron establecidos por Harwick 28 y se basan en:
Evitar la penetración celular a través de la membrana (barrera física).
Debe tener rugosidad que sirva de matriz para la proliferación de células óseas.
Debe tener capacidad oclusiva para aislar el defecto óseo.
Alto grado de biocompatibilidad.
Manejo clínico sencillo.
En cuanto al tipo de membranas a utilizar, clásicamente13 se han dividido en:
a) Membranas no reabsorbibles.
— Polímeros no reabsorbibles.
— PTFe: Gore-Tex.
Polipropileno.
— Etil-Celulosa: Filtros Milipore.
— Mallas y membranas de titanio.
b) Membranas reabsorbibles
— Membranas de colágeno.
— Autógenas: de fascia lata o m. Temporal.
— Alógenas: de duramadre (tutoplast).
— Xenógenas: de origen bovino o equino: Paroguide, Bio Guide.
— Copolímeros de ácido Glicólico y láctico: Poliglactina 910 (Vicryl).
— Ácido poliláctico y éster de ácido cítrico: Guidor.
— Ácido poliláctico: Attrisorb.
— Ácido poliláctico y poliglicol: Resolut.
— Poliuretano y otros.
— Láminas de hueso.
— Membranas de fibrina autóloga.
La técnica de manipulación de membranas es sobradamente conocida, pero, siguiendo a Romero13, caben destacar una serie de principios:
1. Bordes de membrana redondeados y sobrecontorneando el área a cubrir al menos 3 mm.
2. Se debe asegurar tejido estable, suficientemente grueso y bien vascularizado.
3. Manipulación cuidadosa del colgajo.
4. Proveer espacio adecuado para la regeneración.
5. Suturas sin tensión.
6, Cuidados postoperatorios adecuados.
7. Mantener un adecuado periodo de maduración, en función del área a regenerar y de las características de cada membrana.
3. Incorporación del material de regeneración
Como hemos indicado antes, la regeneración ósea se basa en los tres vértices de todo proceso regenerativo, que aplicado al tejido óseo hará que sea preciso potenciar cada uno de ellos, y por eso incidiremos en cada una de las tres vertientes:
a) Osteogénesis
Para que se produzca es necesaria la presencia de células óseas, y por ello diferenciaremos dos tipos de aporte:
Aporte primario: son las células residuales presentes en los márgenes del área a regenerar. Su número varía según la zona que se trate de regenerar, siendo estas más numerosas y con mayor potencial en aquellos huesos de densidad D2 de la escala de Atwood.
Aporte exógeno: son las células procedentes del propio paciente, transplantadas desde otra localización diferente (autoinjerto) y que procuraremos que siempre estén presentes en nuestros injertos.
Las áreas donantes de estas células son variadas, pudiendo ser tanto intra como extraorales, y a su vez la forma de recogida puede variar siendo tanto en bloques de hueso fragmentado como monocorticales12.
b) Osteoinducción
Para que esta se produzca es necesaria la presencia de moléculas reguladoras del metabolismo óseo.
Como ya hemos comentado, las BMP serían nuestras moléculas de elección, pero pese a la importante labor de investigación desarrollada, en especial con la rh-BMP2, todavía no se hallan disponibles, por lo que en lugar de trabajar con estos factores de diferenciación que actúan directamente sobre las células precursoras, utilizaremos otra serie de factores que favorecen el proceso regenerativo (factores de crecimiento), incidiendo en los fenómenos implicados en la fisiología del metabolismo óseo.
Muchos de estos factores de crecimiento han sido aislados en los gránulos alfa de las plaquetas, por lo que podemos tener una fuente sencilla de factores de crecimiento a partir de dichas células29, 30 .
Desde hacía tiempo se había estado trabajando con adhesivos de fibrina31 y su utilización promovía la reparación del tejido y el cierre de la herida de una manera eficaz32, 33, así como de su papel en los injertos de hidroxiapatita34 y de su aplicación en las exodoncias35. En 1994 Tayapongsak36 describió la utilización del adhesivo de fibrina autólogo, pero la dificultad de su obtención y aplicación, hicieron que se buscaran nuevas vías.
En este contexto, aparecen los trabajos destinados a conseguir los concentrados de plaquetas: el Plasma Rico en Plaquetas (P.R.P.) cuya evolución y desarrollo corresponden al equipo del doctor Marx37, pero este sistema adolecía de una serie de problemas (elevado volumen de sangre necesario, técnica compleja, necesidad de emplear trombina bovina, elevados costes, etc.) que no hacían que su uso fuera aplicable a la Cirugía Oral ambulatoria.
De esta manera aparecen los trabajos de Anitua29, 30 encaminados a conseguir un plasma rico en plaquetas y con todas las proteínas y factores de coagulación plasmáticos (P.R.G.F.), utilizando un método de fácil aplicación en clínica ambulatoria, y con una técnica reproducible38 .
El interés de este coágulo se debe a que con él conseguimos un sueño: el tener una malla de fibrina autóloga empapada de factores de crecimiento39. El papel de las plaquetas resulta, pues, fundamental, ya que funcionan como vehículos portadores de factores de crecimiento y de otras proteínas que desempeñan un importante papel en la biología ósea: fibronectina y proteínas adhesivas38.
Siguiendo el protocolo de Anitua38 en el agregado plaquetario se pueden encontrar una serie de factores de crecimiento:
Factor de crecimiento derivado de las plaquetas (PDGF)16, 17.
Existen tres tipos: el PDGF-AA, PDGF-BB y PDGF-AB. Estos factores funcionan porque las células poseen receptores PDGFa para los AA y AB y PDGFb para los BB y AB.
El PDGF-AB aumenta la síntesis de colágeno.
El PDGF-BB hace que aumente el tejido óseo.
El PDGF-AA tiene una función quimiotáctica para las células del tejido conjuntivo, aunque también posee esta función y con mayor potencia el BB.
Factor de crecimiento derivado de la insulina (IGF)20, 21, 22, 23, 24, 25
Hay dos tipos: el IGF-I y el IGF-II. Puede ser sintetizado con los osteoblastos y se ha demostrado que el activo a nivel de crecimiento óseo es el IGF-I. El IGF-I y el PDGF-BB tienen efecto sinérgico e inducen la proliferación celular y hacen que se secreten componentes de la matriz extracelular.
La combinación de PDGF-BB e IGF-I se ha demostrado que es terapia efectiva para el crecimiento óseo.
Factor de crecimiento epidérmico (EGF)26, 27
Se ha aislado en glándulas salivares, líquido amniótico y líquido cefalorraquídeo. Estimula la síntesis de DNA y el crecimiento celular, así como las síntesis de prostaglandinas y la reabsorción ósea.
Sólo se han realizado estudios in vitro que han demostrado el aumento de la migración celular y también se ha demostrado que tiene un efecto dosis-dependiente.
Factor de crecimiento transformador (TGF)14.
La forma activa es el TGFB. Se ha aislado en plaquetas y hueso y es el mayor regulador de la duplicación y diferenciación celular y puede llegar a estimular o inhibir el crecimiento celular.
Puede ser alterado por otros factores: PDGF, EGF y FGF. Sus funciones son las de aumentar la proliferación de las células mesequimatosas y disminuir la proliferación de las células epiteliales. También tiene un efecto quimotáctico sobre los fibroblastos y aumenta las mitosis de las células óseas.
Factor de crecimiento vascular endotelial (VEGF)21.
Es una proteína que mantiene una similitud del 24 por ciento con el PDGF-B, si bien se une a receptores diferentes que ésta.
No están claras sus funciones, si bien su papel parece limitarse al estímulo angiogénico, por lo que su papel en los procesos de regeneración ósea resulta evidente.
c) Osteoconducción
Para que se produzca, es necesario que esté presente una trama que haga de “andamiaje” para dirigir la formación del tejido óseo. El material necesario para ello ha sido múltiple: desde el hueso autógeno hasta las nuevas superficies de los implantes, pasando por los aloinjertos, cerámicas biocompatibles, hidroxiapatitas sintéticas, cristales bioactivos, polímeros y coral natural.
Pero de todas estas sustancias, las que han demostrado tener una mejor capacidad de osteoconducción han sido las hidroxiapatitas microporosas40, 41, 42, y por ello su uso se ha extendido notablemente durante la pasada década con excelentes resultados en las técnicas de R.O.G., siendo estas las que están indicadas para la aplicación como materiales de osteoconducción.
En este periodo se realizaron numerosos estudios para identificar y sintetizar una gran variedad de moduladores biológicos implicados en la regeneración ósea, y uno de los trabajos que mayor repercusión tuvo sobre las hidroxiapatitas microporosas fue el encaminado a localizar el área específica a la que se unen las células en la cadena del colágeno tipo I.
Se trata de una cadena peptídica formada por 15 aminoácidos, localizada entre las bases 766-780 de colágeno tipo I43. El colágeno tipo I consta de 3 cadenas, que contienen cada una 1.000 aminoácidos, por lo que estas 15 bases son el 0,5 por ciento de la cadena de colágeno44.
Esta cadena fue posible sintetizarla in vitro y se ha llamado P-15, y se combinó con una hidroxiapatita microporosa de origen bovino, obteniéndose así el producto denominado Pepgen P-15 (Ceramed USA).
Los estudios realizados45, 46 demostraron múltiples aspectos acerca de la fisiología de la unión celular con la fibra colágena, ya que la unión de las células al colágeno las inmoviliza sobre la superficie (adhesión) o las permite moverse por haptotaxis (mecanismo similar a subir una ladera). El colágeno viene a ser como la “cremallera” por la que las células migran, ya que proporciona un ambiente tridimensional y permite la normal fisiología, incluyendo el intercambio intercelular, o sea, la producción de los diferentes mediadores y sus efectos, que son los que facilitan y promueven al final la formación de tejido óseo
El P-15 funciona de manera similar a la fibra de colágeno.
El estudio realizado por Yukna RA, Krauser JT y Callan DP [Multicenter Clinical Comparison of Anorganic Bovine-Derived Mineral Matrix (ABM) Combination ABM/Synthetic Cell Binding Peptide (P-15) as a Bone Replacement Graft Material in Human Periodontal Defects] demostró también 3 importantes conclusiones:
Resultados clínicos superiores.
Material más consistente.
Evita el uso de autoinjertos.
De esta forma se demostró cómo las propiedades del Pepgen P-15 son similares a la de la fibra de colágeno.
Indicaciones de la R.O.G. en Implantología
Las indicaciones de R.O.G. en implantología van destinadas fundamentalmente a dos fines:
a) Reparación de defectos óseos.
— Fenestraciones.
— Dehiscencias.
— Tratamiento de periimplantitis.
— Defectos postextracción.
b) Creación de tejido óseo en zonas no osificadas previamente.
— Injertos de seno maxilar.
— Injertos onlay maxilares o mandibulares.
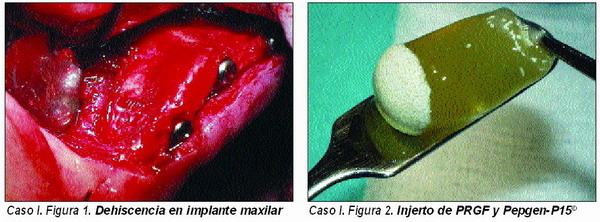
Fenestraciones (Caso 1)
Entendemos por fenestración la pérdida de continuidad puntual de alguna de las paredes óseas que rodean al implante. Habitualmente las fenestraciones se encuentran localizadas en la tabla vestibular del maxilar superior y del maxilar inferior, ya que los procesos de reabsorción hacen que el área en el que se va a insertar el implante deba invadir zonas con escaso contenido de tejido óseo.
Habitualmente se trata de áreas con hueso tipo D 3, por lo que el escaso componente celular nos va a obligar a utilizar hueso autólogo, factores de crecimiento y material osteoconductor para conseguir una adecuada regeneración.
No en todos los casos va a ser necesario la utilización de autoinjerto, ya que la escasa cantidad de tejido óseo ausente puede ser regenerada por el material osteoconductor y osteoinductor.
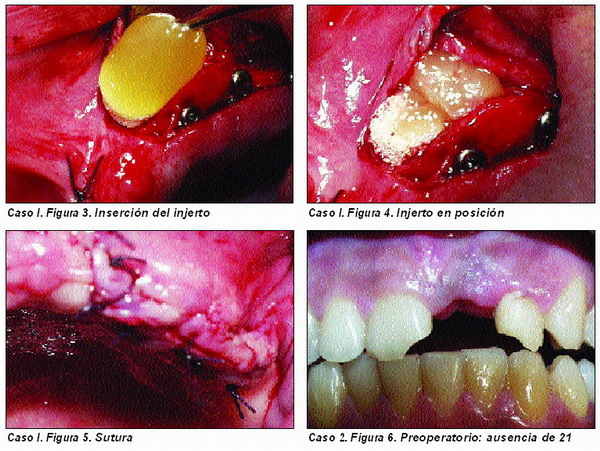
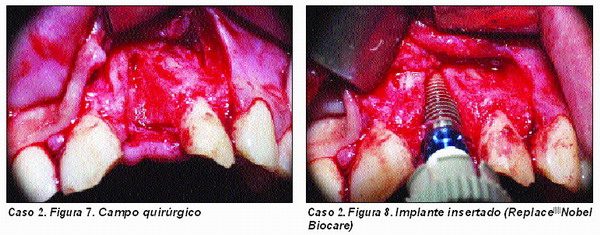
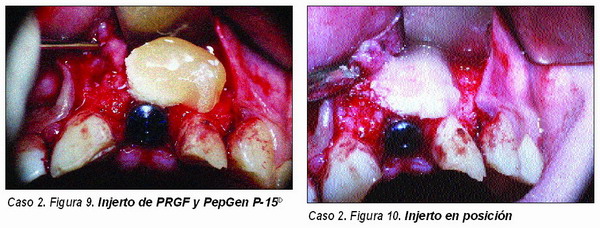
Dehiscencias (Caso 2 )
Por dehiscencia entendemos la pérdida total o parcial de una de las paredes que rodean al implante incluyendo el tercio coronal y pudiendo llegar o no hasta al ápice del implante.
Ocurre principalmente en las paredes vestibulares de la región anterior de los maxilares y generalmente en relación con áreas en las que ha habido cuadros infecciosos o traumáticos que ocasionaron la fractura de la pared vestibular y la avulsión del diente.
Al tratarse de un defecto de mayor extensión que la fenestración es necesario, en la mayor parte de los casos, la aplicación de las técnicas de regeneración ósea utilizando hueso autólogo, aparte del material osteoinductor y osteoconductor adecuados. Asimismo, la mayor extensión de este defecto obliga en muchos casos a tener que utilizar membranas oclusivas celulares que en nuestra experiencia preferimos sean reabsorbibles.
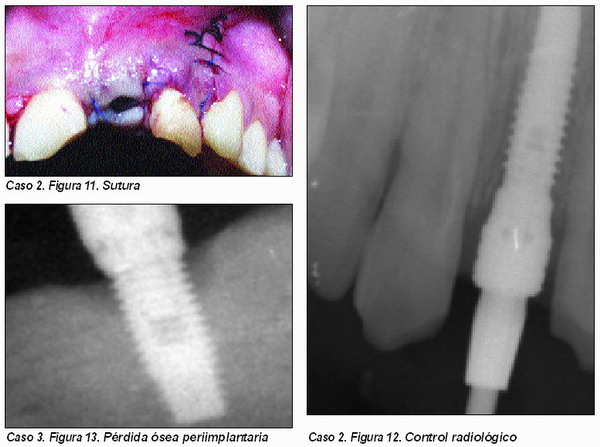
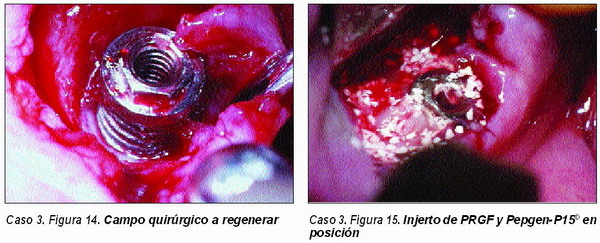
Periimplantitis (Caso 3)
El tratamiento de los defectos óseos periimplantarios presenta una amplia variedad de opciones, y entre ellas la regeneración del tejido óseo destruido es una más de las medidas a aplicar47.
En los últimos años ha habido múltiples opiniones acerca de cuál es la filosofía y la técnica a emplear para regenerar el área afectada. En nuestra experiencia trabajamos exclusivamente con injertos de material osteoconductor a base de Pepgen P-15©, tanto con membranas de titanio o reabsorbibles, como con injertos a base de Pepgen P-15© y PRGF, si bien la experiencia obtenida con este último material nos permite hablar que esta es la técnica de elección en los tratamientos de los defectos periimplantarios de grado 3.
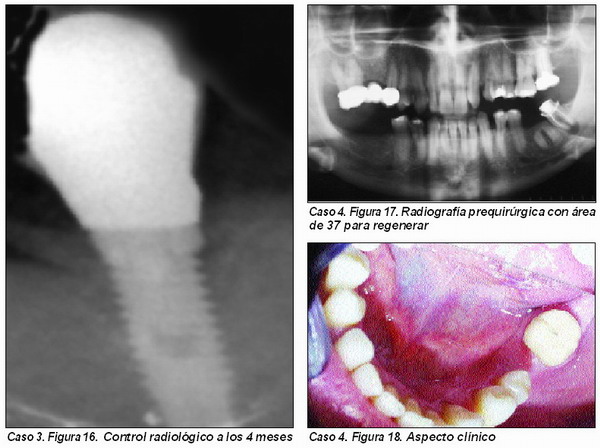
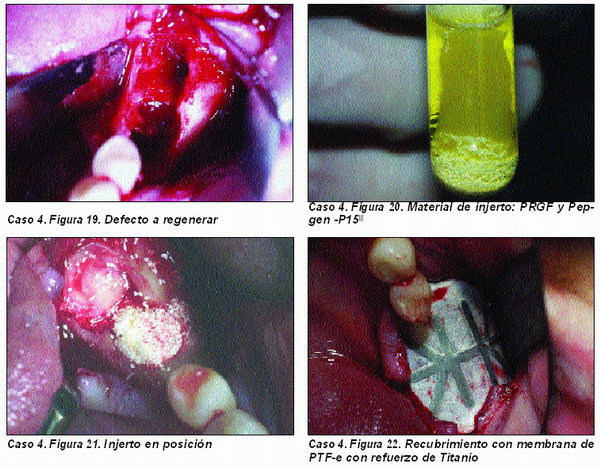
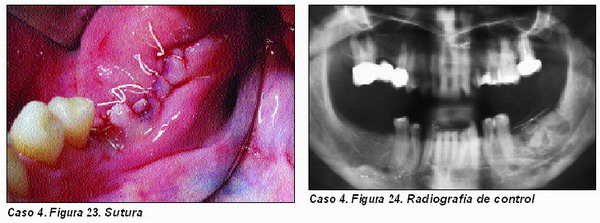
Regeneración de hueso en áreaspostextracción (Caso 4)
En múltiples ocasiones, es necesario realizar las exodoncias previamente a la inserción del implante, y no es extraño encontrar grandes defectos óseos que no es posible recuperar sin aplicar técnicas de R.O.G.
El material a emplear debe tener una gran capacidad osteoinductora, ya que la abundante celularidad de la zona nos proporciona una fuente abundante de osteoblastos, y por ello no siempre es necesaria la utilización de autoinjertos. También es fundamental facilitar la osteoconducción, por lo que el material de injerto deberá llevar el componente osteoconductor.
En cuanto a la utilización de barreras, aplicamos membranas no reabsorbibles, preferentemente con refuerzos de titanio, a fin de proporcionar la configuración anatómica deseada al área futura de implantación.
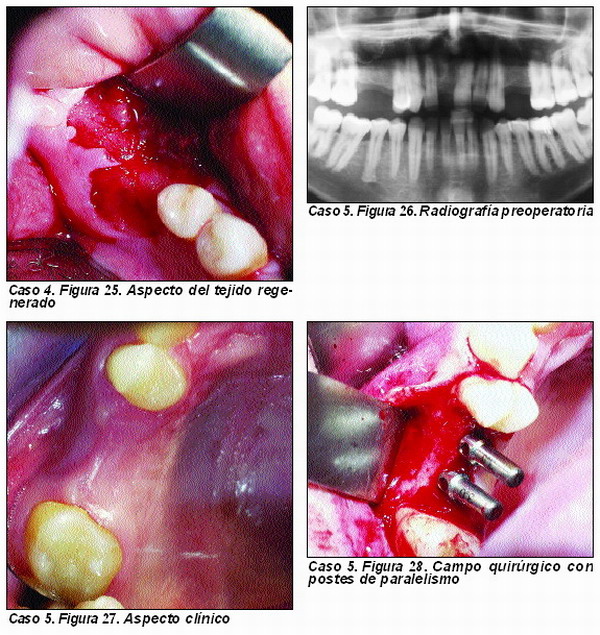
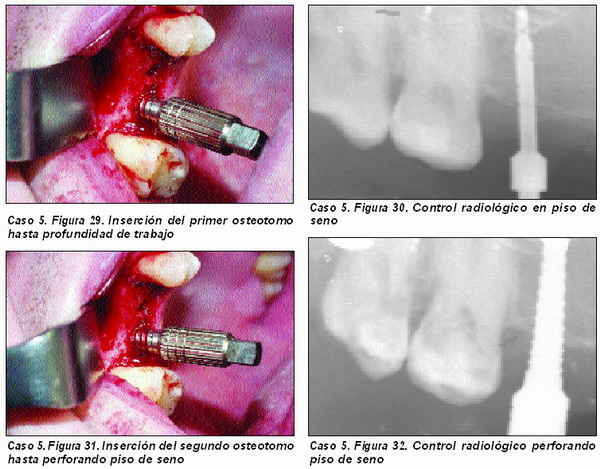
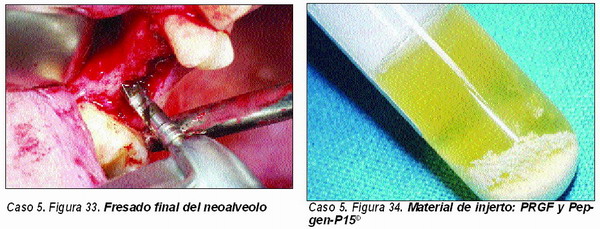
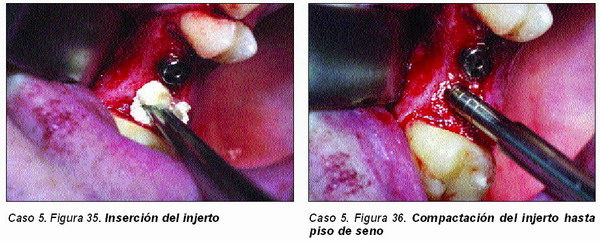
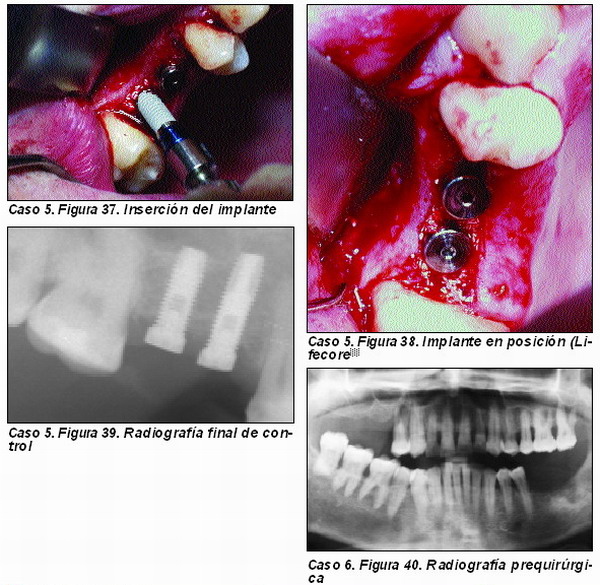
Elevación atraumática de seno (Caso 5)
La elevación atraumática de seno requiere siempre la aplicación de un injerto óseo, ya que la membrana sinusal no tiene per se capacidad osteogénica 48.
El material de injerto a utilizar ha de tener capacidades osteoinductoras y osteoconductoras, por lo que la utilización del PRGF y del Pepgen P-15© están plenamente indicadas. También es importante utilizar hueso autólogo en este caso, por lo que el injerto de elección sería el formado por hueso autólogo y PRGF, si bien el injerto anteriormente descrito cumple perfectamente su función.
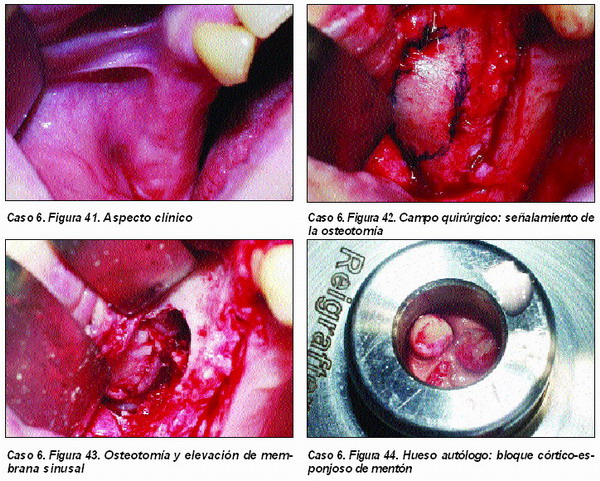
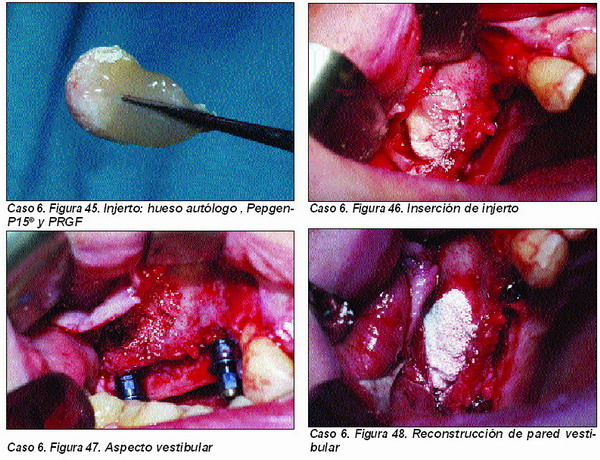
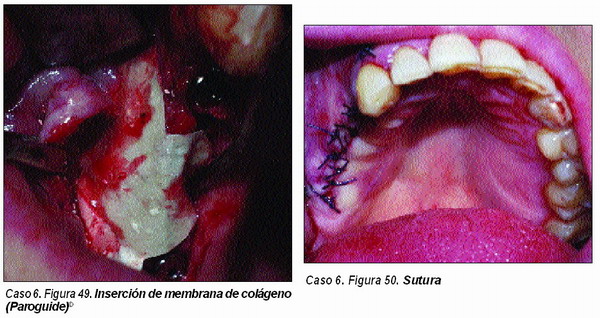
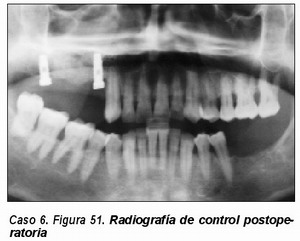
Elevación de seno maxilar convencional (Caso 6)
Empleamos habitualmente la técnica de Tatum modificada con la aplicación de membrana reabsorbible intrasinusal49 y reconstrucción de pared vestibular con membrana reabsorbible de colágeno. El material a utilizar es un injerto en el que deben estar presente tanto el hueso autólogo como el material osteoconductor (PEPGEN P15©) y elosteoinductor (PRGF).
En contra de lo publicado por numerosos autores, no utilizamos el injerto formado exclusivamente por hueso autógeno, ya que, siguiendo los principios de Boyne50, consideramos que tan importantes en la celularidad (capacidad osteogénica) del injerto como la densidad del mismo, que solamente nos es posible conseguir mediante la utilización de material osteoconductor.
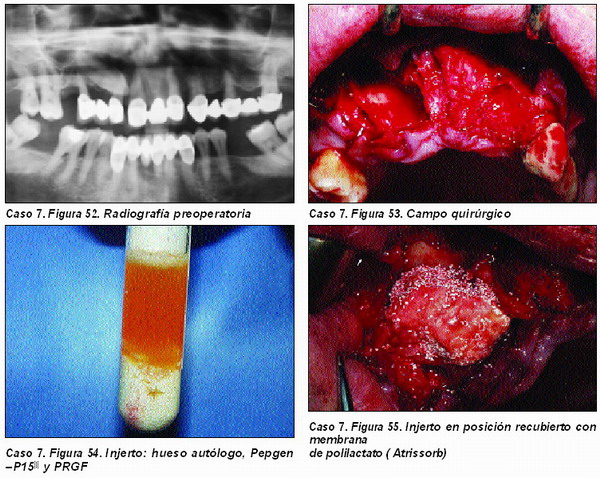
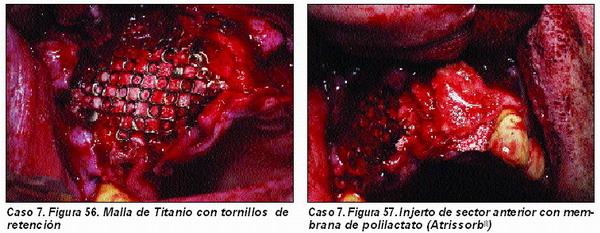
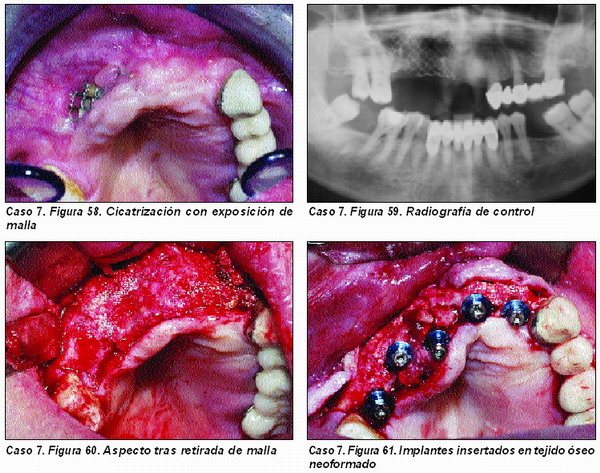
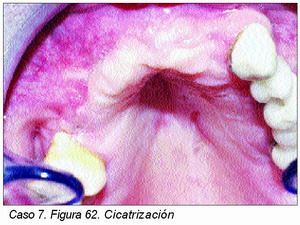
Injertos Onlay (Caso 7)
Una de las técnicas más habituales en el tratamiento de las atrofias maxilares es la aplicación de injertos tipo onlay en la superficie del área a regenerar.
La principal complejidad de esta técnica radica en el colapso que puede sufrir el material de injerto allí depositado al reposicionar los tejidos blandos en su lugar, por lo que será necesario utilizar mallas o membranas de titanio que lo impidan.
El material de injerto a utilizar deberá reunir todos los requisitos, por lo que creemos está plenamente indicado la aplicación de PRGF, Pepgen P15© y hueso autólogo, así como la utilización de membranas reabsorbibles, tanto de colágeno como de polilactatos, si bien, según la extensión del área a regenerar, también las no reabsorbibles con refuerzo de titanio pueden ser útiles.
Conclusiones
La técnica de R.O.G. en Implantología debe basarse en tres vertientes: técnica quirúrgica precisa, aplicación de los principios de exclusión celular y realización del injerto óseo correspondiente.
Las evidentes ventajas del hueso autólogo hacen que sea el material de elección como injerto, si bien su papel en la regeneración puede ser potenciado por la utilización de sustancias osteoinductoras y osteoconductoras.
Los resultados obtenidos con la técnica de P.R.G.F. han sido óptimos, ya que se ha demostrado que el refuerzo de la concentración de factores de crecimiento a través de la aplicación de P.R.G.F. mejora la reparación de tejidos blandos y la regeneración ósea38 por lo que consideramos que es la técnica adecuada para favorecer la osteoinducción.
Las hidroxiapatitas microporosas son el material de elección para favorecer la osteoconducción, si bien el Pepgen P-15© presenta una serie de importantes ventajas sobre otros materiales osteoconductores, lo que lo hace estar plenamente indicado en las técnicas de R.O.G. en Implantología. v
Bibliografía
1. Codivila A. On the means of lengthening in the lower limbs, the muscles, and tissues which are shortened through deformity. Am J Orthop Surg 1905; 2: 353-369.
1. Nyman S, Lindhe J, Karring T et al. New attachment following surgical treatment of human periodontal disease. J clin Perioodntol 1982; 9: 290.
2. Gottolow J, Nyman S, Lindhe J, Karring R, Wennstram J. New attachment formation in the human periodontium by guied tissue regeneration. J Clin Periodontol 1986; 13: 604-16.
3. Dhalin C. Scientific background of guided bone regeneration. En: Buser D, Dahlin C, Schenk RK, Guided bone regeneration in implant dentistry. Chicago: Quintessence Books; 1994.
4. Seibert L, Nyman S. Localizated ridge augmentation in dogs incorporating the principle of guided tissue regeneration. J Periodontol 1990; 31: 157-165.
5. Becker W, Becker BE. Guided tissue regeneration for implants placed into extraction sockets and for implants dehiscences: surgical techniques and case reports. Int J Periodontol 1990; 10: 376.
6. Buser D, Brugger U, Lang NP et al. Regeneration and enlargement of jaw bone using guided tissue regeneration. Clin Oral Implant Res 1990; 1: 22.
7. Jovanovic SA, Spiekermann H, richter EJ. Bone regeneration around titanium dental implants in dehisced defect sites. A clinical study. Int J Oral Maxillofac Implants 1992; 7: 233.
8. Rubin E, Farber JL. Pathology. Philadelphia: JB Lippencott, 1988.
9. Langer R, Vacanti JP. Tissue engineering. Sciencie. 1993; 260: 920-926.
10. Anitua-Aldecoa E. La utilización de los factores de crecimiento plasmáticos en cirugía oral, maxilofacial y periodoncia (P.R.G.F.) RCOE 2001; 6(3): 305-315.
11. Aguirre Zorzano LA, García Villafañe B, Remolina A, Bayona J, Santamaría Zuazua J, Estefanía Cundín E. Regeneración ósea guiada sobre implantes: Estudio clínico de intervención. Periodoncia y Osteointegración. 1999; 9: (3): 129-140.
12. Hunt DR, Jovanovic S. Recogida de hueso autógeno: técnica de injerto del mentón para bloques de hueso fragmentados y monocorticales. Revista Internacional de Odontología Restauradora y Periodoncia. 3 (2): 1999; 165-173.
13. Romero Olid MN, Olmedo Gaya MV, Vallecillo Capilla M. La utilización de membranas en cirugía bucal. Ventajas e inconvenientes. Avances en Odontoestomatología 1999; 15 (1): 9-23.
14. Kinsgley D. The TGF-beta superfamily. Genes Dev 1994; 8: 133
15. Lynch SE. Tissue Engineering. Quintessence books. 1999.
16. Zhang L, Leeman E, Carnes DC, Graves DT. Human Osteoblasts synthetize and respond to phatelet derived growth factor. Am J Physiology 1991; 261: C348-C354.
17. Hughes FJ, Aubin JE, Heersche JN. Differential chemotactic responses of different populations of fetal rata calvaria cell to platelet derived growth factor and transforming growth factor Beta. Bone Mineralización 1992; 19: 63-74.
18. Eppley BL., Connolly DT, Winkelmann T, Sadove AM, Huevelman D, Feder J. Free bone graft reconstruction of irradiated facial tissue: experimental effects of basic fibroblasts growth factor stimulation. Plastid-Reconst Surg 1991; 88: 1-11.
19. Schiliephake H, Neukam FW, Löhr A, Hutmacher D. The use of basic fibroblast growth factor (ßFGF) for enchancement of bone in growth into pyrolized bovine bone. Int J Oral-Maxillofac Implants 1995; 10: 181-186.
20. Lynch SE y cols. A combination of platelet dreived and insulin like growth factors enhances periodontal regeneration. J clin Periodont 1989; 16: 545-548.
21. García de la Fuente, AM, Estefanía Cundín E, Aguirre Zorzano LA. Actualización sobre el uso de los factores de crecimiento y proteínas en el tratamiento regenerativo periodontal (I). Revista Oficial de la Sociedad Española de Periodoncia. 1999; 9: 3: 341-354.
22. Lynch SE y cols. Effects of the platelet-derived grow factor insulin like growth factor-I combination on bone regeneration around titanium dental implants. Results of a pilot study in beagle dogs. J Periodontol 1991; 62: 710-716.
23. Becker y cols. A comparative of e-PTFE membranes alone or in combination with platelet derived growth factors and insuline like growth factor-I or demineralized freeze-dried bone in promoting bone formation around immediate extraction socket implants. J Periodontol 1992; 63: 929-940.
24. Rutheford RB, Nickrash CE, Kennedy JE, Charete MF. Platelet derived and insulin-like growth factors stimulate regeneration of periodontal attachment in monkeys. J Periodontol 1992; 27: 285-290.
25. Rutheford RB, Ryan ME, Kennedy JE, Tucker MM, Charette MF. Platelet derived growth factor and desamethasone combined with a collagen matrix induce regeneration of the periodontium in monkeys. J Clin Periodont 1993; 20: 537-544.
26. Matsuda N, Lin WL, Kumar NM, Cho MI, Genco RJ. Mitogenic, chemotactic, and synthetic responses if rat periodontal ligament fibroblastic cells to polypeptide growth factors in vitro. J Periodontol 1992; 63: 515-525.
27. Cho Mi, Matsuda N, Ramakrishnan PR, Lin Wl, Genco RJ. Differential regulation of periodontal ligament cells activities by platelet derived growth factor, insuline like growth factor-I and epidermal growth factor. En: Genco RJ, Hamda S, Lehner T, McGhee J, Mergenhangen S (eds). Molecular pathogenesis of periodontal disease. 1994; 403-414. Washington DC: American Society for Microbiology.
28. Hardwick R. Membrane design criteria for GBR of the alveolar ridge. En: Buser D, Guided Bone Regeneration in implant dentistry, Quintessence books. 1994
29. Anitua E. Resumen de comunicaciones Congreso S.E.P.A., Alicante 97.
30. Anitua E. Plasma rich in growth factors: Preliminary results of use in the preparation of future sites for implants. Int J Maxillofac Implants. 1999; 14: 529-35.
31. Matras H. The use of fibrin glue in oral and maxillofacial surgery. J Oral Maxillofac Surg. 1982; 40: 617.
32. Matras H. Fibrin seal: the state of art. J Oral Maxillofac Surg. 1985; 43: 605.
33. Matras H, Krenkel CH. Selective indications for fibrin sealing in maxillofacial surger. Abteilung fur Kieferund Gesichtschirurgie, Landeskrankenanstalten Salzburg, Müller Hauptstr. 48, A-5020 Salzburg.
34. Histological and histophysical evaluation of human fibrin glue used in association with non-absorbable hodroxylapatite –and 8- year study. G. Ferrari Parabita. División of Maxillofacial Surgery, Civil Hospital of Bresica, Italia.
35. Carmona Arroyo, F.G.; Monleón Alegre. La exodoncia en el paciente de alto riesgo hemorrágico. FM Gráfico. Barcelona. 1994.
36. Tayapongsak P, O´Brien DA, Monteiro CB, Arceo-Díaz LL. Autologous fibrin adhesive in mandibular reconstruction with particulate cancellous bone and marrow. J Oral Maxillofac Surg 1994; 52: 161-6.
37. Robert E, Marx DDS, Eric R, Carlson, DMD, Ralph M. Eichstaedt, DDS, Steeen R. Schimmele. DDS, James E. Strauss, DMD. And Karen R. Georgeff. RN. Platelet-rich plasma. Growth factor enhacncement for bone grafts. Oral Surg, Oral Med, Oral Pat. 1998: 85: 638-646.
38. Anitua, E. Un nuevo enfoque en la regeneración ósea. Plasma rico en factores de crecimiento (P.R.G.F.). Puesta al día publicaciones, S.L. 2000.
39. Anitua E. Factores de crecimiento plasmático. Una revolución terapéutica. Ideas y trabajos odontoestomatológicos. 2001; 2: 2: 90-94.
40. Stahl SS, Forum SJ. Histologic and clinical responses to porous hydroxylapatite implants in human periodontal defects: Three to twuelve months postimplantation. J Periodontol 1987; 58: 689-695.
41. Carranza FA, Jr. Keneey EB, Lekovic V, Talamante E, Valencia J, Dimitrijevic B. Histologic study of healing of human periodontal defects after placement of porous hydroxylapatite implants. J Periodontol 1987; 58: 682-687.
42. Kenney EB, Lekovic V, SaFerreira JC, Han T, Dimitrijevic B, Carranza FA Jr. Bone formation within porous hydroxilapatite implants in human periodontal defects. J Periodontol 1986; 57: 76-83.
43. Bhatnagar RS, Qian JJ, Gough CA. The role in cell binding of a betabend within the triple helical region in collagen al (I) chain: structural and biological evidence for conformational tautomerism on fiber surface. J Biomolecular Structure Dynamics 1997; 14: 547-560.
44. Sadeghi M, Qian JJ, Richards DW, Ghatnagar RS. A shyntetic peptide promotes attachment of periodontal ligament fibroblasts to anorganic bone mineral. J Dent Res 1993; 72 (Spec.Issue): 391 (Abstr. 2299).
45. Yukna RA, Callan DP, Krauser JT, Evans GH, Aichelmann-Reidy ME, Moore K, Cruz R, Scott JB. Multi-Center clinical evaluation of combination anorganic bovine-derived hydroxyapatite matrix (ABM)/cell Binding Peptide (P-15) as a Bone Replacement Graft material in human periodontal osseous defects. 6-month results.
46. Qian JJ, Bhatnagar RS. Enhanced Cell Attachment to Anorganic Bone Mineral in the Presence of a Synthetic Peptide Related to Collagen J Biomedical Materials Research, 1996; 31: 545-554.
47. Zvi A. Coronal Ridge Augmentation in the absence of bilateral bony plates around a pathologically denuded implant surface. Int J of Periodontics Restorative Dent 2000;20:191-197.Para periimplantitis
48. Summers R. The osteotome technique: Part III less invasive methods of elevating the sinus floor Compendium Cont Ed Dent. 1994; 15
49. Lozada J, Salagaray V. Técnica de Elevación Sinusal. Unidad de Prótesis Biointegrada. Madrid. 1993.
50. Boyne P. Osseous reconstruction of the maxilla and the mandible. Quintessence books.1997




