Dr. Francisco Holgado. Médico Estomatólogo. Profesor asociado de la Cátedra de Prótesis Bucofacial de la Facultad de Odontología de la U.C.M. Madrid / Dra. Esther Bellafont Santias. Médica Geriatra. Odontóloga. Barcelona / Dr. Francisco Gallegos. Médico Estomatólogo. Barcelona
Resumen
Se repasan en el artículo las diferentes técnicas para el aumento óseo en maxilar y mandíbula en la práctica de la Implantología, haciendo mención de aquellas técnicas que por su accesibilidad pueden ser tributarias de su utilización por el práctico general, incluida la obtención y utilización de los factores de crecimiento por medio de la técnica del plasma rico en plaquetas.
Palabras clave
Factores de crecimiento. Plasma rico en plaquetas. Células madre. Membranas. Material osteoconductor. Material osteoinductor.
Summary
The different techniques for the osseous increasement in the maxilla and in the mandible, in the practice of the implantology, are reviewed in the article, making mention of these techniques, that for their accessibility can be indebted to their utilization for the general practician, including the obtaining and use of the growth factors through the technique of the platelet-rich plasma.
Key words
Growth factors. Plasma rich in plaquets. Mother cells. Membrane. Osteoinductive material. Osseous lead material.
Introducción
El fin del presente artículo es la presentación y desarrollo de dos casos con grandes defectos óseos en los que utilizando las técnicas de regeneración tisular más actuales, podamos obtener unos resultados predecibles y exitosos.
Haciendo un poco de historia, recordaremos que el objetivo final en los inicios de las técnicas implantológicas no era sino conseguir la estabilización de las prótesis en la boca del paciente, imposibles de obtener por los métodos hasta entonces empleados y, en su caso, la rehabilitación dental sin el obligado sacrificio de piezas sanas.
El desarrollo de las diferentes técnicas nos ha llevado a exigir cada vez más, tratamientos conducentes a conseguir unos resultados predecibles tanto estética como funcionalmente.
La consecución de estas exigentes metas en el campo de la implantología actual, precisa, en muchas ocasiones, del concurso de técnicas habitualmente reservadas al especialista en cirugía bucal; sin embargo, el práctico general puede conocer y utilizar algunas de ellas con el objetivo final de conseguir espacio y masa ósea suficiente como para llevar a cabo tratamientos estomatológicos, que con las técnicas habituales no nos serían posibles.
Clásicamente se admite que en presencia de un defecto óseo reciente o refrescado se origina un crecimiento paralelo y competitivo entre el tejido óseo remanente y los tejidos blandos adyacentes para ocuparlo. El resultado en la mayoría de los casos es la aparición de un defecto permanente cubierto por tejido gingival.
Con el fin de modificar este proceso favorablemente, contamos con un arsenal terapéutico tanto en técnicas como en material que reconocemos en tres grupos.
El primer grupo lo formarían aquellos materiales tendentes a aislar el defecto e impedir el crecimiento del tejido conjuntivo hacia el interior del mismo.
Básicamente se consigue con la aposición de membranas (1) fabricadas convencionalmente con diversos materiales reabsorbibles (2) o no reabsorbibles (3), rígidas o adaptables, pero que todas persiguen en su caso el impedir que el crecimiento de los tejidos blandos hacia el interior del defecto ocupen el espacio en el que debe regenerarse el hueso neoformado.
Este tipo de material presenta una serie de ventajas e inconvenientes y, dada su gran variedad de posibilidades, será el especialista el que decida la utilización más idónea para cada caso concreto (4 y 5).
A una membrana, deberíamos exigirle no solamente que impida el crecimiento de los tejidos blandos hacia el defecto, sino que sea inmunológicamente compatible, que sea barata, fácil de aplicar, que permita un recubrimiento total por la mucosa y encía adherida, y que no sea posible su exposición.
Que sepamos sólo existe una membrana que reúna todas esas características y que además es muy barata: el propio periostio (6).
El segundo grupo estaría formado por aquellos materiales susceptibles de rellenar el defecto.
Para este tipo se han utilizado multitud de productos, pero la discusión reside, al igual que en el caso de las membranas, en la conveniencia o no de utilizar materiales permanentes o con capacidad de reabsorción en el tiempo, con el objetivo final de aportar únicamente volumen, o que además, presenten capacidad osteoconductora, como son el caso de las hidroxiapatitas liofilizadas (7) con las que pretendemos obtener el andamiaje suficiente por el que, en teoría, discurrirá el neohueso.
El problema estriba en que por ese andamiaje es posible igualmente el crecimiento de cualquier otro tejido, es por ello por lo que se precisará un estímulo selectivo que haga crecer exclusivamente material óseo, un inductor de crecimiento óseo.
El único material reconocido con esas características era, hasta épocas recientes, el hueso de cadáver, que al poseer proteínas precursoras del mismo, podía inducir su crecimiento (8).
El tercer grupo es el propio material osteogénico del que cada individuo es portador y por tanto el que presenta unas características más favorables para su aceptación por el organismo, puesto que solamente el material vivo es capaz por sí de generar neocélulas, y únicamente el del propio paciente ofrece la seguridad inmunológica necesaria (9).
Este material es susceptible de obtenerse, pues, de cualquier masa ósea del individuo, pero para el práctico general, la toma de muestras óseas de tejidos intraorales es una técnica de elección.
Es nuestra opinión que esta es la más conveniente, ya que vamos a utilizar hueso del mismo origen embriológico y por tanto la capacidad osteogénica es aún mayor para cada una de las zonas anatómicas elegidas.
Para este tipo de tratamientos la masa ósea necesaria la obtendremos preferentemente de las áreas retromolares tanto en maxilar como en mandíbula, consiguiendo tras su manipulación un triturado idóneo como relleno de cualquier defecto óseo.
La sínfisis mandibular es otra zona posiblemente donante, sin embargo nos ofrece un hueso muy cortical, de gran dureza y muy difícil de manipular, por lo que nosotros no recomendamos la obtención de hueso de este área.
Queremos hacer hincapié dentro de este tercer grupo en la utilización de los factores de crecimiento descrita por el doctor Eduardo Anitua Aldecoa en la obtención de concentrado de plaquetas (10) y con la que, ligeramente modificada por nosotros, conseguimos los mejores resultados en la práctica ambulatoria.
En ella, los factores de crecimiento son los mediadores biológicos que ponen en marcha el proceso de regeneración ósea, desarrollados por diferentes grupos celulares y almacenados en las plaquetas. Dentro de los mismos, los más interesantes son el factor derivado de las plaquetas, el factor de crecimiento fibroblástico y el factor de crecimiento semejante a la insulina. Con su acción conjunta se consigue el metabolismo óseo, estimular la regeneración periodontal y acelerar el proceso de cicatrización. Por lo que consideramos a los mismos los inductores de crecimiento óseo ideales.
Material y método
Justificamos con dos casos la presentación previa y el proceso que el práctico general puede seguir en la actualidad, para conseguir una regeneración ósea que nos posibilite el tratamiento prostondócico necesario y sobre todo una masa ósea suficiente para un tratamiento implantológico ideal.
En ambos podríamos haber optado por una cirugía en dos fases, pero dado los excelentes resultados que nos está aportando la actual técnica, somos partidarios de una única intervención, siempre que nos sea posible, debido a la comodidad que representa tanto para el clínico como para el paciente.
El objetivo es preparar un relleno osteogénico con material osteoinductor u osteoconductor, o una mezcla de ambos, un triturado del hueso del propio paciente, y un concentrado de plaquetas.
La mezcla así obtenida se cubrirá directamente con el periostio, procurando un cierre y sutura posterior sin tensión.
Conseguiremos de esta forma un andamiaje por el que discurrirá el crecimiento óseo iniciado en las células madre óseas del propio paciente que, a su vez, serán inducidas por los factores plaquetarios, estando todo el conjunto protegido por el propio periostio que, a su vez, como hemos visto ,presenta un poder osteogénico propio (6), que facilitará aún más una regeneración favorable.
Caso I
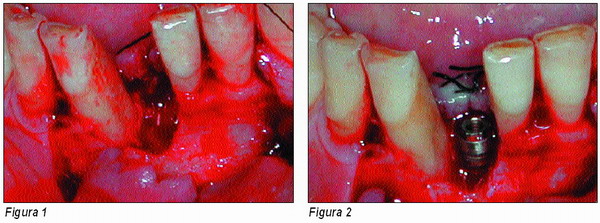
Paciente de 35 años que presenta pérdida traumática del 41 con dehiscencia anterior de la creta y reabsorción ósea a nivel del 42.
Se rehabilita con un implante Microdent, que lógicamente queda expuesto (Figuras 1 y 2).
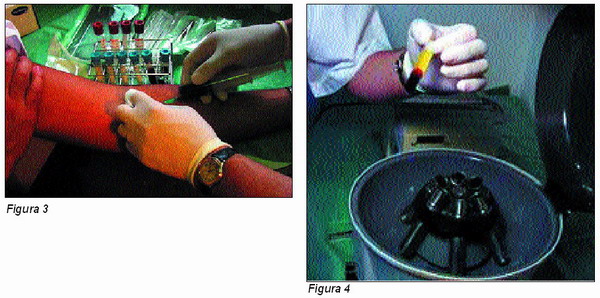
Inmediatamente antes de la intervención se obtienen 20 c.c. de sangre del propio paciente (Figura 3).
La sangre así obtenida se trasvasa a unos tubos estériles que contienen citrato sódico para evitar la hemocoagulación, centrifugándose a continuación a 3.500 r.p.m. durante 7 minutos, con el fin de obtener el plasma contenido (Figura 4).
Con un rotulador marcamos en los tubos la cantidad de plasma y lo dividimos en tres fracciones.
A continuación y con una pipeta estéril trasvasamos las dos primeras a un tubo estéril vacío, mientras que la tercera, la más cercana a la serie roja, a un segundo tubo (Figura 5). En ambos casos añadiremos al plasma así diferenciado dos gotas de cloruro cálcico al 10 por ciento por centímetro cúbico (Figura 6).
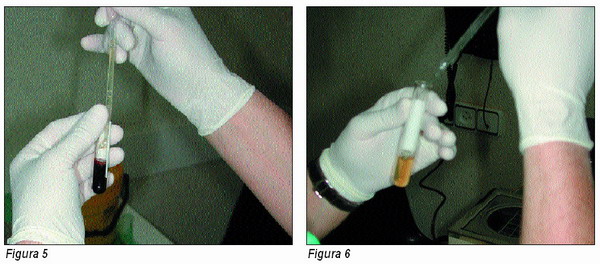
Durante el pipeteado y separación de las fracciones deberemos ser exquisitamente cuidadosos de no remover la serie roja sedimentada para evitar la hemolización del plasma diferenciado. En el caso de que esto se produjese, deberíamos desechar el tubo contaminado.
El primer tubo con las dos primeras fracciones se colocará al baño maría durante un mínimo de 10-15 minutos, aunque podemos mantenerlo en esta situación durante el tiempo que reste a la intervención quirúrgica.
De este primer tubo obtendremos, por efecto de la coagulación que se produce, fibrina autóloga (Figura 7), que en su momento podremos utilizar como membrana o tapón hemostático, dado su gran poder cicatrizante.
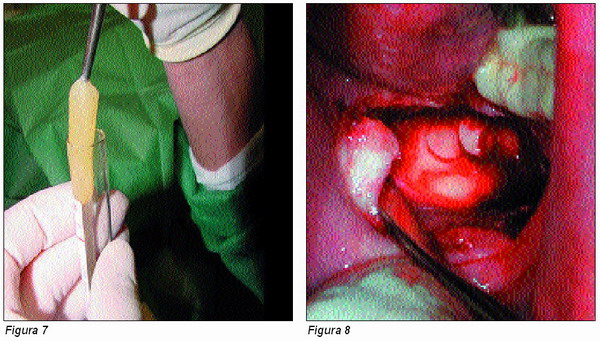
Del segundo tubo, obtendremos el concentrado de plaquetas necesario. Recordemos que para la obtención de la mezcla osteogénica del concentrado partimos del triturado óseo obtenido del paciente (Figuras 8, 9 y 10), más el material osteoinductor u osteoconductor elegido, o bien una mezcla de ambos (Figura 11).
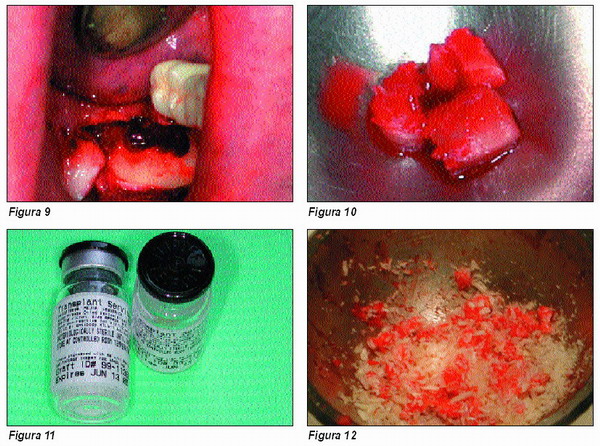
Tendremos preparada una batea igualmente estéril donde depositaremos la mezcla de este preparado, al que añadiremos el concentrado de plaquetas que conservábamos en el segundo tubo. Al extenderse esta mezcla sobre la batea coagulará en forma de una fina película, evitando así que el material sólido del preparado se precipite (Figuras 12 y 13). Conseguiremos de esta manera, tras 5-10 minutos a temperatura ambiente, un coágulo semielástico en forma de película, fácil de manipular (Figura 14).
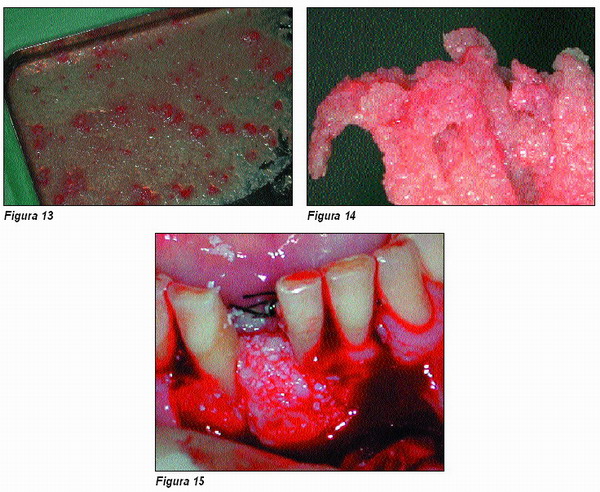
Tras la inserción del implante se apone el material, rellenando los defectos, y se cubre todo el periostio sin necesidad de colocar membrana alguna (Figura 15), aunque en algún caso aislado y para asegurarnos el éxito valoraremos su utilización con el único fin de evitar la dispersión del material de relleno.
Para este último fin contaremos con la fibrina obtenida del primer tubo, que en el caso de utilizarse, su forma cilíndrica, modelada por la luz interna del tubo en el que ha estado contenida, nos facilita su aposición y modelado sobre el defecto y material de relleno ya colocado, hasta que quede convertida en una membrana compacta de color blanquecino y de gran resistencia (Figura 16).
Como vemos con este método obtenemos, por un lado, un entramado autólogo con gran capacidad regenerativa y una membrana, obtenida de igual manera del mismo material genético que el paciente al que tratamos.
Consecuencia: el material ideal para cualquier tipo de regeneración tisular.
A los tres meses de la intervención exponemos nuevamente el campo durante la 2.ª cirugía, descubriendo un hueso maduro y sangrante.
La diferencia con el estadío inicial es evidente (Figuras 17 y 18).
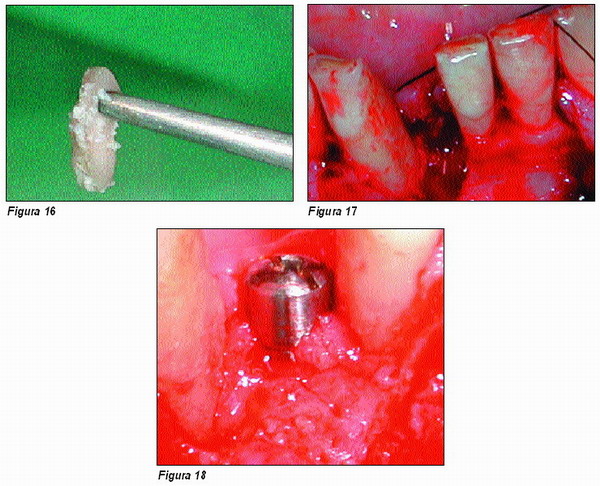
Caso II
Paciente de 52 años, que presenta pérdida de piezas y periimplantitis asociada. Se decide por la rehabilitación mediante la colocación de seis implantes Microdent y la recuperación de los otros cuatro afectos de periimplantitis (Figura 19).
Se realiza un curetaje cuidadoso de los implantes que queremos recuperar, con curetas de teflon para evitar lesionar el titanio, una vez limpios y alisados los implantes, se procede a su detoxificación con ácido cítrico al 40 por ciento (Figuras 20 y 21), consiguiendo la preparación idónea de la superficie del titanio (11).
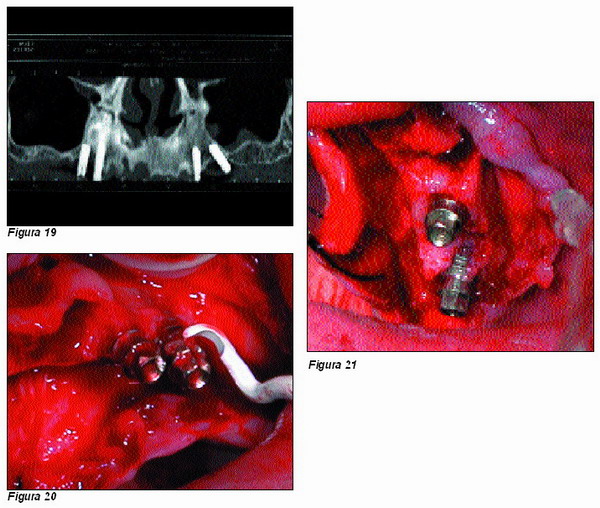
Después de irrigar profusamente la zona quirúrgica con suero fisiológico, se refresca el hueso periimplantario para tener la seguridad de que todo el ácido cítrico y el material óseo afectado por él ha sido eliminado.
Se procede a la inserción de 6 nuevos implantes Microdent, así como a la obtención y colocación del material osteogénico siguiendo el mismo proceso que en el caso anterior (Figuras 22 y 23).
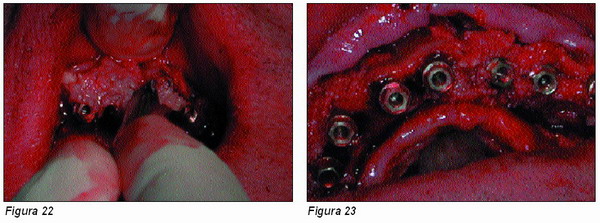
En algunas ocasiones, como en el presente caso, el colgajo a espesor total no es suficiente para cubrir nuevamente implantes y relleno, o bien lo cubre a tensión.
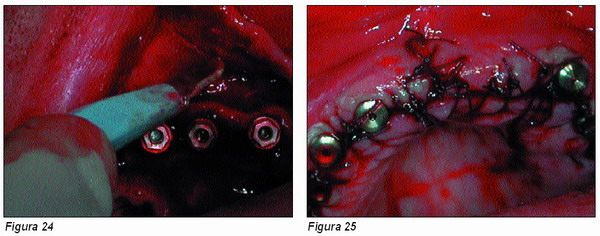
Para obtener el suficiente tejido de recubrimiento, se practican pequeñas incisiones transversales en el propio periostio (Figura 24) que permitan que éste quede liberado, y dada la elasticidad de la mucosa de recubrimiento, se pueda desplazar coronalmente, cubriendo por completo la zona expuesta y poder suturarse sin tensión alguna (Figura 25).
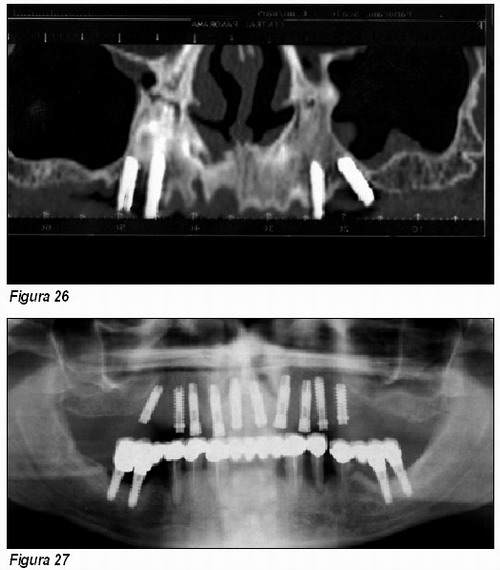
Tras seis meses de osteoregeneración e integración implantaria, la diferencia radiográfica entre el pre y postratamiento es espectacular (Figuras 26 y 27).
La posterior rehabilitación de la mandíbula se intentará resolver siguiendo la misma técnica.
Conclusiones
Los aumentos óseos horizontales, sobre todo el cubrimiento óseo de espiras expuestas como consecuencia de traumatismos espontáneos o controlados, o bien durante la inserción de implantes; con las técnicas habituales de relleno asociadas a membranas, han sido hasta el momento de resultados cuanto menos poco predecibles.
La técnica descrita, al alcance del práctico general, deseamos abra el camino a una mayor regularidad de resultados en este tipo de pacientes.
Correspondencia
Doctor Miguel Velilla
C/ l’Alou, n.º 4
08552 Taradell
E-Mail: dentaldux@dentaldux.com v
Bibliografía
1. Douthitt JC, Gutmann JL, Witherspoon DE. Histologic assessment of healing after the use of a bioresorbable membrane in the management of buccal bone loss concomitant with periradicular surgery. Journal of endodontics. Jun 2001, 27; pp. 404-10.
2. Borghetti A, Glise JM, Monnet-Corti V, Dejou. Comparative clinical study of a bioabsorbable membrane and subepithelial connective tissue graft in the treatment of human gingival recession. Journal of periodontology. Feb 1999, 70; pp. 123-30.
3. Simion M, Dahlin C, Blair K, Schenk RK. Effect of different microstructures of e-PTFE membranes on bone regeneration and soft tissue response: a histologic study in canine mandible. Clinical oral implants research. Apr 1999, 10; pp. 73-84.
4. Marinucci L, Lilli C, Baroni T, Becchetti E, Belcastro S, Balducci C, Locci P. In vitro comparison of bioabsorbable an non-resorbable membranes in bone regeneration. Journal of periodontology. Jun 2001, 72; pp. 753-9.
5. Tinti C, Parma-Benfenati S. Treatment of peri-implant defects with the vertical ridge augmentation procedure: a patient report. International journal of oral & maxillofacial implants. Jul-Aug 2001, 16; pp. 572-7.
6. Ham AW. Tratado de Histología. 1969. Philadelphia. Edición española, 1970. Nueva editorial interamericana, S.A.; pp. 439-40.
7. Ito K, Yamada Y, Ishigaki R, Nanba K, Nishida T. Sato S. Effects of guided bone regeneration with non-resorbable and bioabsorbable barrier membranes on osseointegration around hydroxyapatite-coated and uncoated threaded titanium dental implants placed into a surgically-created dehiscence type defect in rabbit tibia: a pilot study. Journal of oral science. Mar 2001, 43; pp. 61-7.
8. Faul BF, Horning GM, Hellstein JW, Schafer DR. The osteoinductive potencial of demineralized freeze-dried bone allograft in human non-orthotopic sites: a pilot study. Journal of periodontology. Aug 2001, 72; pp. 1064-8.
9. Shanaman R, Filstein MR, Danesh-Meyer MJ. Localized ridge augmentation using GBR and platelet-rich plasma: case reports. International journal of periodontics & restorative dentistry. Aug 2001, 21; pp. 345;55.
10. Anitúa Aldecoa E. Un nuevo enfoque en la regeneración ósea. (P.R.G.F.) Plasma rico en factores de crecimiento. Puesta al día publicaciones, S.L.,Vitoria (Spain) 2000; pp. 83-145.
11. Tinti C, Parma-Benfenati S. Treatment of peri-implant defects with the vertical ridge augmentation procedure: a patient report. International Journal of oral & maxillofacial implants. Jul-Aug 2001, 16; pp. 572-7.



