Dr. V. Monleón / Dr. J. A. Barea / Dr. E. Bizcarrondo /Dr. J. Delhom / Dr. L. Monleón / Jefe de Sección Servicio de Cirugía Maxilofacial HU La Fe de Valencia / Doctor en Medicina y Cirugía / Doctor en Odontología./ Médico Adjunto Servicio de Cirugía Maxilofacial HU La Fe / Doctor en Medicina y Cirugía./ Médicos Residentes del Servicio de Cirugía Maxilofacial HU La Fe / Farmacéutico Comunitario. Universidad Cardenal Herrera CEU. Valencia
Resumen
Presentamos el resultado, a nuestro juicio prometedor, del uso de hidroxiapatita nanométrica enriquecida con gránulos de magnesio, en el relleno de cavidades quísticas de los maxilares.
Palabras clave
Quistes maxilares. Cavidad quística. Relleno. Hidroxiapatita nanométrica. Biopsia.
Introducción
Antigua es la controversia entre si se debe rellenar o no la cavidad ósea tras la quistectomía en los maxilares. Hay multitud de autores tanto a favor como en contra de ella. A favor del relleno podemos citar como pioneros entre otros a:
Grandin H. y Deroubaix P.(1), quienes en 1954 rellenaban con tejido adiposo del paciente la cavidad. También en 1954 Kallenberger K. (2); rellenaba con “Bone Chips” de hueso homólogo y tratado con parafina y mantenido a temperatura de -15 ºC. El mismo autor refiere resultado poco alentador.
En 1959 Lebourg M, Biot J y Grandchamp (3) rellenaban las cavidades con yeso. El éxito de sus trabajos no fue lo prometedor que se esperaba.
Durante la década de los sesenta hay más bibliografía referente al relleno de cavidades. En 1961 Prawednikow S. (4) rellenaba con trozos de músculo del paciente. Mayer R. (5), en 1962, ya rellenaba con hueso y gasa mezclada con yodoformo. En 1966 Roccia B. (6) rellenaba con ácido tricloro acético. En el mismo año otros autores Weigele B. y Wehlan H. (7), refieren haber rellenado con gas de cloro las cavidades quísticas. En 1967 Schulte W. (8), rellenaba con sangre del propio paciente la cavidad quística. ¿Se le podría considerar un antecesor sin saberlo del plasma rico en plaquetas (PRP)?
Los resultados obtenidos con los diversos materiales de relleno tuvieron en su época su controversia, pero los autores, en su mayoría, afirman haber obtenido buena regeneración ósea con el paso del tiempo, entre 2 y 3 años, según estudios radiológicos oportunos.
Con el paso del tiempo, en la década de los ochenta, aparecen materiales bio-orgánicos con características cada vez más similares al hueso humano, la hidroxiapatita.
Hoy en día (2007) se puede afirmar que algunas de ellas a nivel comercial presentan características muy parejas al hueso humano en cuanto a capacidad osteoinductora, osteoconductora y osteogénica (conceptos conocidos ampliamente). Entre estos materiales que ayudan de manera fehaciente a una mejor evolución clínico-funcional del paciente a corto plazo, citamos SINTlife®.
Referenciar la lista de autores no partidarios del relleno cavitario, sería gastar hojas sin interés alguno. Referimos como anécdota, la experiencia personal con Ries Centeno en 1971 quien nos manifestó que “el mejor relleno para las cavidades era la propia sangre”.
Nuestro propósito, con el presente trabajo, no es despertar polémica alguna a favor o en contra del relleno cavitario quístico, sino exponer el resultado del uso de la nueva hidroxiapatita, SINTlife®, como material de relleno óseo.
Material y método
Presentamos nuestra experiencia clínica en el uso de la hidroxiapatita nanométrica enriquecida con iones de magnesio, SINTlife®, en el relleno de cavidades quísticas de los maxilares de más de 5 ml, centrada principalmente en el relleno posquirúrgico de la cavidad mandibular que presentamos en la Figura 1 dadas sus grandes dimensiones radiológicas.
Se trata de un paciente varón de 30 años, que acude a nuestro Servicio por la vía de urgencias remitido por su odontólogo tras el hallazgo casual de la imagen expuesta, en una simple radiografía intraoral. No refería sintomatología alguna y la exploración clínica fue anodina. La exploración radiológica (ortopantomografía y TAC) se expone en la siguiente imagen de la Figura1.
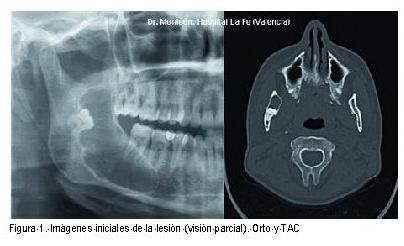 |
En ella se aprecia una imagen radiolúcida de grandes dimensiones (15 cc.) marcada por los parámetros informáticos actuales, compatible clínicamente con diagnóstico de quiste y ante el cual nos preguntamos la actitud quirúrgica a seguir.
Se optó por:
— Exodoncia de los cordales incluidos (18, 28, 38).
— Quistectomía cuerpo y rama mandibular derecha con exodoncia de (46-48).
— Relleno cavidad quística: Este apartado nos cuestiona las preguntas siguientes:
•¿Sí o no?
•¿Por qué?
•¿Con qué?
Responder a la primera de ellas es hacerlo desde nuestro punto de vista con una afirmación rotunda, que a su vez se une con la segunda pregunta, para evitar:
• Posible dehiscencia de la sutura.
• Infección sobre añadida de la cavidad quística.
• Posible fractura de mandíbula (9).
La respuesta a la tercera pregunta, ¿Con qué?, la encontramos en los resultados tan esperanzadores de la extensa experiencia bibliográfica (10-21), así como por la personal en el relleno de cavidades quísticas menores y alveolares, en elevaciones de seno con el uso de hidroxiapatitas, nos decidimos a rellenar la cavidad que se presentaría postquistectomía con SINTlife® mezclada con plasma rico en plaquetas (PRP) y hueso del propio paciente obtenido en la exodoncia del 38.
El producto utilizado es una hidroxiapatita de sustitución cuya fórmula química presentamos en el cuadro siguiente:
Fórmula química Ca10-xMgx(PO4)6(OH)2
Relación Ca+Mg / P: 1,86 (teórico 1,67)
Contenido en iones: Ca (1,94 moles); Mg (0,1004 moles); P (1,09 moles)
(Información proporcionada por OP Profesionales)
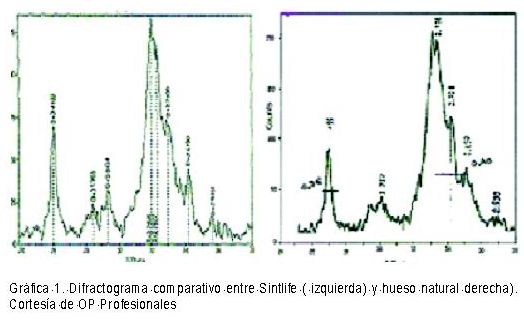
El difractograma presentado (ver Gráfica 1), muestra un estudio comparativo entre el hueso natural y la hidroxiapatita que usamos para el relleno, SINTlife®, dada la gran similitud entre ambas sustancias, fue una razón más para su uso como relleno.
 |
Bajo anestesia general con intubación naso-traqueal se practicó la exodoncia de las inclusiones citadas junto con la quistectomía y exodoncia de las piezas citadas (46 y 47) puesto que ambas estaban incluidas en la membrana quística.
Tras la quistectomía se practicó un barrido de la cavidad quística con plasma rico en plaquetas (PRP) y se rellenó la misma con una mezcla de hueso obtenido en la exodoncia del 38 junto con SINTlife®. Un nuevo barrido se practicó con el PRP previo a la sutura de las partes blandas y sellado posterior de la misma con PRP. Como detalle de la capacidad de la cavidad, referimos que se usaron un total de 15 ml del producto en su relleno.
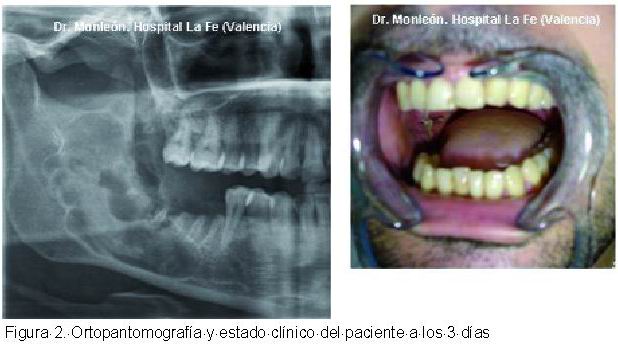
A los tres días de la intervención, se practica un estudio radiológico que junto al estado clínico presentamos (Figura 2) y que consideramos como muy satisfactorio.
 |
El resultado histológico de la pieza operatoria remitida para estudio anatomopatológico confirma la sospecha clínica de quiste dentígero.
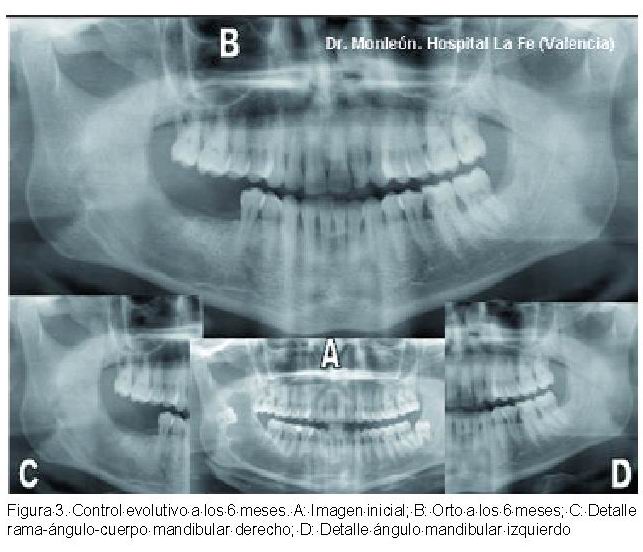
Los controles radiológicos mensuales practicados constatan una evolución clínica muy favorable, en comparación con otras experiencias evolutivas de las cavidades quísticas no rellenas (22). No hubo dehiscencia de las suturas, ni procesos infecciosos locales. Si en cambio un buen mantenimiento del “grosor alveolar” y” buena altura del mismo”.
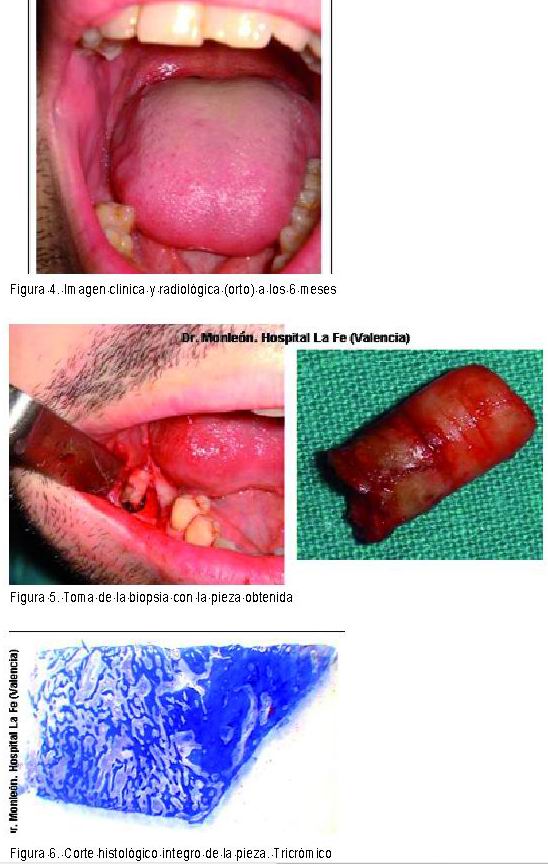
A los seis meses, viendo la buena evolución tanto clínica como radiológica (Figuras 3 y 4), nos decidimos por realizar lo que consideramos la prueba de fuego del producto de relleno: una biopsia.
 |
En la Figura 5 presentamos la toma de la biopsia junto con la pieza obtenida en la misma.
Al ver y tocar la pieza obtenida nos preguntamos si sería o no sería hueso y cuál sería su calidad. Para responder a esta pregunta remitimos la pieza obtenida a estudio histológico. Nuestra formación clínica nos permitía asegurar que se trataba de un hueso de buena calidad, pero la ratificamos con el informe histológico siguiente:
Macroscópica
Cilindro óseo de 0,8 cm de longitud, por 0,5 cm de diámetro transversal.
Microscópica
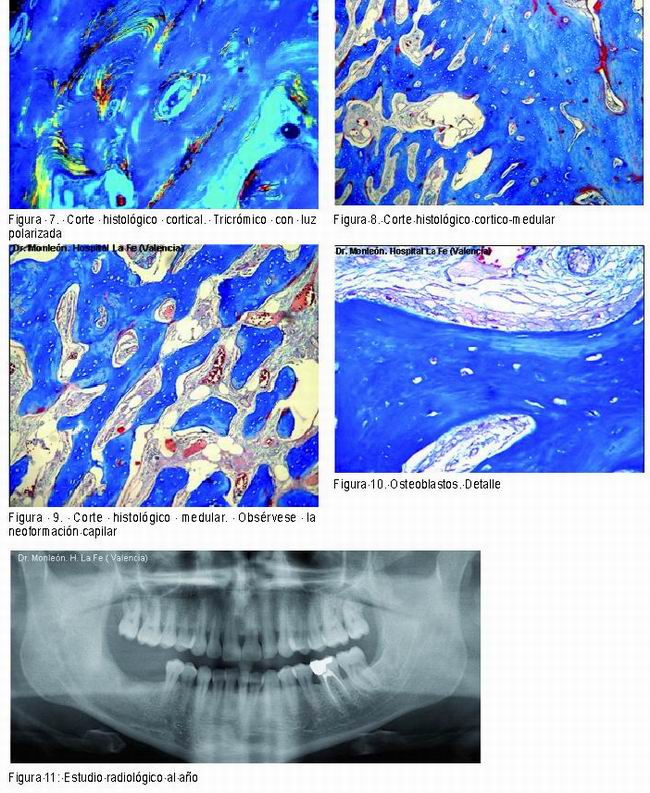
Al estudio histológico, el cilindro óseo presenta una cortical gruesa, de hasta 3,7 mm. de espesor. Esta se halla formada por sistemas de “Havers” apretadamente dispuestos, con laminillas concéntricas refringentes a la luz polarizada, ordenadas alrededor de los vasos. Los osteocitos están regularmente dispersos en el tejido óseo y son pequeños y fusiformes, con su eje mayor dispuesto “paralelamente a las lamelas de colágeno”. La parte esponjosa del tejido óseo muestra trabéculas de 100 a 200 micras de diámetro transversal, bordeadas por un endostio que contiene escasos osteoblastos y muy ocasionales osteoclastos. Aquí el tejido óseo tiene una estructura laminar bien apreciable en la periferia de las trabéculas y menos definida en su centro. El espacio medular está ocupado por tejido conectivo laxo, ricamente vascularizado, sin adipocitos ni elementos hematopoyéticos.
Diagnóstico
Cilindro óseo: Tejido óseo, compacto y esponjoso, bastante maduro, predominantemente de tipo laminar.
En las Figuras 6-10 se presentan las imágenes del estudio histológico.
 |
 |
Discusión
En la búsqueda bibliográfica realizada, no hemos hallado referencias de estudios histológicos en humanos tras el relleno de cavidades quísticas de gran tamaño (mayores de 5 ml ) con materiales biocerámicos.
La bibliografía consultada, siendo extensa, solamente hace referencia a estudios histológicos en animales de laboratorio: ratas, conejos y cerdos.
Los resultados obtenidos con esta nueva hidroxiapatita nos plantean campos de estudio en relación a la actitud terapéutica a seguir ante el hallazgo de cavidades de más de 5 cc: el relleno de las mismas.
La duda que se nos plantea ante esta hidroxiapatita es saber si por sí sola (sin la aplicación de PRP ni el uso de óseo autólogo) sería capaz de regenerar la calidad y cantidad ósea que se ha visto y en qué período de tiempo. ¡Estamos en ello!
Resultados
El relleno de la cavidad quística presentada en la Figura 2 con SINTlife® mezclada con PRP y hueso antólogo, ha regenerado hueso de buena calidad.
El relleno ha sido en la totalidad de la misma.
El tiempo transcurrido en el relleno se puede considerar óptimo, 6 meses, demostrado tanto a nivel radiológico como histológico.
En la Figura 11 presentamos el estudio radiológico, Ortopantomagrafía, al año de la intervención.
Conclusión
Estamos ante un producto que nos está proporcionando unos resultados clínico-funcionales que consideramos óptimos, tanto en tiempo como en tipo de regeneración ósea, de las cavidades quísticas.
Agradecimientos
Manifestamos nuestro sincero agradecimiento a los doctores Aparisi, Beltrán y Cifrian del Servicio de Radiología Hospital Universitario La Fe de Valencia (España), por sus explicaciones en los controles radiológicos y su estímulo científico.
Igualmente agradecemos al doctor Rivas, del Servicio de Anatomía Patológica Hospital Universitario La Fe de Valencia (España), por su colaboración al aportarnos el estudio histológico.
Correspondencia
Dr. D. Vicente Monleón Alegre
Hospital Universitario La Fe. Valencia (España)
Secretaría Servicio Cirugía Maxilofacial Pabellón de Rehabilitación, 6ª planta.
C/ Avda. Campanar, 21
46009 VALENCIA (ESPAÑA)
e-mail: monleval@hotmail.com.
Bibliografía
1. Grandin H, Deroubaix P. Traitement d´un volumineux kyste paradentaire du maxiliaire inférieure par greffe de graise. Rev. franç. d’Odonto-Stomat. (1954) Nr. 8.
2. Kallenberger K. Zur Pathogenese der Follikularzysten. DZZ 12 (1957) 212.
3. Lebourg M, Biot J et Grandchamp P. Inclusion de plâtre de Paris pour le comblement des cavités osseuses. Revue de Stomatologie 9 (1959) 525-532.
4. Prawednikow S. Plastik der Restknochenhöhlen mit Muskelteilen bel Opetationen von chronischer Osteomielitis und eitrigen Zysten am Kiefer. Stomatologija Moskva 40 (1961) 53.
5. Mayer R. Technique d´exérése cystes muqueux de la lèvre. Acta stomat. Belg. 59(1962) 103.
6. Roccia B. Ubre die Behandlung der Zahnzysten. Ost. Z. Stomat. 63 (1966) 341.
7. Weigele B.;Wehlan H. Die transradikulare Therapie der Kieferzysten durch strukturelle Modifizierung bei Anwendung von Cl2- Gas. DZZ 22 (1967) 875.
8. Schulte W. Fragen der Knochenregeneration nach der Ausschalung grober Kieferzysten. DZZ 20 (1965) 620.
9. Monleón V. Carmona F. Fractura espontánea de mandíbula en el post-operatorio de quiste dentígero de 48. ORIS 1991. Vol 41 4: 105-112.
10. Scabbia A, Tampieri A, Trombelli L. I materiali bioceramici osteoconduttivi e il loro ruolo come sostituti dell»osso. Implantologia Orale n.º 4, sept 2003.
11. Constatino Pd, Freidman CD. Synthetic bone graft substitutes. Otoralyngol Clin North Am 1994; 27: 1037-73.
12. Bauer Tw, Muschler GF. Bone graft materials. An overview of the basci science. Clin Orthop Rel Res 2000; 371: 10-27.
13. Burchardt H. The biology of bone graft repair. Clin Orthop 1983; 174: 28-42
14. Khan Sn, Tomin E, Lane JM. Clinical applications of bone graft substitutes. Orthop Clin North Am 2000; 31: 389-98.
15. Beckham CH, Greenlee J, Crebo AR. Bone formation at a ceramic implant surface. Calcif Tissue Res 1971; 8: 165-71.
16. Tracy BM, Doremas RH. Direct electron microscopy studies on the bone hydroxyapatite interface. J Biomed Mater Res 1984; 18: 719-26.
17. Ogiso M. Bone formation on HA implants: a commentary. J Long Term Eff Med Implants 1998; 8:193-200.
18. Ripamonti U. The morphogenesis of bone in replicas of porous hydroxyapatite obtained from conversion of calcium carbonate exoskeleton of coral. THE J Bone Joint Surg Br. 1991; 73-A, n.º5: 692-703.
19. Holmes RE, Bucholz RW, Mooney V. Porous hydroxyapatite as a bone-grtaft substitue in metaphyseal defescts. A histometric study. J Bone Joint Surg Am. 1986; 68:904-911.
20. Sartoris DJ, Gershumi DH, Akerson WH et als. Coralline Hydroxyapatie Bone graft substitutes: Preliminary report of radiographic evaluation. Radiology 1986; 159: 133-137.
21. Henkel et al. Macroscopical, histological, and morphometric studies of porous bone-replacement and materail in minipigs 8 months after implantation. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2006; 102: 606-13.
22. Chiapasco M, Rossijason A, Motta J, Crescentin M. Spontaneous Bone Regeneration After Enucleation of Large Mandibular Cysts: A Radiographic Computed Analysis of 27 Consecutive Cases. J Oral Maxillofac Surg 2000; 58: 942-948.



