Resumen
El gran potencial osteoinductor y osteorregenerador de la BMP-7 en base a los estudios llevados a cabo en relación con la Odontología, alientan a esperar que la disponibilidad comercial de esta proteína producida mediante ingeniería genética revolucionará la cirugía ósea restauradora, ya que mediante su utilización en la clínica será posible inducir la formación de
Tejidos óseos en el sitio afectado, prescindiendo, en muchos casos, de los transplantes óseos autólogos o materiales de sustitución ósea, dando además grandes esperanzas en el campo de la regeneración periodontal (en base a los óptimos resultados obtenidos en regeneración de hueso alveolar, cemento y ligamento) y en implantología (este factor favorece la osteointegración).
Introducción
La Proteína Morfogenética Ósea 7 (BMP-7), también denominada Proteína Osteogénica 1 (OP-1), es una proteína formada por 2 monómeros de 139 aminoácidos unidos por un puente disulfuro. Es un potente modulador de la osteogénesis y tiene propiedades osteoinductivas. Se encuentra en los tejidos óseos humanos en una proporción de 1 microgramo por kilogramo de tejido óseo.
Su disponibilidad en el mercado es aún muy reciente y se emplea en clínica en casos de pseudoartrosis, fusión espinal y fracturas abiertas que no consolidan.
Su gran potencial en Odontología es la razón que ha llevado a la realización del presente artículo.
Hoy por hoy se sabe que la implantación de OP-1 en defectos óseos produce quimiotaxis, es decir, las células indiferenciadas son reclutadas activamente desde los tejidos circundantes y los vasos sanguíneos hasta el lugar de la lesión. Allí se produce la mitogénesis, debido a que la OP-1 crea un ambiente propicio para la multiplicación celular. Para la diferenciación, la OP-1 se une a receptores específicos de las células indiferenciadas y se transmite la señal para la formación de hueso a través de las proteínas SMAD intracelulares hasta el núcleo. Esta señal induce a la célula para que comience la cascada de formación ósea, los osteoblastos se organizan y aparece proliferación vascular.
Posteriormente se produce la calcificación debido a una elevada actividad osteoblástica apoyada por el gran crecimiento vascular. Finalmente se produce la remodelación ósea, el hueso se organiza apropiadamente respondiendo a estímulos biológicos y biomecánicos (Figura 1).
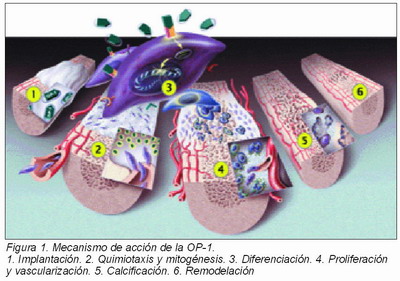 Objetivos
Objetivos
Los objetivos de este artículo son exponer la situación actual de los estudios llevados a cabo con la BMP-7 y conocer los resultados obtenidos en el campo de la Odontología así como poner de manifiesto su gran potencial osteoinductor y osteorregenerador.
Material y método
Para la realización de este trabajo de revisión bibliográfica, se ha realizado una búsqueda a través de Medline y Compludoc empleando las palabras clave:
— Bone Morphogenetic Protein 7,BMP-7 and periodontal regeneration, BMP-7 and osteoinduction.
Obteniendo 32 entradas válidas, el material empleado ha sido obtenido en la hemeroteca de la Facultad de Odontología de la UCM, hemeroteca de la facultad de Medicina de la UCM, Hospital Clínico San Carlos y Hospital General Universitario La Paz.
Discusión y resultados
Al tratarse de un trabajo de revisión bibliográfica se han agrupado la discusión y los resultados.
• La historia de las BMP comenzó en 1889 con las investigaciones del cirujano americano Senn, que utilizaba implantes óseos desmineralizados en la cirugía ósea restauradora. A mediados de la década de los sesenta, el profesor Urist, de la Universidad de California en Los Ángeles, descubrió que los huesos alógenos desmineralizados implantados entre el músculo formaban hueso nuevo (1). En 1973, este investigador y su equipo lograron extraer del tejido óseo una mezcla proteica heterogénea con propiedades para formar hueso en partes blandas, y que recibió el nombre de proteína morfogenética ósea.
Tras la secuenciación enzimática, Wozney y cols. lograron clonar las proteínas BMP-1 a BMP-14. Hasta la fecha se han aislado y clonado más de 40 BMP de diferentes tejidos (2).
• Dentro de los principales estudios llevados a cabo con la proteína están el de Warnke y Coren (3) que aplicaron por primera vez esta proteína sobre un ser humano.
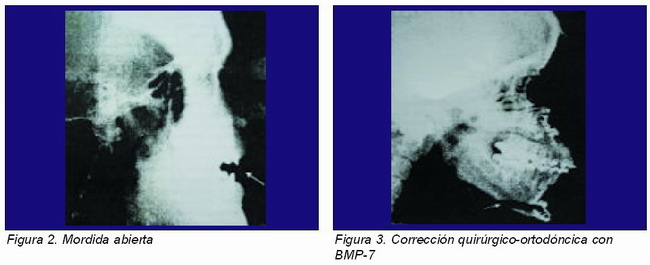
El paciente era un varón de 21 años con mordida abierta maxilar sobre el que se realizó una osteotomía tipo Lefort I para conseguir una clase I dentaria, en el lugar del defecto se aplicó BMP-7 y se fijó con miniplacas.
A los 29 días se realizó una intervención para revisar el estado de la zona y la sorpresa fue la gran cantidad de neoformación ósea y el avanzado estado del callo de maduración. Se piensa firmemente que estos resultados tan positivos fueron debidos al empleo de la proteína (Figuras 2 y 3).
• Terheyden y cols.(4-6) llevaron a cabo una nueva técnica de prefabricación de injertos óseos vascularizados sobre el músculo Latissimus Dorsi de cerdos enanos, implantando la BMP-7 unida a un transportador, y posteriormente empleando este injerto prefabricado para la reconstrucción mandibular. Los resultados se compararon con defectos idénticos del lado contralateral sobre los que se aplicó BMP-7 de modo directo. Los resultados fueron significativamente mejores en la técnica de prefabricación (Figura 4).
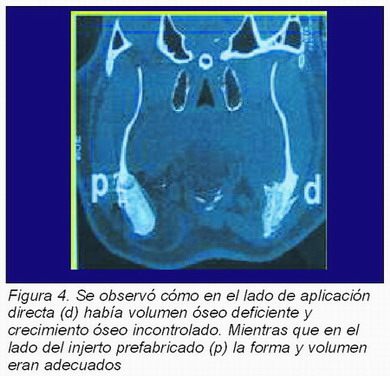
Por tanto esta técnica podría convertirse en la alternativa clínica a los injertos óseos vascularizados convencionales (7). Los estudios de Roldan apoyan estos resultados (8).
• Mizumoto y cols. (9) estudiaron la capacidad de la BMP-7 para acelerar el callo de maduración ósea durante la osteogénesis por distracción y obtuvo unos resultados apoyados por Terheyden (10) que demostraban la capacidad de aceleración de la regeneración ósea y su potencial para reducir al periodo de tratamiento con fijación externa durante la osteogénesis por distracción. Por tanto si la BMP-7 es administrada en el momento preciso durante la distracción, se podría disminuir el periodo de consolidación y aumentar el grado de distracción (11).
• En implantología la BMP-7 también se perfila como un potente agente a tener en cuenta, así lo sugieren los estudios realizados por Gianobile y cols. en los que se administró el gen que codifica la BMP-7 sobre defectos óseos en ratas y se colocaron implantes de titanio. La BMP-7 se aplicó con el fin de reactivar los mecanismos de regeneración ósea. Se observó que en los animales que recibían la terapia génica se producía un 50 por ciento más de hueso alrededor de los implantes. Por tanto la introducción de este factor de crecimiento en defectos óseos bucales produce neoformación ósea.
• Otra posibilidad terapéutica de la proteína se encuentra en el campo de la endodoncia. Six y cols. (12) examinaron la BMP-7 por su eficacia en la inducción de dentinogénesis reparativa en la pulpa expuesta de molares de rata sobre las que se aplicaron bolitas de colágeno con BMP-7. A los 28 días la pulpa coronal y radicular estaba totalmente reparada, mostrando mineralización homogénea y osteodentina. Lo que sugiere el potencial de la BMP-7 como alternativa a tratamientos endodónticos convencionales.
• Debido a la falta de estudios histológicos detallados sobre defectos mandibulares reconstruidos mediante BMP-7 en grandes mamíferos, Abu-Serriah y cols. (13) realizaron un estudio sobre la reparación osteoperiostal mandibular en ovejas; concluyendo que el hueso nuevamente formado restauró las capas endostales y periostales, era biocompatible y además no indujo osificación de tejidos blandos o crecimientos anormales alrededor de estructuras vitales. Se demostró por tanto que esta proteína promueve los procesos de premineralización y la formación de tejido óseo.
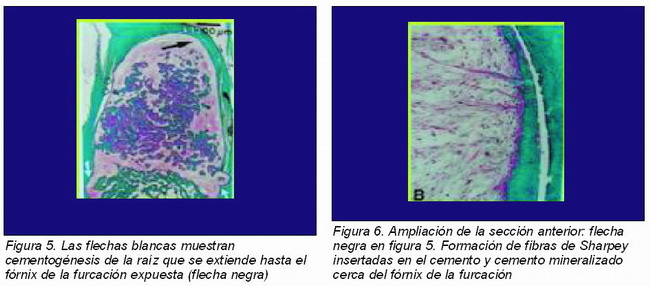
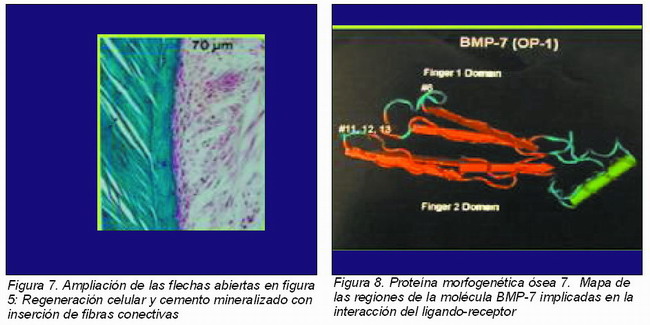
• Una de las principales metas de la terapia génica con BMP es la regeneración periodontal. Con este fin Ripamonti y cols. (14) realizaron un estudio en el que prepararon 12 defectos de furca en los primeros y segundos molares de mono, que fueron tratados con un control que contenía 0 microgramos de BMP-7, con 100 y con 500 microgramos, unidos a un transportador (matriz bovina colágena insoluble). Los análisis histológicos a los 60 días de curación mostraron una importante cementogénesis en la dentina expuesta en las furcaciones tratadas con ambas dosis de OP-1, también se observó la regeneración del ligamento periodontal, con inserción de fibras de Sharpey dentro del cemento orientadas funcionalmente. Las mismas conclusiones se obtuvieron por Giannobile y cols. (15) y Kuboki y cols. (16) en sus respectivos estudios.
Estas microfotografías corresponden al estudio llevado a cabo por Ripamonti (Figuras 5-7):
Consenso actual entre investigadores
Hoy en día los investigadores están de acuerdo en que la reconstrucción del soporte periodontal perdido (incluyendo hueso, ligamento y cemento) es uno de los principales objetivos de la terapia con BMP. Así las lesiones periodontales tratadas con BMP-7 muestran una rápida condrogénesis, cementogénesis y una fiable reparación de los defectos óseos periodontales. Se sabe que sus efectos están profundamente influenciados por una serie de factores que pueden limitar sus efectos como la condición radicular, la carga oclusal, la dosis, los sistemas de transporte, la actividad biológica transitoria de las BMP y la contaminación bacteriana. Dada esta amplia gama de factores, es concebible que las investigaciones preliminares en humanos no den unos resultados claros y concretos.
Está demostrado que la BMP-7 en elevadas concentraciones produce anquilosis, por ello es crítica la selección de las dosis adecuadas para alcanzar regeneración periodontal sin que se dé anquilosis.
Los investigadores están de acuerdo en que en el campo de la implantología, el control farmacogenético de las BMP tiene una importancia clave para lograr una osteointegración exitosa y así conseguir un aumento del contenido mineral entorno a implantes dentales y reducir el periodo hasta la carga mecánica. A tal fin, Kirwood y cols. (17) investigaron 13 péptidos bioactivos derivados de la BMP-7 y los acoplaron mediante química silánica a sustratos vítreos. Obteniendo unos resultados que indican que esta técnica puede proveer la base biológica para inmovilizar péptidos en implantes de titanio y así inducir la diferenciación osteoblástica y la mineralización de un modo más predecible alrededor de los implantes (Figura 8).
— En la técnica de elevación de seno los resultados son controvertidos. Van Der Bergh y cols. (18) afirman que el comportamiento es aún insuficientemente predecible en esta área de indicación.
Groeneveld y cols. (19) analizaron el tejido formado en el seno maxilar, después de 6 y de 12 meses de haber implantado BMP-7 unido a un transportador de colágeno de origen bovino. Este estudio indicó que el inicio de la nueva formación ósea observada tras 6 meses del injerto, no persistió a los 12 meses mientras que el transportador colágeno permanecía. La carencia de carga mecánica, como resultado de posponer la colocación de implantes, pudo haber dado lugar a la reabsorción del hueso emergente que estaba presente 6 meses después del injerto.
Roldán y cols. (20) evaluaron los posibles beneficios de la BMP-7 en el seno injertado comparado con el uso del Plasma Rico en Plaquetas.
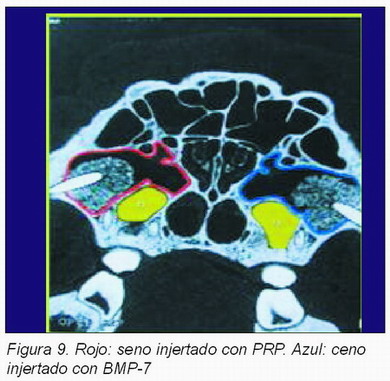 Para este propósito, se preparó un aumento de seno bilateral con hueso bovino inorgánico. Bajo las condiciones experimentales seleccionadas, el uso de la BMP-7 condujo a unos resultados superiores con respecto a la osteointegración de los implantes dentales y la altura del nuevo hueso.
Para este propósito, se preparó un aumento de seno bilateral con hueso bovino inorgánico. Bajo las condiciones experimentales seleccionadas, el uso de la BMP-7 condujo a unos resultados superiores con respecto a la osteointegración de los implantes dentales y la altura del nuevo hueso.
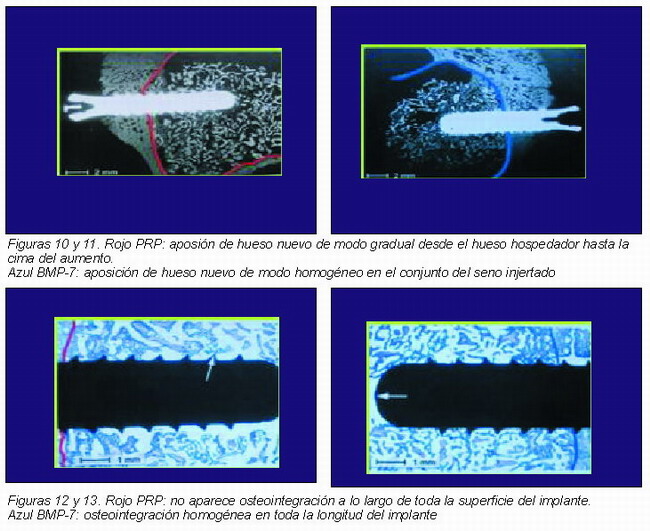
En la tomografía computerizada realizada a las 6 semanas tras la elevación de seno. Se observó que en la zona donde se colocó PRP la aposición de hueso tomó lugar de un modo gradual desde el hueso hospedador hasta la cima del aumento. Mientras que con BMP-7 se apreció formación homogénea de nuevo hueso en todo el conjunto del seno aumentado. Además la osteointegración del implante de titanio se observa en toda su longitud en el seno tratado con BMP-7, mientras que en el lado de aplicación de PRP la osteointegración no era tan óptima (Figuras 9-13).
Conclusiones
Los resultados obtenidos hasta el momento son muy esperanzadores.
Se ha demostrado la eficacia de la proteína en reparación de pequeños defectos óseos; para favorecer la osteointegración y en regeneración periodontal.
Y se necesita corroborar su eficacia en mejorar el porcentaje de éxito y calidad de resultados en la reconstrucción de malformaciones y defectos óseos; para el tratamiento de territorios irradiados y para reemplazar un porcentaje significativo de los injertos óseos actualmente empleados.
Correspondencia
Gloria de Tena
C/ Lima, n.º5, 1.º C.
28944 Madrid.
Tel.: 916907689
y 617243874
Correo electrónico: detenagonzalez@hotmail.com
Bibliografía
1. Wonzney JM et al. Overview of bone morphogenetic proteins. Spine. 2002;27:S2-S8.
2. Einhorn TA. Clinical applications of recombinant human BMPs: Early experience and future developement. J Bone Joint Surg.2003;85-A:82-88.
3. Correspondece and brief communications. Plastic and Reconstructive Surgery.2003;June.
4. Terheyden H, Warnke P, Dunsche A, Jepsen S, Brenner W, Palmie S et al. Mandibular reconstruction with prefabricated vascularized bone grafts using recombinant human osteogenic protein-1: an experimental study in miniature pigs. Part II: Transplantation. Int J Oral Maxillofac Surg. 2001;30:469-478.
5. Terheyden H, Knak C, Jepsen S, Palmie S, Rueger DR. Mandibular reconstruction with a prefabricated vascularized bone graft using recombinant human osteogenic protein-1: an experimental study in miniature pigs. Part I:Prefabrication. Int J Oral Maxillofac Surg. 2001;30:373-379.
6. Terheyden H, Menzel C, Wang H, Springer IN, Rueger DR, Acil Y. Prefabrication of vascularized bone grafts using recombinant human osteogenic protein-1 – part 3: dosage of rhOP-1, the use of external and internal scaffolds. Int J Oral Maxillofac Surg.2004;33:164-172.
7. Terheyden H, Jepsen S, Rueger DR. Mandibular reconstruction in miniature pigs with prefabricated vascularized bone grafts using recombinant human osteogenic protein-1: a preliminary study. Int J Oral Maxillofac Surg.1999;28:461-463.
8. Roldán JC, Jepsen S, Miller J, Freitag S, Rueger DC, Acil Y, Terheyden H. Bone formation in the presence of platelet-rich plasma vs. Bone morphogenetic protein-7. Bone.2004;34:80-90.
9. Mizumoto Y, Moseley T, Drews M, Cooper VN, Reddi H. Acceleration of regenerate ossification during distraction osteogenesis with recombinant human bone morphogenetic protein-7. J Bone Joint Surg
10. Terheyden H, Wang H, Warnke PH, Springer I, Erxleben A, Ludwig K, Rueger DC. Acceleration of callus maturation using rhOP-1 in mandibular distraction osteogenesis in a rat model. Int J Oral Maxillofac Surg. 2003;32:528-533.
11. Masaki-Yazawa, Kazuo-Kishi, Hideo-Nakajima, Tatsuo-Nakajima. Expression of bone morphogenetic proteins during mandibular distraction osteogenesis in rabbits. J Oral Maxillofac Surg.2003;61:587-592.
12. Six N, Lasfargues JJ, Goldberg M. Differential repair responses in the coronal and radicular areas of the exposed rat molar pulp induced by recombinant human bone morphogenetic protein 7 ( osteogenic protein 1). Arch Oral Biol. 2002;47:177-187.
13. Abu-Serriah MM, Odell E, Lock C, Gillar A, Ayoub AF, Fleming RH. Histological assesment of bioengineered new bone in repairing osteoperiosteal mandibular defects in sheep using recombinant human bone morphogenetic protein-7. Br J Oral Maxillofac Surg. 2004;42:410-418.
14. Ripamonti U, Heliotis M, Rueger DC, Sampath TK. Induction of cementogenesis by recombinant human osteogenic protein-1 (hOP-1/BMP-7) in the baboon (papio ursinus). Arch Oral Biol. 1996;41(1):121-126.
15. Giannobile WV, Ryan S, Shih M, Ling-Su D, Kaplan PL, Chan TCK. Recombinant human osteogenic protein-1 (OP-1) stimulates periodontal wound healing in class III furcation defects. J Pperiodontol. 1998;69:129-137.
16. Kuboki Y, Sasaki M, Saito A, Takita H, Kato H. Regeneration of periodontal ligament and cementum by BMP-applied tissue engineering. Eur J Oral Sci. 1998;106(1):197-203.
17. Kirkwood K, Rheude B, Joon-Kim Y, White K, Dee KC. In vitro mineralization studies with substrate-inmobilized bone morphogenetic protein peptides. J Oral Implantol. 2003;29(2):57-65.
18. Van den-Bergh JPA, Ten-Bruggenkate CM, Groeneveld HHJ, Burger EH, Tuinzing DB. Recombinant human bone morphogenetic protein-7 in maxillary sinus floor elevation surgery in 3 patients compared to autogenous bone grafts. A clinical pilot study.J Clin Periodontol. 2000;27:627-636.
19. Groenveld HHJ, Van den-Bergh JPA, Holzmann P, Ten-Bruggenkate CM, Tuinzing DB, Burger EH. Histological observations of a bilateral maxillary sinus floor elevation 6 and 12 months after grafting with osteogenic pretein-1 device. J Clin Periodontol. 1999;26:841-846.
20. Roldan JC, Jepsen S, Knuppel H, Rueger DC, Acil Y, Terheyden H. Sinus floor augmentation with simultaneous placement of dental implants in the presence of platelet-rich plasma or recombinant human bone morphogenetic protein-7. Clin Oral Impl.2004;15:716-723.
21. Groeneveld EHJ, Burger EH. Bone morphogenetic proteins in human bone regeneration. Eur J Endocrinol.2000;142:9-21.
22. Asahina I, Kuber-Sampath T, Nishimura I, Hauschka PV. Human osteogenic protein-1 induces both chondroblastic and osteoblastic differentiation of osteoprogenitor cells derived from newborn rat calvaria. J Cell Biol.1993;123(4):921-933.
23. Jin QM, Anusaksathien O, Webb SA, Rutherford RB, Giannobile WV. Gene therapy of bone morphogenetic protein for periodontal tissue engineering. J Periodotol. 2003; 74:202-213.
24. King G, Cochran D. Factors that modulate the effects of bone morphogenetic protein-induced periodontal regeneration: A critical Review. J Periodontol. 2002;73:925-936.
25. Ripamonti U, Crooks J, Petit JC, Rueger DC. Periodontal tissue regeneration by combined applications of recombinant human osteogenic protein-1 and bone morphogenetic protein-2. Apilot study in Chacma baboons ( Papio ursinus). Eur J Oral Sci. 2001;109:241-248.
26. Helder MN, Karg H, Bervoets TJM, Vukicevic S, Burger EH, D´Souza RN et al. Bone morphogenetic protein-7 (Osteogenic Protein-1, OP-1) and tooth developement. Dent Res. 1998;77(4):545-554.
27. Zoiric S, Maric I, Bobinac D, Vukicevic S.Expression of bone morphogenetic protein and cartilage-derived morphogenetic proteins during osteophyte formation in humans. J Anat. 2003;202:269-277.
28. Rutherford RB, Racenis P, Fatherazi S, Izutsu K. Bone formation by BMP-7-tranduced human gingival keratinocytes. J Dent Res. 2003;82(4):293-297.
29. Sorní M, Guarinós J, García O, Peñarrocha M. Implant rehabilitation of the atrophic upper jaw: A review of the literature since 1999. Med Oral Patol Oral Cir Bucal. 2005;10:E45-E56.
30. Dawson EG.Letters to editor.Spine.2003;3:87-89.
31. Boden DS, Andersson BJ, Anderson DG, Damien C, Ebara S, Helm G, Lane JM et al. Summary statement:Overview of bone morphogenetic proteins for spine fusion. Spine. 2002;27(165):51.
32. Tissue engineering: applications in maxillofacial surgery and periodontics/ edited by Samuel E.Lynch, Robert J. Genco, and Robert E. Marx. 1999. Quintessence Publishing CO, Inc.
33. OP-1 implant. Product information. Stryker Biotech, 2001.




