Resumen
Objetivo del trabajo: evaluar la eficacia de un preparado galénico para uso tópico constituido por elementos de fito y oligo-derivación en la cura de los tejidos blandos de la cavidad bucal.
Material y métodos: se organizó un ensayo clínico a doble ciego y aleatorizado en la Clínica Odontológica de la Universidad de Milán (Bicocca) Hospital S. Gerardo, en pacientes de patología ulcerativa de la cavidad bucal de tipo aftósica o traumática, de enfermedad periodontal, o sometidos a extracciones dentarias.
En cuanto a la evaluación de la cura de los tejidos blandos en el grupo experimental o con el grupo placebo, se evaluaron aspectos clínicos, el sangrado y el dolor después de una semana de la aplicación.
Resultados: se evaluaron un total de 72 pacientes. El medicamento test ha mostrado reducir el dolor por úlceras orales y facilitar la cura (80% de los casos). En los casos de sangrado tras la extracción, el fenómeno se detuvo precozmente en el grupo experimental (66,6%). En los individuos con enfermedad periodontal, el índice de sangrado tras el tratamiento periodontal, llegó a ser 0 (cero) en el 100 por cien del grupo experimental y del 0 por ciento en el grupo control, mientras permaneció sin cambios la profundidad de sondeo periodontal.
Conclusiones: Cikaflogo fue eficaz en la facilitación de la cura de las lesiones ulcerativas de la cavidad bucal, en la reducción del sangrado después de la extracción y del sangrado de las encías relacionado a enfermedades periodontales.
Palabras clave
Úlceras orales; gingivitis; ácido hialurónico.
Abstract
Objective: to evaluate the effectiveness of a galenic topic medicament made of fito and oligoelements on the healing of oral soft tissues.
Methods: we conducted a randomized double-blind placebo-controlled clinical trial between patients of the Clinica Odontoiatrica of the University of Milano-Bicocca – Hospital S.Gerardo with apthous or traumatic ulcers of oral mucosa, with periodontal disease or with extracted teeth. The evaluation of the healing of oral soft tissues with the testing preparation and with placebo was conducted through a double-blind analysis observing clinical aspect, bleeding and pain.
Results: 72 patients were evaluated. The tested preparation showed to reduce pain of oral ulcers and to improve the healing (80 per cent of case group). In the extracted teeth with postsurgical bleeding, bleeding stopped earlier in the test group (66,6 per cent). In periodontal diseases, bleeding on probing became 0 (zero) in 100 per cent of test group and in 0 per cent of control group, whereas periodontal pocket depth showed no significant reduction.
Conclusions: the study showed that Cikaflogo is effective on improving healing of oral ulcers, on reducing postsurgical bleeding and gingival bleeding in periodontal diseases.
Key words
Oral ulcers; gingivitis; hialuronic acid.
Introducción
En este trabajo ha sido probada la eficacia de un nuevo preparado galénico para uso tópico (Cikaflogo®) en la cura de los tejidos blandos de la cavidad bucal, especialmente en los tejidos afectados por enfermedades periodontales, por úlceras de origen traumático o aftósico, asimismo como tratamiento post-extracción.
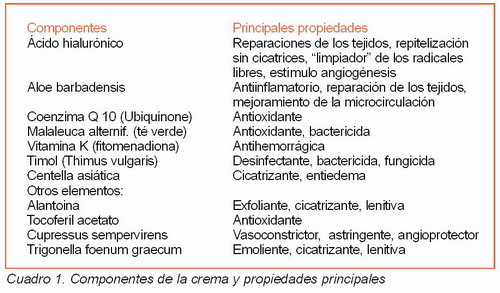
Cikaflogo es una crema formada por una mezcla de oligoelementos y fitoderivados, algunos de los cuales se han usado desde tiempos remotos, cuyas características y propiedades fueron analizadas en los últimos decenios en diversos estudios experimentales (Cuadro 1).
Ácido hialurónico (hialuronato)
Uno de los principales componentes del medicamento es el ácido hialurónico, que bajo forma de polímero (carbohidrato) representa un constituyente fundamental de las matrices extracelulares en la piel, en las mucosas, en las articulaciones, en el ojo y en muchos órganos y tejidos.
Es reconocida la función del ácido hialurónico en los procesos de reparación de los tejidos, aunque si hasta ahora no se conocen bien los mecanismos de intervención que parecen estar relacionados a su función como parte integrante, estructural de la matriz extracelular y a complejas interacciones con componentes celulares y extracelulares en virtud de sus propiedades osmóticas, estereoscópicas y visco-elásticas, además de una acción directa en la función celular mediante interacción receptora con la consiguiente respuesta en la expresión de genes específicos.
Gracias a su característica osmótica, el ácido hialurónico restablece la hidratación de los tejidos durante los procesos inflamatorios; su viscosidad contribuye, además, a obstaculizar el pasaje de virus y bacterias a través de la zona pericelular (1-5).
Los principales receptores del ácido hialurónico son los CD44, presentes en la piel y en las mucosas, que intervienen en la regulación de la proliferación de los queratinocitos en respuesta a los estímulos externos (6), los RHAMM (Receptors for Hyaluronan Motility) a nivel de los fibroblastos, implicados en su migración (7), y los ICAM-I (Intracellular Adhesión Molecule -1), cuya interacción con el hialurónico contribuye al control de la activación de los fenómenos inflamatorios ICAM-1 mediada (5).
La respuesta inicial a los ataques de los tejidos incluye la formación de una matriz extracelular rica en ácido hialurónico y fibrina que soporta la influencia de fibroblastos y células endoteliales dentro de la zona del ataque y la siguiente formación de tejido de granulación (1, 2, 8). La matriz de tejido de granulación rica en hialurónico desarrolla una serie de funciones útiles a la reparación de los tejidos, entre las cuales facilitar la migración y la proliferación celular y la organización de la matriz de tejido de reparación (2, 9, 10). Además de tener una función de estimulación del proceso inflamatorio, el hialurónico se caracteriza por una función moderadora de la inflamación, gracias a sus propiedades antioxidantes, de “limpiador” de los radicales libres y de barrera de degradación de los tejidos (11-15).
Los oligosacáridos del ácido hialurónico de bajo peso molecular han demostrado ser capaces de promover la angiogénesis y estimular la producción de colágeno por parte de las células endoteliales (8, 16).
Por último, el hialuronato de la epidermis es esencial, mediante su interacción con los receptores CD44, en la repitelización durante la reparación de los tejidos, e incluso la ausencia de la formación de cicatrices parece estar relacionada a este componente (17).
Diferentes estudios clínicos sobre la aplicación exógena de hialuronato para la cura de las heridas a nivel de la piel, de la membrana timpánica, del epitelio de la córnea han demostrado cómo el mismo acelera la cura y cómo su presencia está asociada y, mejor dicho, fuese necesaria para una cura sin cicatrices (14, 18, 19) como en los tejidos fetales, que son muy ricos en ácido hialurónico. También es muy útil en el tratamiento de las inflamaciones de las encías (20).
Aloe Barbadensis (Aloe vera)
Aloe vera es una planta perenne de la familia de las Liliaceae, desde siempre conocida por sus propiedades terapéuticas. Varios estudios experimentales han confirmado el efecto del extracto de Aloe en la cura de las heridas, de los ataques térmicos, además de sus capacidades anti-inflamatorias y de inmuno-modulación (21-23). Se han examinado las acciones de todo el extracto completo del gel de aloe vera como de los componentes únicos identificados como aloesina, manosio-6-fosfato, glicoproteína G1G1M1DI2, aloe-emodina. Se evidenció su capacidad de estimular la migración y la proliferación de los queratinocitos y de los fibroblastos en los procesos de reparación de los tejidos (23-26) y también sus propiedades angiogenéticas (27). La cura de las heridas fue más veloz mediante la aplicación de su extracto (28). Aloe vera también fue útil en la cura de inflamaciones de las encías con sarro (29).
Coenzima Q10 o Ubiquinone
Es un compuesto liposoluble que pertenece a la familia de los Quinones (Q = quinone) contenido en todas las células como parte de la cadena de transferencia de electrones para la producción de energía (Ciclo de Krebs). Es un agente antioxidante, lo que representa su principal función, gracias a la capacidad de transferir electrones a otras sustancias que han sido oxidadas, devolviéndoles su estado íntegro. El CoQ10 ha demostrado inhibir la oxidación de los lípidos de la membrana y de las lipoproteínas (séricas) de baja densidad (30-33).
Los estudios clínicos han demostrado que la conenzima Q10 penetra en las capas epiteliales y reduce el nivel de oxidación, previene los daños oxidantes del ADN en los queratinocitos expuestos al ataque de los rayos UVA y suprime la acción de las enzimas líticas como las colagenasas en los fibroblastos expuestos a los rayos UVA (34-36).
Se ha efectuado estudios relativos al uso de la CoQ10 en la enfermedad periodontal, que han mostrado cómo su aplicación tópica ha determinado una mejora de las dolencias de las encías en general y del sangrado, tanto como tratamiento único como asociado a terapia no quirúrgica (37, 38).
Macadamia alternifolia (extracto de té verde)
El aceite de té verde es un aceite esencial de una mezcla de al menos ocho aceites diferentes. La propiedad antioxidante del té verde está relacionada con la presencia de los polifenoles en él contenido, especialmente los flavanoides, también conocidos con el nombre de catequinos; algunos catequinos han demostrado poder modular procesos bioquímicos relacionados con la proliferación celular y con las respuestas inflamatorias (39, 40). El té verde ha demostrado además una propiedad antibacteriana contra diferentes microorganismos, incluidos los microorganismos orales, relacionados con la actividad citolítica (41).
Centella asiática
Está constituida por tritepernos, entre los cuales los más eficaces son el asiaticósido y el ácido asiático (42, 43), capaz de modular el desarrollo del tejido conectivo, estimulando la proliferación celular y la síntesis de glicosaminoglicanos y colágenos, determinando una repitelización más rápida y eficaz con formación de un tejido más consistente y denso, sin formación de queloides cicatriciales (42-45).
Asimismo promueve la angiogénesis, mejorando la circulación a nivel del área capilar (42).
Vitamina K (Fitonadione)
La vitamina K está contenida en las hojas verdes de los vegetales de la dieta y participa en el proceso de coagulación de la sangre manifestando propiedades antihemorrágicas (46, 47).
Materiales y métodos
El grupo experimental estuvo formado por individuos relacionados con periodoncia, patología oral, ortodoncia, odontología infantil, cirugía oral de la clínica universitaria del hospital S. Gerardo, de la ciudad de Monza.
Se organizó un ensayo clínico aleatorizado, con el uso para el grupo control de placebo, en un diseño doble ciego. Los individuos del estudio no fueron informados acerca de las características del medicamento, ni tampoco los odontólogos que evaluaron clínicamente los casos; los medicamentos fueron identificados mediante dos señales de color diferente en el tubo de crema.
A los pacientes se les solicitó su autorización, por medio de un formulario.
El medicamento fue administrado en tres ámbitos principales (Cuadro 2):
— Ámbito de patologías orales (áreas ortodoncia-odontología infantil-patología oral).
— Ámbito de periodoncia (área periodoncia).
— Ámbito postquirúrgico (área cirugía oral).
 Patología oral
Patología oral
Fueron evaluados individuos relacionados con los siguientes problemas:
— Patología aftósica, tanto en el ámbito de la odontología infantil (infancia y adolescencia) como en individuos adultos sin patologías sistémicas.
— Úlceras traumáticas en las que se incluyen lesiones por:
a) decúbito de prótesis removibles, en los pacientes adultos;
b) uso de aparatos ortodónticos removibles, en pacientes infantiles;
c) mordeduras o traumatismos dentales.
— Otras lesiones ulcerosas.
Entre estos individuos, se seleccionaron aleatoriamente los paciente para el grupo experimental, que recibieron el medicamento, y, para el grupo control, a los que se administró el placebo.
En los individuos con varias lesiones del mismo tipo (úlceras con las mismas dimensiones, que surgieron a partir de un periodo de tiempo variable en el lapso de algunos días) participaron, tanto en el grupo control como en el experimental, adjudicando una lesión a cada grupo.
El medicamento fue administrado directamente en las lesiones tres veces al día por siete días.
El paciente escribió en un diario clínico de autoevaluación el nivel de dolor por cada día, según una escala analógica visual (VAS) de 0 a 10. En la visita de control después de siete días fue rellenada una ficha de evaluación clínica de las lesiones, según una escala 1, 2, 3 en que 1 = ausencia de cura de la lesión, 2 = cura parcial de la lesión, 3 = cura completa de la lesión. Las evaluaciones fueron realizadas siempre por el mismo investigador.
Ámbito postquirúrgico
Fue evaluado el dolor y el sangrado postquirúrgico después de la extracción y sutura del alveolo.
Se seleccionaron individuos con características similares: intervalo de edad, fumadores, ausencia de alteraciones de la capacidad reparativa y alteraciones de la coagulación relacionadas con el uso de fármacos o con patologías sistémicas (por ejemplo, diabetes), con una distribución aleatoria en cada uno de los grupos del estudio.
La crema fue aplicada localmente por el paciente tres veces al día durante una semana.
El paciente anotó en un diario clínico de autoevaluación el dolor, mediante una escala VAS de 0 a 10 y de la presencia o no de sangrado del alveolo postextracción, según una escala 1,2 (1 = ausencia de sangrado, 2 = presencia de sangrado).
Durante la visita de control, después de una semana de la intervención, en la que se retiró la sutura, se evaluaron las características clínicas del alveolo postextracción, valorando la ausencia de inflamación del alveolo y de edema, según una escala 1, 2, en la que: 1 = cura parcial, 2 = cura completa. Todas las evaluaciones fueron realizadas siempre por el mismo investigador.
Ámbito periodontal
Fue seleccionado un número variable de individuos con enfermedades periodontales con los siguientes problemas:
— Señales clínicas de inflamaciones en las encías.
— Bolsas periodontales
con lesiones múltiples del mismo aspecto.
Se rellenó la ficha periodontal de pretratamiento que incluía:
— Índice de sangrado (0 = ausencia de sangrado en el sondeo, 1 = sangrado en el sondeo).
— Profundidad de sondeo y pérdida de inserción.
Tras haberse efectuado la terapia periodontal inicial, se seleccionaron un número equivalente de lesiones con características similares según la evaluación de la ficha periodontal, y de modo aleatorio se administró el medicamento en la mitad de las lesiones y en la otra mitad se administró el placebo.
Los medicamentos se administraron tópicamente tres veces al día, después de las maniobras de higiene oral domiciliaria.
Se efectuó una visita de control tras una semana, con una nueva evaluación de las lesiones estudiadas como en la ficha de pretratamiento, evaluando el índice de sangrado, la profundidad de sondeo y la pérdida de la inserción.
Las evaluaciones fueron efectuadas siempre por el mismo investigador.
Resultados
Patología oral
Fueron evaluados 40 pacientes con patologías de las mucosas orales, especialmente:
— 9 pacientes con lesiones aftósicas;
— 18 pacientes pediátricos con úlceras traumáticas por uso de aparatos ortodónticos removibles;
— 6 pacientes adultos con lesiones traumáticas por decúbito de prótesis removibles;
— 7 pacientes adultos con lesiones de mordedura o traumatismo dental.
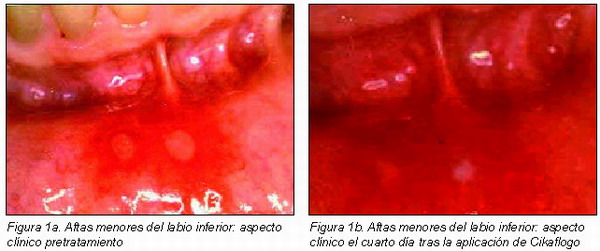
En el 80 por ciento de los individuos a los que se aplicó tanto Cikaflogo como la crema placebo en dos lugares diferentes de la cavidad bucal con las mismas lesiones, el nivel de cura y cicatrización de las lesiones fue completo en las lesiones del grupo experimental y parcial en las del grupo control después de una semana (Figuras 1 y 2).
El restante 20 por ciento de los individuos tanto en el grupo experimental como en el de control, mostraron, una semana después, una cura completa de las lesiones ulcerativas.
En los pacientes que no se logró una cura completa de la lesión ulcerativa se produjo una disminución del diámetro de la lesión en el 77,5 por ciento del grupo experimental (Cikaflogo) y en el 5 por ciento de los casos en el grupo control (placebo).
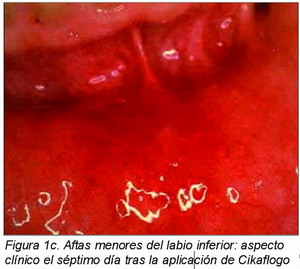
En la Figura 1 es posible observar el aspecto clínico de dos lesiones ulcerativas aftósicas del labio inferior pretratamiento (Figura 1a), el cuarto día de aplicación (Figura 1b) y el séptimo día de aplicación (Figura 1c) de la crema de Cikaflogo.
 |
 |
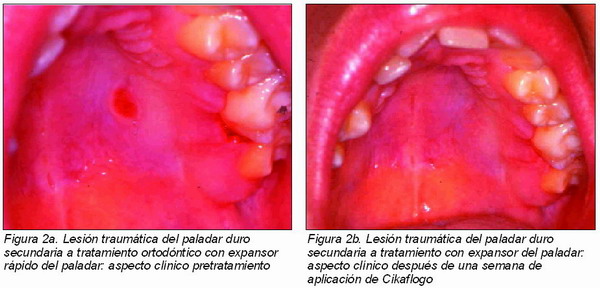
 En la Figura 2 está representado otro caso con una lesión ulcerativa del paladar duro de unos 6 mm de diámetro de origen traumática, secundaria a tratamiento con expansor rápido del paladar, provocada por el contacto del aparato con la mucosa del paladar, antes del tratamiento (Figura 2a) y después de una semana de aplicación de Cikaflogo (Figura 2b).
En la Figura 2 está representado otro caso con una lesión ulcerativa del paladar duro de unos 6 mm de diámetro de origen traumática, secundaria a tratamiento con expansor rápido del paladar, provocada por el contacto del aparato con la mucosa del paladar, antes del tratamiento (Figura 2a) y después de una semana de aplicación de Cikaflogo (Figura 2b).
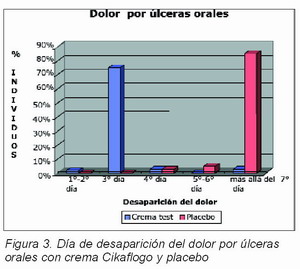
Los registros clínicos de autoevaluación del dolor demostraron una desaparición del mismo (valor 0) al segundo día de aplicación de la crema Cikaflogo en el 20 por ciento de los casos; al tercer día en el 75 por ciento de los casos, tras el cuarto día en el 2,5 por ciento de los casos, mientras el dolor resultaba ser aún positivo al séptimo día de aplicación sólo en el 2,5 por ciento de los casos.
En el grupo control (placebo) no hubo registro 0 de dolor ni al segundo ni al tercer día de aplicación de la crema; al cuarto día despareció el dolor en el 2,5 por ciento de los casos, al quinto día, en el 5 por ciento y después del quinto día en el 7,5 por ciento, mientras era aún positivo en el 85 por ciento de los casos (Figura 3).
Ámbito postquirúrgico
Se evaluaron 12 pacientes sometidos a extracción de dientes permanentes con cirugía oral de la clínica odontológica.
El 66,6 por ciento de los pacientes no tuvieron sangrado postextracción
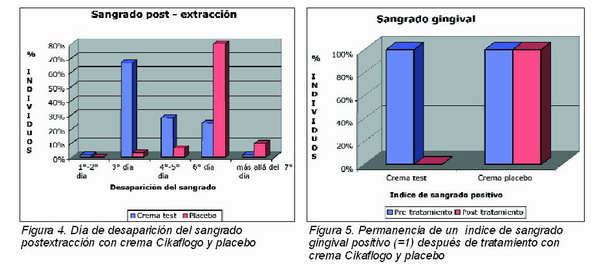
Entre los pacientes que mostraron sangrado postextracción tras procedimientos quirúrgicos complejos, el 77,7 por ciento de los que recibieron Cikaflogo mostraron un cese del sangrado entre el 2° y 3° día de tratamiento, mientras que en los individuos que recibieron placebo, el sangrado se detuvo en casi todos los casos al 6° día tras la extracción (80 por ciento) (figura 4).
Asimismo, los valores de dolor atribuidos por el paciente mostraron una disminución importante en el transcurso de los días con respecto a los pacientes tratados con placebo, puesto que al tercer-cuarto día el 72,5 por ciento de los individuos tratados con Cikaflogo manifestaron una disminución de 3 puntos en la escala de autoevaluación del dolor, mientras que la mayor parte de los pacientes del grupo control (62,5 por ciento) mostraron una disminución de 0 (cero) a 1 punto.
En ningún caso hubo edema o inflamación del alveolo.
Ámbito periodontal
Se evaluaron 20 pacientes del área periodontal de la clínica odontológica, con la siguiente patología:
— 6 pacientes con gingivitis, sometidos a limpieza de ultrasonidos por encima de las encías.
— 9 pacientes con periodontitis, sometidos a raspaje y alisado radicular mediante técnica de Widman modificada;
— 5 pacientes con periodontitis, sometidos a raspaje y alisado radicular sin cirugía.
Los datos relativos a la evaluación clínica periodontal pre y postratamiento después de una semana indican que:
— en el 100 por cien de los individuos del estudio los valores de sondeo periodontal postratamiento no demostraron variaciones importantes con respecto a los valores pretratamiento tanto con la aplicación de Cikaflogo como con la aplicación de placebo;
— en el 100 por cien de los pacientes el índice de sangrado, positivo (1) en la situación pretratamiento, fue 0 (cero) en los lugares de aplicación de Cikaflogo, mientras permaneció positivo (1) en los lugares de aplicación de la crema placebo (Figura 5);
— en 14/20 pacientes (70 por ciento) se detectó una diferencia en el aspecto inflamatorio postratamiento de las mucosas de las encías, que resultó ser, según la evaluación objetiva del clínico, menos acentuada en los lugares de aplicación de Cikaflogo con respecto a los lugares de aplicación del placebo.
Discusión de los resultados y conclusiones
Fueron evaluados 72 individuos de las áreas Ortodoncia, Odontología infantil, Patología Oral, Periodoncia y Cirugía Oral de la Clínica Odontológica de la Universidad de Milán (Bicocca).
Los resultados fueron mejores en el grupo experimental con respecto al grupo control en los tres ámbitos del estudio. El uso de Cikaflogo en la cura de los tejidos blandos de la cavidad bucal fue eficaz en la reducción del dolor de úlceras orales de diferentes orígenes (aftósicas y traumáticas), a partir del tercer día de aplicación, y en lograr una mejor y más rápida cicatrización de las lesiones, que fueron completas tras 4 – 6 días de la aplicación. El uso de la crema está indicado tanto en individuos adultos con lesiones traumáticas de la cavidad bucal debidas a mordeduras o incluso a traumatismos de prótesis removibles, como en el alivio de la sintomatología dolorosa y urente de aftas o lesiones provocadas por aparatos ortodónticos en niños, siendo de fácil empleo y bien tolerado incluso en pacientes pediátricos.
En el ámbito postquirúrgico Cikaflogo se demostró eficaz en la reducción del dolor y del sangrado tras la extracción a partir del tercer día de aplicación, disminuyendo de este modo las molestias de las intervenciones quirúrgicas en la cavidad bucal.
Ante la presencia de patologías periodontales, la aplicación de Cikaflogo después de terapia periodontal mejoró la desaparición del sangrado de las encías (nivel encías = 0), mostrándose útil en la reducción de los síntomas clínicos de inflamación. Asmimismo, su aplicación no influyó en la profundidad de sondeo ni en la pérdida de inserción. El medicamento ha confirmado las propiedades antiinflamatorias y antihemorrágicas de sus componentes en los tejidos de las encías, sin mostrar actividad reparativa-reconstructiva a nivel de los tejidos periodontales.
Cikaflogo, gracias a sus componentes, ha demostrado capacidad cicatrizante, anti-hemorrágica, analgésica y anti-inflamatoria en los tejidos blandos, contribuyendo especialmente en la reducción del dolor relacionado con las lesiones ulcerativas de la cavidad bucal y tras intervenciones como extracciones dentales. Asimismo, ha demostrado su eficacia en el sangrado relacionado con la inflamación de las encías y en las intervenciones quirúrgicas en la cavidad bucal. Se esperan ulteriores estudios acerca de la eficacia de cada componente de la crema, de modo que se puedan evaluar sus propiedades específicas.
Bibliografía
1. Chen WYJ, Abatangelo G. Functions of hyaluronan in wound repair. Wound Rep Reg 1999;7:79-89.
2. Weigel PH, Frost SJ, McGary CT, LeBoeuf RD. The role of hyaluronic acid in inflammation and wound healing. Int J Tiss React 1988;10:355-65.
3. Ogston AG, Sherman Tf. Effects of hyaluronic acid upon diffusion of solutes and flow of solvent. J Physiol 1961;17:1-8.
4. Laurent TC, Ogston AG. The interactions between polysaccharides and other macromolecules. 4. The osmotic pressure of mixtures of serum albumin and hyaluronic acid. Biochem J 1963;89:249-53.
5. Knudson CB, Knudson W. Hyaluronan-binding proteins in development, tissue homeostasis, and disease. FASEB J 1993;7:1233-41.
6. Aruffo A, Stamenkovic I, Melnick M, Underhill CB, Seed B. CD44 is the principal cell surface receptor for hyaluronate. Cell 1990;61:1303-13.
7. Hall CL, Yang B, Yang X, Zhang S, Turely EA. Hyaluronan and the hyaluronana receptor RHAMM promote focal adesion turnover and transient tyrosine kinase activity. J Cell Biol 1994;126:575-88.
8. Weigel PH, Fuller GM, LeBoeuf RD. A model for the role of hyaluronic acid and fibrin in the early events during the inflammatory response and wound healing. J Theor Biol 1986;11:219-34.
9. Oksala O, Salo T, Tammi R, Hakkinen H, Jalkanen M, Inki P, Larjava H. Expression of proteoglycans and hyaluronan during wound healing. J Histochem Cytochem 1995;43:125-35.
10. Culp LA, Murray BA, Rollins BJ. Fibronectin and proteoglycans as determinants of cell-substratum adhesion. J Supramol Struct 1979;11:401-27.
11. Ialenti A, Di Rosa M. Hyaluronic acid modulates acute and chronic inflammation. Agent Action 1994; 43:44-7.
12. Cortivo R., Brun P, Cardarelli L, O’Regan M, Conconi MT, Radice M, Abatangelo G. Antioxidant effects of hyaluronan and its alpha-methyl-prednisolone derivative in chrondrocyte and cartilage cultures. Sem Arthritis Rheum 1996;26:492-501.
13. Presti D, Scott JE. Hyaluronan-mediated protective effect against cell damage caused by enzymatically produced hyddroxyl (OH) radical is dependent on hyaluronan molecular mass. Cell Biochem Funct 1994;12:281-8.
14. Nitzan DW, Nitzan U, Dan P, Yedgar S. The role of hyaluronic acid in protecting surface-activephosopholipids from lyisis by exogenouos phosopholipase A(2). Rheumatology (Oxford) 2001 Mar;40(3):336-40.
15. Foschi D, Castoldi L, Radaelli E, Abelli P, Calderini G, Rastrelli A. et al. Hyaluronic acid prevent oxygen free-radical damage to granulation tissue: a study in rats. Int J Tiss React 1990; 12:333-9.
16. West DC, Kumar S. The effect of hyaluronate and its oligosaccharides on endothelial cell proliferation and monolayer integrity. Exp Cell Res 1989;183:179-96.
17. Longaker MT, Chiu ES, Adzick NS, Stern M, Harrison MR, Stern R. Studies in fetal wound healing. 5. A prolonged presence of hyaluronic acid characterizes fetal wound fluid. Ann Surg 1991;213:292-6.
18. King SR, Hickerson WL, Proctor KG, newsome AM. Beneficial actions of exogenous hyaluronic acid on wound healing. Surgery 1991;109:76-84.
19. West DC, Shaw DM, Lorenz P, Adzick NS, Longaker MT. Fibrotic healing of adult and late gestation fetal wounds correlates with increased hyaluronidase activity and removal of hyaluronan. Int Biochem Cell Biol 1997;29:201-10.
20. Jentsch H, Pomovski R, Kundt G, Gocke R. Treatment of gingivitis with hyaluronan. J Clin Periodontol 2003 Feb;30(2):159-64.
21. Davis RH, Leitner MG, Russo JM, Byrne ME. Wound healing. Oral and topical activity of Aloe vera. J Am Podiatr Med Assoc 1989 Nov;79(11):559-62.
22. Hutter JA, Salman M, Stavinoha WB, Satsangi N, Williams RF, Streeper RT, Weintraub ST. Antiinflammatory C-glucosyl chromone from Aloe barbadensis. J Nat Prod 1996 May;59(5):541-3.
23. Davis RH, Donato JJ, Hartman GM, Haas RC. Anti-inflammatory and wound healing activity of a growth substance in Aloe vera. J Am Podiatr Med Assoc 1994 Nov; 84:77-81.
24. Yagi A, Egusa T, Aras M et al. Isolation and characterization of the glycoprotein fraction with a proliferation-promoting activity on human and hamster cells in vitro from Aloe vera gel. Planta Med 1997; 63(1):18-21.
25. Lee KY, Weintraub ST, Yu BP. Isolation and identification of a phenolic antioxidant from Aloe barbadensis. Free Radic Biol Med 2000 Jan 15;28(2):261-5.
26. Choi SW, Son BW, Son YS, Park YI, Lee SK, Chung MH. The wound-healing effect of a glycoprotein fraction isolated from aloe vera. Br J Dermatol 2001 Oct;145(4):535-45.
27. Lee MJ, Lee OH, Yoon SH et al. In vitro angiogenic activity of Aloe vera gel on calf pulmunary artery endothelial (CAPE) cells. Arch Pharmacol Res 1998;21:260-5.
28. Davis RH, Rosenthal KY, Cesario LR, Rouw GA. Processed Aloe vera administered topically inhibits inflammation.J Am Podiatr Med Assoc. 1989 Aug;79(8):395-7.
29. Wu CD, Savitt ED. Evaluation of the safety and efficacy of over-the-counter orale hygiene products for the reduction and control of plaque and gingivitis. Period 2000 2002; 28:91-105.
30. Kaikkonen J, Tuomainen TP, Nyyssonen K, Salonen JT. Coenzyme Q10: absorption, antioxidative properties, determinants, and plasma levels. Free Radic Res. 2002 Apr;36(4):389-97.
31. Hojerova J. [Coenzyme Q10–its importance, properties and use in nutrition and cosmetics] Ceska Slov Farm 2000 May;49(3):119-23.
32. Melissa C, Baumann L, Baumann LS. The use of cosmoceutical moisturizers. Dermatol Ther 2001; 14: 200-207.
33. Tomasetti M, Littarru GP, Stocker R, Alleva R. Coenzyme Q10 enrichment decreases oxidative DNA damage in human lymphocytes. Free Radic Biol Med 1999 Nov;27(9-10):1027-32.
34. Pugliese PT. The skin»s antioxidant systems. Dermatol Nurs 1998 Dec;10(6):401-16.
35. Hoppe U, Bergemann J, Diembeck W, et al. Coenzyme Q10 – a cutaneous antioxidant energizer. Biofactors 1999;9:371-78.
36. Geromel V, Kadhom N, Ceballos-Picot I, Chretien D, Munnich A, Rotig A, et al. Human cultured skin fibroblasts survive profound inherited ubiquinone depletion. Free Radic Res 2001 Jul;35(1):11-21.
37. Hanioka T, Tanaka M, Ojima M, Shizukuishi S, Folkers K. Effect of topical application of Conzyme Q10 on adult periodontitis. Mol Aspects Med 1994;39 (11):1001-1002.
38. Iwamoto Y, Nakamura R, Folkers K, Morrison RF. Study of periodontal disease and coenzyme Q.Res Commun Chem Pathol Pharmacol 1975 Jun; 11(2):265-71.
39. Katiyar SK, Ahmad N, Mukthtar HS. Green tea and skin. Arch Dermatol 2000;136:989-994.
40. Katiyar SK, Matsui MS, Elmets CA, Mukthtar HS. Polyphenolic antioxidant –)-epigallocatechin-3-gallate from green tea reduces UVB-indiced inflammatory responses and infiltration of leukocytes in human skin. Photochem Photobiol 1999;69:148-53.
41. Faoagali J, George N, Leditschke JF. Does tea tree oil have a place in the topical treatment of burns? Burns 1997;23(4):349-51.
42. Shukla A, Rasik AM, Jain GK, Shankar R, Kulshrestha DK, Dhawan BN. In vitro and in vivo wound healing activity of asiaticoside isolated from Centella asiatica. J Ethnopharmacol. 1999 Apr;65(1):1-11.
43. Maquart FX, Chastang F, Simeon A, Birembaut P, Gillery P, Wegrowski Y. Triterpenes from Centella asiatica stimulate extracellular matrix accumulation in rat experimental wounds. Eur J Dermatol 1999 Jun;9(4):289-96.
44. Sunilkumar, Parameshwaraiah S, Shivakumar HG. Evaluation of topical formulations of aqueous extract of Centella asiatica on open wounds in rats. Indian J Exp Biol 1998 Jun;36(6):569-72.
45. Suguna L, Sivakumar P, Chandrakasan G. Effects of Centella asiatica extract on dermal wound healing in rats. Indian J Exp Biol 1996 Dec;34(12):1208-11.
46. Weiser H, Kormann AW. Biopotency of vitamin K. I. Antihemorrhagic properties of structural analogs of phylloquinone as determined by curative prothrombin time tests. Int J Vitam Nutr Res 1983;53(2):143-55.
47. Iriarte Ezcurdia JA, Babio San Salvador JL. [Antihemorrhagic activity of vitamin K 1. (Experimental and clinical results of its use in hemorrhages caused by coumarins] Rev Clin Esp 1966 Jul 15;102(1):26-8.