Miguel Miñana Gómez. Máster de Endodoncia, Universidad de San Antonio. Texas. Profesor colaborador del Máster de Endodoncia. Universidad de Valencia. Endodoncista exclusivo. Alicante / Manuel Peix Sánchez. Profesor asociado de PTD. Facultad de Medicina. Salamanca. Endodoncista exclusivo, Salamanca / Rafael Miñana Laliga. Profesor asociado Odontología Integrada de Adultos. Co-Director del Máster de Endodoncia. Universidad de Valencia. Endodoncista exclusivo. Madrid. Madrid
Resumen
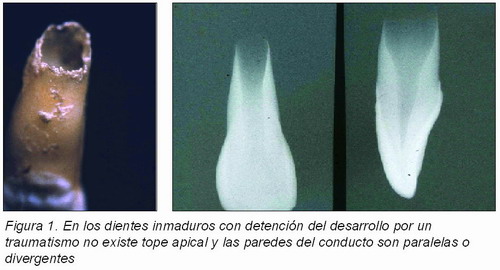
Cuando los dientes inmaduros sufren un traumatismo se puede producir una necrosis pulpar que conlleva a la detención de desarrollo de estos dientes, cuyos conductos presentarán unas paredes paralelas o divergentes en el tercio apical.
Esto supone un desafío endodóncico y restaurador, ya que la forma apical divergente hace casi imposible limpiar y conformar el conducto y, sobre todo, obturarlo correctamente. Gracias a la técnica de inducir la formación de una barrera apical (Apicoformación) empleando hidróxido de calcio se han conseguido innumerables éxitos mediante la obtención de un cierre apical. Sin embargo la susceptibilidad de estos dientes a fracturas hace que el pronóstico del tratamiento sea menos favorable. Esto puede deberse al efecto proteolítico del hidróxido de calcio.
Desde hace unos años se realizan apicoformaciones mediante el empleo de MTA como tapón apical. Las propiedades de este material, así como los resultados obtenidos en los tratamientos, hacen del MTA un material idóneo para tratamientos de apicoformación. Además esta técnica permite reducir el tiempo de tratamiento necesario para una apicoformación clásica con hidróxido de calcio.
Palabras clave
Apicoformación, hidróxido de calcio, Agregado Trióxido Mineral (MTA).
APEXIFICACIÓN CON HIDROXIDO DE CALCIO VS TAPÓN APICAL DE MTA
 Introducción
Introducción
Las lesiones traumáticas de los dientes pueden dar lugar a innumerables formas de patología dentaria: luxaciones, fracturas coronarias sin complicación pulpar, fracturas coronarias con afectación pulpar, fracturas radiculares, reabsorciones, avulsiones, entre otras.
El principal objetivo en la terapéutica endodóncica es la obturación completa del espacio del conducto radicular. Un factor esencial para conseguir este objetivo es obtener un buen stop apical; pues gracias a esto se obtiene una condensación correcta del conducto radicular que conduce al éxito.
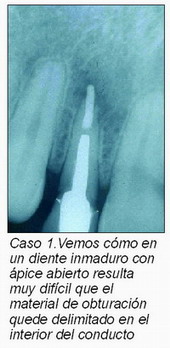
Sin embargo, cuando los dientes inmaduros han sufrido un traumatismo que provoca una necrosis pulpar con pérdida de vitalidad, conlleva a la detención de desarrollo de estos dientes; lo que hace que el conducto presente unas paredes paralelas o divergentes en el tercio apical y que el tope apical no se produzca (Figura 1). Esta circunstancia conduce a la imposibilidad de que el material de obturación quede delimitado por el espacio pulpar (caso 1).
 El cese del desarrollo radicular causado por un trauma o por una afectación pulpar presentan un desafío endodóncico y restaurador, ya que la forma apical divergente hace casi imposible limpiar y conformar el conducto y, sobre todo, obturarlo correctamente.
El cese del desarrollo radicular causado por un trauma o por una afectación pulpar presentan un desafío endodóncico y restaurador, ya que la forma apical divergente hace casi imposible limpiar y conformar el conducto y, sobre todo, obturarlo correctamente.
Apexificación con hidróxido de calcio
La técnica de inducir la formación de una barrera apical, llamada Apicoformación, fue presentada por Kaiser1 y Frank2 en 1964, empleando hidróxido de calcio. Gracias a esta técnica se han conseguido innumerables éxitos, por la obtención de un cierre apical y evitándose así la cirugía en estos jóvenes pacientes.
Muchos materiales y técnicas se han empleado con éxito, sin embargo el hidróxido de calcio ha sido el material de elección más utilizado.
Se han escrito múltiples artículos y presentados innumerables casos durante todos estos años, destacando los de Andreasen, que describe en todas sus publicaciones y libros de texto; los de Cvek; y sobre todo los trabajos de Heithersay3 y de Webber4.
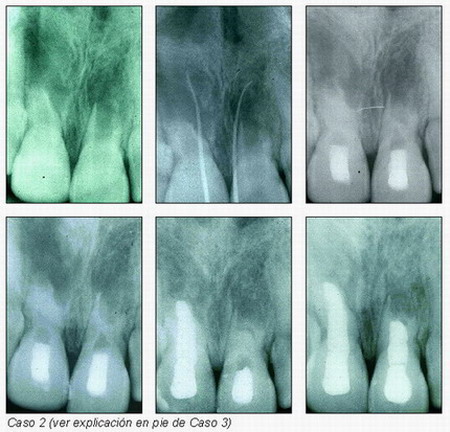
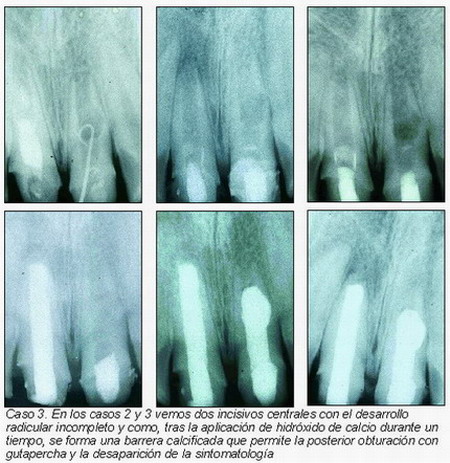
En los casos que se presentan (casos 2 y 3) se observa una formación de una barrera apical que permite la obturación y sellado del conducto. Hay, por tanto, unos resultados muy gráficos y alentadores, con éxitos que llevan emparejados la desaparición de la sintomatología y de la patología periradicular; visualizándose radiográficamente una barrera calcificada apical. Esto permite calificar esta técnica de fácil de realizar y con muy buenos resultados.
Pero, a pesar de los éxitos conseguidos con el hidróxido de calcio, la técnica de apicoformación con este material presenta varias desventajas, como son las múltiples citas necesarias en un largo periodo de tiempo, la colaboración del paciente, el resultado impredecible de formación de una barrera apical, problemas estéticos, gastos, y sobre todo, susceptibilidad a microfiltraciones coronarias y a fracturas de estos dientes debilitados.
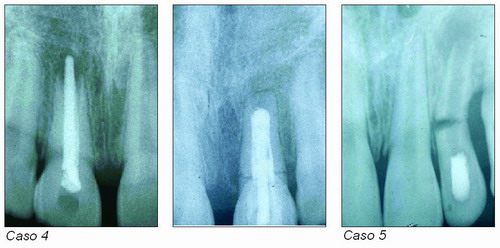
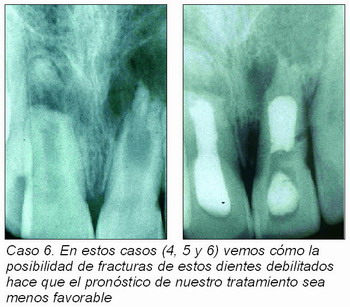
Una alternativa a las múltiples citas ha sido el emplear una barrera artificial apical que impida la sobreobturación, como fosfato tricálcico5, un tapón de dentina6, hidróxido de calcio, cemento de fosfato cálcico7, etc. Y aunque se alivian algunos problemas, la posibilidad de fracturas radiculares a menudo nubla el pronóstico. En los casos siguientes se observan estos problemas (casos 4, 5 y 6).
Varias teorías se han defendido para explicar cómo se desarrolla una barrera apical, pero el mecanismo exacto de acción sigue siendo desconocido; aunque todos los investigadores coinciden que el desbridamiento del espacio pulpar es un factor crítico para conseguir una apicoformación.
Sin duda lo más descorazonador es que estos dientes son susceptibles a fracturas, ya que las frágiles paredes del conducto radicular pueden quedar tan débiles que no puedan soportar las fuerzas normales de la masticación.
Según Cvek8, un trauma sobre la dentición en desarrollo es mucho más frecuente en los dientes del grupo maxilar y con frecuencia pueden conducir a la necrosis pulpar y a la posterior detención del desarrollo del diente, por lo tanto, el profesional se tropieza con la dificultad del tratamiento endodóncico, además del problema de restaurarlo al tener unas paredes dentinales tan finas.
 |
 |
El tratamiento de apexificación en estos dientes es predecible con un gran número de éxitos, sin embargo las finas paredes dentinales en la unión cemento-dentinaria, hacen que sean propensos a fracturas por un trauma secundario, por ejemplo, al morder o por un ligero traumatismo, haciéndoles más difíciles de restaurar.
Los estudios de Cvek han mostrado que a pesar de conseguir el tratamiento con éxito, hay aproximadamente entre un 28 por ciento a un 77 por ciento de estos dientes que pueden fracturarse durante o después del tratamiento, dando la impresión a muchos clínicos que este tratamiento tiene un pobre pronóstico; sin embargo el autor afirma que el pronóstico de estos dientes necróticos e inmaduros, dependerá, en gran manera, del estado de desarrollo en el momento de la muerte pulpar.
Cvek8 clasificó el desarrollo radicular en cuatro estadíos, por estimación radiográfica de la anchura del foramen apical y del largo de la raíz.
Los resultados muestran que a los cuatro años de terminar el tratamiento, hay fracturas cervicales en:
Un 77 por ciento en estadío 1 (conducto ancho, divergente apertura apical y largo de la raíz menor que la mitad del largo final).
El 53 por ciento en estadío 2 (conducto ancho, apertura apical divergente, largo de raíz la mitad del largo final).
Del 43 por ciento en estadío 3 (conducto ancho, apertura apical divergente, largo de raíz dos tercios del largo final).
Un 28 por ciento en estadío 4 (foramen apical abierto, raíz casi completamente formada)
Ante estos hallazgos, el autor concluía diciendo que la aparición de fracturas cervicales en más de la mitad de los dientes con formación radicular inmadura tratados endodóncicamente, podría ser debida al acción del hidróxido de calcio.
De todos es sabido que el hidróxido de calcio es una medicación muy efectiva en el tratamiento de complicaciones pulpares y periodontales después de un traumatismo gracias a su capacidad de esterilizar los tejidos y de cicatrizar el tejido duro.
Sin embargo se ha visto que este material posee un efecto proteolítico muy fuerte9; por tanto, la posible razón de la alta incidencia de fracturas cervicales radiculares en dientes que han sido tratados con una técnica de apicoformación con hidróxido de calcio (además de presentar unas paredes radiculares finas propias de los diente en desarrollo) podría deberse al efecto adverso del hidróxido de calcio sobre la dentina, que la hace progresivamente más frágil, mucho más cuanto más tiempo están en contacto dentina e hidróxido de calcio10.
Este efecto proteolítico al igual que disuelve los restos pulpares en una semana, también afecta la dentina de alrededor, haciéndola con el tiempo (unos meses) más frágil11.
Es importante conocer la relación entre el tiempo y sus efectos, por lo que el uso del hidróxido de calcio solo deberá limitarse a unas pocas semanas14.
El MTA en Endodoncia
Desde 1993 se está empleando un nuevo material en Endodoncia, el Agregado de Trióxido Mineral (MTA), para sellar las comunicaciones entre la cámara pulpar, el sistema del conducto radicular y los espacios periradiculares.
Los principales componentes del MTA son silicato tricálcico, aluminato tricálcico, óxido tricálcico, óxido de silicato, además de otros óxidos minerales, los cuales son responsables de las propiedades físicas y químicas del agregado.
La hidratación del polvo da lugar a un gel coloidal que solidifica en una estructura dura que fragua en menos de 4 horas y que tiene una fuerza de compresión igual a la de la amalgama. Las características del MTA dependen del tamaño de las partículas, la relación polvo-agua (3 a l), la temperatura ambiente, y de la presencia de humedad y de aire entre las partículas.
Los primeros estudios sobre las aplicaciones del MTA se realizaron en el sellado de perforaciones laterales14 y sobre su capacidad de sellado como material de obturación15.
Desde entonces los estudios hechos sobre el MTA han sido innumerables: En 1995 se investigó su filtración; adaptación marginal; biocompatibilidad; citotoxicidad y mutagenicidad, entre otros.
En 1996 se estudiaron la respuesta de los tejidos periradiculares; efectos sobre la pulpa del perro; la influencia sobre el cierre apical; como material de recubrimiento pulpar; reacción de los tejidos óseos; y se describe el primer caso de Apicoformación (Tittle y cols.16).
En 1997 se estudia su potencial osteogénico; la filtración ante bacterias anaerobias; la formación de un puente dentinario en recubrimientos; tiempo de fraguado y retención; citotoxicidad sobre el ligamento periodontal; y es descrito por Shabahang y Torabinejad su aplicación y resultados en Apicoformación17.
Un par de años después en el congreso de la AAE de 1999, Green y cols.18 muestran la similitud en propiedades entre el cemento Pórtland y el MTA, compuestos por los mismos ingredientes, y que ambos tienen unos efectos similares sobre las células pulpares y que favorecen el depósito de una dentina de reparación después de una lesión pulpar.
Funteas y cols.19 afirman que no hay diferencias significativas entre los 14 elementos que componen el cemento Pórtland y el MTA con excepción del Bismuto presente en el MTA.
Presentado en dos colores gris y blanco (Figura 2), adquiere gran popularidad en Estados Unidos y se extiende en todo el mundo, empleándose, sobre todo, como material de obturación a retro en cirugías y en las perforaciones iatrogénicas.
Pero también se comienza a aplicar en las lesiones traumáticas de los dientes, en la terapia de la pulpa viva, recubrimientos y pulpotomías en Odontopediatría12; como barrera artificial en dientes con ápice abierto; en los casos de fracturas radiculares cuando la pulpa del fragmento coronario presenta una necrosis pulpar, con el mismo objetivo que en la apicoformación, el conseguir una barrera artificial contra la que obturar.
Por tanto, desde el año 1999 se vienen realizando apexificaciones mediante el empleo del MTA como tapón apical.
La técnica de empleo de apicoformación con MTA más acertada es la descrita por Bakland20 que consiste en un tratamiento combinado de hidróxido de calcio y de MTA, sin embargo la iconografía que exponemos está tomada del Manual de Traumatismos Dentarios de Andreasen et al, publicado en el año 200313.
La técnica, paso a paso, es la siguiente:
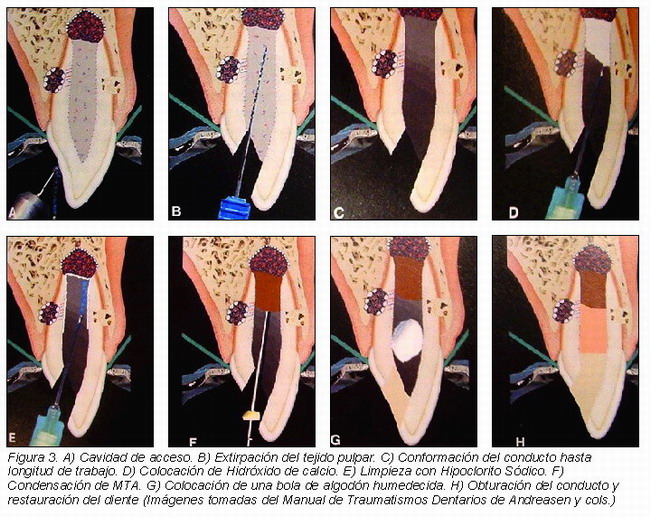
1. Una vez hecho el diagnóstico de necrosis pulpar y ápice abierto, se anestesia la zona y se aísla el diente con el dique de goma. A continuación se realiza la cavidad de acceso, que tendrá por característica ser de igual tamaño o mayor que la cámara pulpar y el conducto (Figura 3A).
2. Se extirpa el tejido pulpar hasta el nivel apical, pudiendo aparecer una ligera hemorragia procedente de tejido periapical sano. Se irrigan abundantemente la cámara y el conducto radicular con hipoclorito sódico (en una proporción en agua del 50 por ciento o menor) (Figura 3B).
3. Se comienza a preparar y conformar el conducto con limas manuales, hasta el largo de trabajo, conseguido previamente con medios radiológicos. Esta preparación deberá hacerse de forma conservadora, nunca agresiva ni violenta, para preservar la mayor cantidad posible de estructura dentinaria de la raíz (Figura 3C).
4. El empleo del hipoclorito sódico favorece la desinfección del conducto y cuando consideramos que este objetivo se ha conseguido, se seca con puntas de papel del 100 al 140, de manera suave, medidas al largo de trabajo.
Una vez seco y sin secreciones, se coloca en el interior del conducto una mezcla de hidróxido de calcio, ya sea preparando el polvo con Agua destilada e introducido con léntulos manuales, o mediante una jeringuilla que contiene este preparado comercial y que suele estar mezclado con metilcelulosa como vehículo. (Figura3D)
A continuación se coloca una bolita de algodón y se sella la cavidad con varios milímetros de una obturación temporal (Cavit®, oxifosfato de zinc o composite).
El hidróxido de calcio deberá estar en el interior del conducto entre un mínimo de 2 semanas a un máximo de 4 semanas.
Como se ha descrito por muchos autores21-23, el hidróxido de calcio tiene un gran efecto desinfectante y antimicrobiano, y reduce la inflamación de los tejidos periapicales.
5. A la visita siguiente, se irriga el conducto con hipoclorito sódico, varias veces, intentando eliminar el hidróxido de calcio, ayudándonos mediante un limado circunferencial con limas manuales medidas al largo de trabajo. Se seca el conducto con puntas de papel (Figura 3E).
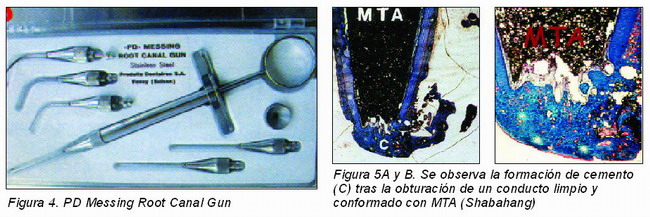
A continuación se prepara la mezcla de MTA con agua destilada o solución anestésica, de tal forma que sea homogénea y manejable. La consistencia del material puede controlarse eliminando el exceso de humedad con una gasa seca. El transporte del material de la loseta a la cámara pulpar puede hacerse mediante un porta-amalgamas aunque, por experiencia personal, el Messing Gun (Figura 4) parece el portador de elección para llevarlo e introducirlo en el conducto.
El MTA se condensa en el conducto con la ayuda de puntas de papel o atacadores de gutapercha, correctamente medidos con topes de goma a 4-5 milímetros del largo de trabajo para evitar la extrusión del material. Se van condensando pequeñas porciones del MTA en el conducto de una forma suave y firme, depositándolo en su parte apical hasta conseguir entre 4 – 5 mm de tapón apical24 (Figura 3F).
Posteriormente conviene comprobar la situación y colocación del MTA mediante radiografías periapicales y, en caso de que su adaptación no sea la correcta, el MTA puede lavarse con solución salina y limas, repitiéndose de nuevo el proceso25.
En determinadas ocasiones si el foramen apical del diente inmaduro es de una anchura que pueda favorecer la posible sobreobturación con MTA, sería aconsejable, antes de poner el MTA, crear un tope con un material reabsorbible de fosfato tricálcico o hidroxiapatita o matriz colágena que favorezca la condensación del MTA sin que haya salida abundante a los tejidos periapicales44.
7. Una vez conseguido el objetivo de obtener un tapón apical de 4-5 mm, para favorecer el fraguado del MTA, que es un material hidrófilo, se coloca una bolita de algodón humedecida en el interior de conducto-cámara pulpar y se sella con un material de obturación temporal (Cavit®, oxifosfato de zinc o composite). El fraguado del MTA se puede conseguir a partir de las 4 horas (Figura 3G).
8. Cuando el MTA ha fraguado, a las 4-6 horas, el tratamiento puede terminarse. Se elimina la bolita de algodón y se confirma, de forma no agresiva, el fraguado y dureza del MTA. A continuación se puede obturar el conducto con cemento sellador y gutapercha termoplástica o mediante la técnica de obturación preferida. En esa misma cita se restaura el diente con un material compuesto (Figura 3H).
La obturación ideal sería la realizada mediante un grabado interno del conducto y un material compuesto desde el tercio medio del conducto (en largo) hasta la cavidad de acceso coronario, para así conseguir fortalecer el diente y hacerlo más resistente a la fractura26.
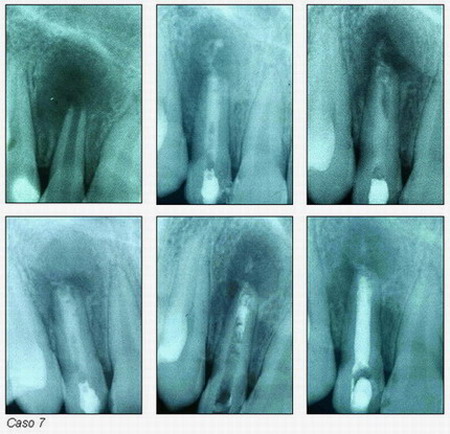
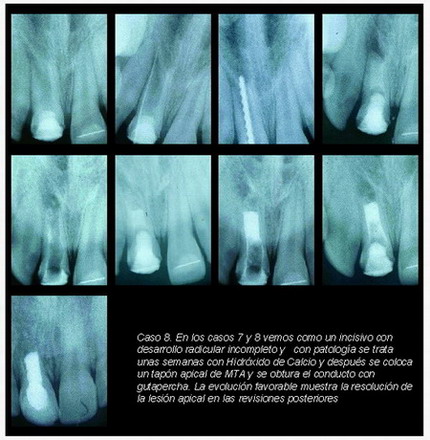
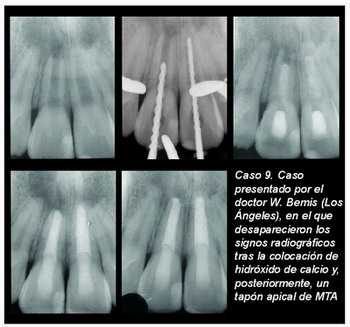
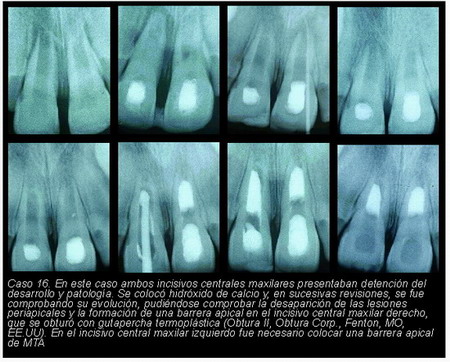
En los distintos casos que presentamos a continuación (casos 7-16) se aprecian los resultados conseguidos con esta técnica en cuanto a morfología según el estado del conducto.
Ante esta situación surge una pregunta: ¿Podemos llamar apicoformación al empleo de MTA como material de barrera apical? La respuesta es sí.
Es aconsejable su uso y, aunque todavía es pronto para confirmarlo, puede estar indicado en la mayoría de dientes necróticos con ápice abierto, e incluso con una morfología apical extraña.
De este modo, el MTA es una alternativa al largo tratamiento de la apicoformación convencional con hidróxido de calcio, porque:
 En primer lugar, la barrera apical que se consigue tiene una buena capacidad de sellado y favorece la formación de un tejido apical duro de gran consistencia y con el mismo grado de inflamación que el hidróxido de calcio o la proteína osteogénica-1.
En primer lugar, la barrera apical que se consigue tiene una buena capacidad de sellado y favorece la formación de un tejido apical duro de gran consistencia y con el mismo grado de inflamación que el hidróxido de calcio o la proteína osteogénica-1.
En segundo lugar, en directa aposición con el MTA hay formación hueso y cemento y un tejido periapical mínimamente inflamado, como vemos en los cortes histológicos de los trabajos de Shabahang y cols.27 (Figuras 5A y 5B).
Numerosas han sido los trabajos sobre el MTA en Apicoformación24, 28, y entresacando alguno de ellos, tenemos los realizados en la Universidad de San Antonio, en Texas29 – en los que se obtiene un tapón de MTA de al menos de 4 mm, no se emplea gutapercha en la obturación, y si un grabado interno del conducto y un sistema de poste de resina reforzado. Gracias a esta técnica se reduce el tiempo de tratamiento y mejora el pronóstico a largo plazo.
En otras publicaciones, se aconseja la condensación manual, como el método preferido para la colocación del MTA30; y que el polvo de MTA que sobra de un paquete abierto puede emplearse pero teniendo en cuenta que en un ambiente muy húmedo este material fraguará más rápidamente31.
Para Fridland y cols.32 la presencia excesiva de liquido hace la mezcla difícil de manejar y de compactar. Por tanto, la relación agua-polvo recomendada por el fabricante (3 a 1) sería la mejor proporción, aunque en ocasiones esta mezcla toma el aspecto como de sopa. Este problema puede resolverse cubriendo la mezcla con una gasa húmeda y esperando hasta obtener la consistencia adecuada.
También se ha recomendado por Stowe y cols.33 el reemplazar el agua por gluconato de clohexidrina al 12 por ciento para aumentar la actividad antimicrobiana del ProRoot MTA.
En otros estudios hechos por Arch y cols.34 se ha visto que el MTA tiene la capacidad de sellar el ápice de manera excelente; y que además tiene capacidad osteogénica y muy buena biocompatibilidad.
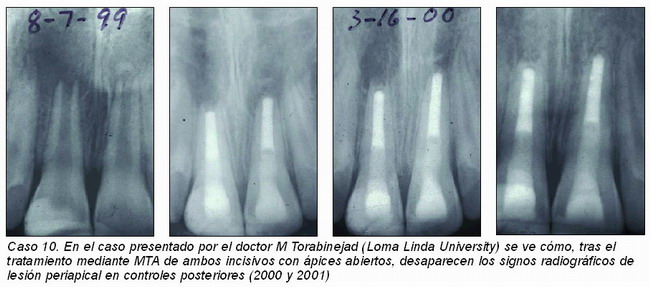
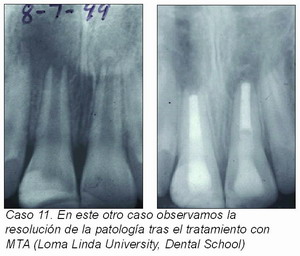
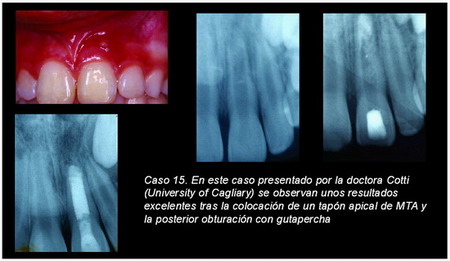
La doctora Cotti35 (caso 11) en su presentación en el IADR (2002) sugiere que el empleo de una barrera apical de un material reabsorbible como matriz, el material de obturación del ápice abierto, puede no garantizar un buen sellado apical.
 En estudios más recientes, Apaydin et al.36 muestran que no hay diferencias significativas en la cantidad de cemento o hueso formados según sea MTA recién preparado o fraguado.
En estudios más recientes, Apaydin et al.36 muestran que no hay diferencias significativas en la cantidad de cemento o hueso formados según sea MTA recién preparado o fraguado.
Bullock y cols.37, refieren que durante su empleo hay que evitar la contaminación con saliva, ya que el MTA no contaminado filtra menos; y si hubiera filtración, ésta ocurriria en la interfase dentina-MTA y no a través del MTA38.
Para Matt y cols.39 al comparar el MTA blanco y el gris en aplicaciones de una o dos visitas, encontraron que el MTA gris filtraba menos que el blanco y que el empleo en dos citas, mostraba menor filtración que si se hacía en una sola sesión. Su recomendación era, que 3-5 mm de barrera apical de MTA gris, empleando una técnica en dos sesiones en casos de ápice abierto se obtendrían mejores resultados.
Pero para conseguir las mejores propiedades y su fraguado al hidratarse, era necesario conseguir en el conducto un pH alcalino, de aproximadamente 9, favoreciendo así el aumento de su dureza; mientras que con un pH 5, que afectaría las propiedades físicas y al fenómeno de la hidratación40.
Para Lawley y cols.41 si se coloca el MTA mediante ultrasonidos, seguido de un material compuesto, se conseguirá un mejor sellado del MTA (de 4 mm), reduciéndose además la posibilidad de fracturas ya que la resistencia obtenida es mayor que con la obturación de gutapercha y cemento sellador.
Sarkar y cols.45 han demostrado que el MTA en un ambiente oral simulado no es un material inerte, es bioactivo; ya que en contacto con un fluido tisular sintético se disuelve liberando todos sus componentes catiónicos y provoca la precipitación de hidroxiapatita en su superficie y en los fluidos de alrededor. Además parece que se une químicamente a la dentina cuando se coloca contra ésta, posiblemente por la reacción-difusión controlada entre la superficie apatítica y la dentina.
Los éxitos clínicos del MTA en la técnicas de sellado, biocompatibilidad y actividad dentinogénica, son debidos, según los autores45, a las reacciones físico-químicas mencionadas.
Ventajas y desventajas del MTA en apicoformación
Entre las ventajas tenemos42:
— La apicoformación en una sola cita puede reducir el tiempo de tratamiento entre la primera cita y la restauración final.
— El sellado apical favorece la regeneración ósea.
— Menos fracturas, ya que una restauración de composite puede colocarse inmediatamente en el interior del conducto radicular, con o sin gutapercha.
Desventajas43:
— Dificultad para prepararlo, manejarlo e introducirlo en el conducto radicular, sobre todo en los dientes largos y estrechos.
— Posibilidad de sobre-obturación.
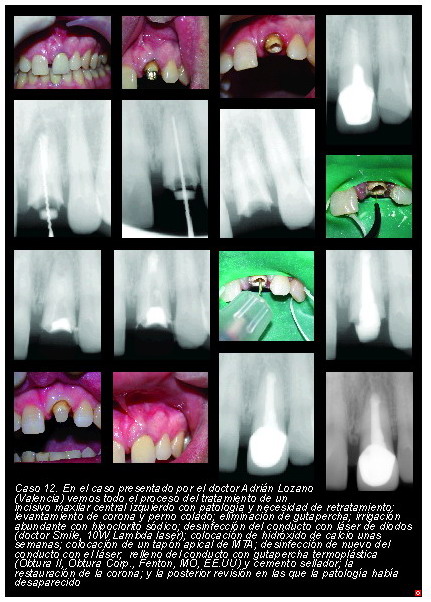
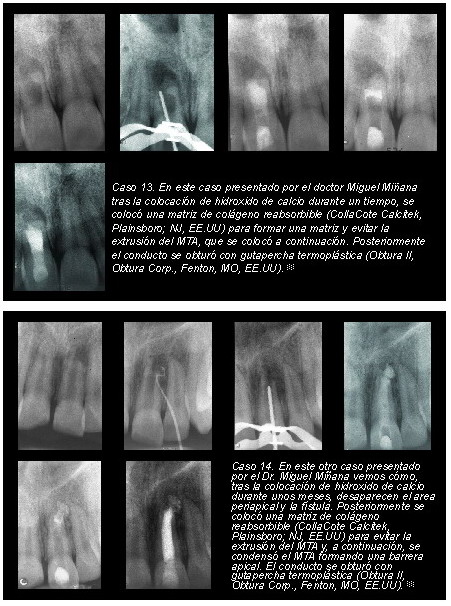
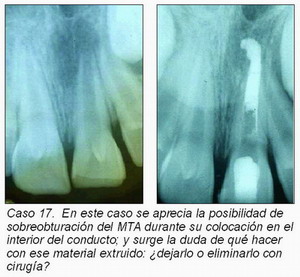
En los siguientes casos (casos 12 y 13) se aprecian estas dificultades.
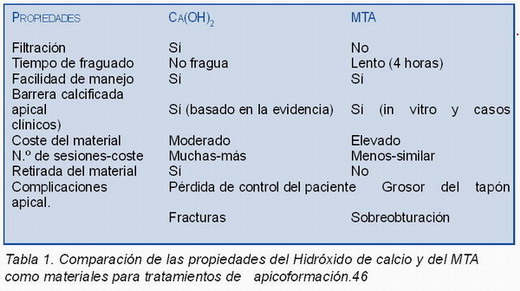
En la Tabla 1 podemos observar las diferencias entre el hidróxido de calcio y el MTA como materiales empleados en tratamientos de apicoformación 46.
Conclusiones
— La apexificación con MTA puede potencialmente eliminar el largo proceso de la apicoformación clásica con hidróxido de calcio.
— Una técnica en dos visitas es mejor que una sola, ya que permite colocar un algodón humedecido que da humedad adicional a la dada por los tejidos periapicales. Esto permite que el MTA alcance sus propiedades más óptimas.
— Con esta técnica no es necesario obturar con gutapercha después de la apicoformación, ya que se puede colocar un material compuesto directamente contra la barrera apical de forma más rápida, y acelerar así el proceso de restauración del diente; reduciéndose el número de fracturas.
— El MTA permite la formación de una barrera apical con buena capacidad de sellado, y además en directa aposición con el MTA hay formación de hueso y cemento y un tejido periapical mínimamente inflamado.
— Es aconsejable seguir las recomendaciones del fabricante al mezclar el MTA para evitar la disminución de sus propiedades.
Sin embargo, todavía quedan algunas cuestiones por solucionar con respecto a esta técnica:
— ¿Qué puede suceder si, por ser la etiología de la muerte pulpar un traumatismo dental, quedara el MTA en los tejidos periradiculares? Y, de forma similar, ¿qué hacer si hay una sobre-obturación con MTA?; o ¿qué pasaría si comienza una reabsorción radicular tras colocar el MTA? En estos casos, ¿estará indicada la cirugía periradicular para eliminar este material?
— Cuáles pueden ser las nuevas tendencias en el tratamiento de estos dientes traumatizados: ¿Revascularización pulpar? ¿Sería esta igual que cuando se reimplanta un diente?
 Bibliografía
Bibliografía
1. Kaiser JH. Management of wide-open canals with calcium hydroxide. Presentation at the American Association of Endodontics. Washington DC, April 17, 1964.
2. Frank Al. Therapy for divergent pulpless tooth by continued apical formation. J Am Dent Assoc, 72: 87, 1966.
3. Heithersay GS. Calcium Hydroxide in the treatment of pulpless teeth with associated pathology. J Br Endod Soc, 1975, Jul, 8(2), 74-93.
4. Webber RT. Traumatic injuries and the expanded endodontic role of Calcium Hydroxide. In: Gerstein H.(ed.) Techniques in clinical endodontics, Philadelphia, WB Saunders Co, 1983, pp. 172-258.
5. Coviello. A preliminary clinical study on the use of tricalcium phosphate as an apical barrier.J Endod, 1979, Jan, 5(1), 6-13.
6. Pitts. A histological comparison of calcium hydroxide plugs and dentin plugs used for the control of Gutta-percha root canal filling material. J Endod, 1984, Jul, 10(7), 283-293.
7. Goodell. Linear dye penetration of a calcium phosphate cement apical barrier. J Endod, 1997, Mar, 23(3), 174-177.
8. Cvek M. Prognosis of luxated non-vital maxillary incisors treated with Calcium Hydroxide and filled with Gutta-percha. A restrospective study. Endod Dent Traumatol, 1992, Apr, 8(2), 45-55.
9. Andersen M et al. In vitro solubility of human pulp tissue in Calcium hydroxide and Sodium hypochloride. Endod Dent Traumatol,1992, Jun 8(3), 104-108.
10. Andreasen JO. Controversies and challenges in the management of luxated teeth. AAE Annual Session 2001.
11. Andreasen JO et al. Long term calcium hydroxide as a root canal dressing may increase risk of root fractures. Dent Traumatol, 2002, 18, 134-137.
12. Maroto M, Barbería E, Planells P. Estudio clínico del agregado Trióxido Mineral en pulpotomías de molares temporales: estudio piloto a 15 meses. RCOE, 2004, 9(1): 23-30.
13. Andreasen JO et al. Traumatic Dental Injuries. A manual. Ed. Blackwell-Munksgaard, 2nd edition, 2003.
14. Lee SJ et al. Sealing ability of Mineral Trioxide Aggregate for repair of lateral perforations. J Endod 1993, Nov 19(11): 541-544.
15. Torabinejad M et al. Sealing ability of Mineral Trioxide Aggregate when used as a root and filling material. J Endod, 1993, Dec 19(12):591-595.
16. Tittle et al. Presentation at the American Association of Endodontics.1996.
17. Shabahang and Torabinejad. Presentation at the American Association of Endodontics. 1997.
18. Green DB et al. MTA vs Portland cement:two biocompatible filling materials. J Endod, April 1999, 25 (4), Abs# 40: 308.
19. Funteas UR et al. A comparative analysis of mineral trioxide aggregate and Portland cement. Aust Endod J 2003, Apr 29(1): 43-44
20. Bakland L. In: Ingle JI Endodontics, 5th Ed., 2002.
21. Bystrom A et al. The antibacterial effect of camphorated paramonochlorophenol, camphorated phenol and calcium hydroxide in the treatment of infected root canals. Endod Dent Traumatol, 1985, Oct, 1(5), 170-175.
22. Sjogren et al. Influence of infection at the time of root filling on the outcome of endodontic treatment of teeth with apical periodontitis. Int Endod J, 1997, Sep, 30(5), 297-306.
23. Katebzadeh J et al. Histological periapical repair after obturation of infected root canals in dogs. J Endod, 1999, May, 25(5), 364-8.
24. Shabahang S, Torabinejad M. Treatment of teeth with open apices using mineral trioxide aggregate. Pract Periodontics Aesthetic Dent 2000, Apr 12(3):315-320.
25. Torabinejad M, Chivian N. Clinical applications of mineral trioxide aggregate. J Endod 1999, Mar 25(3):197-205.
26. Katebzadeh J et al. Stregthening immature teeth during and after apexification. J Endod, 1998, Apr, 24(4), 256-259.
27. Shabahang S et al. A comparative study of root-end induction using osteogenic protein-1, calcium hydroxide and mineral trioxide aggregate in dogs. J Endod 1999, Jan 25(1):1-5.
28. Witherspoon D, Ham K. One visit apexification: Technique for inducing root-end barrier formation in apical closures. Pract Proced Aesthet Dent, 2001, Aug 13(6): 455-460.
29. Hachmeister DR et al. The sealing ability and retention characteristics of mineral trioxide aggregate in a model of apexification. J Endod 2002, May 28(5):386-390.
30. Aminosharae A et al. Placement of mineral trioxide aggregate using two different techniques. J Endod 2003, Oct 29(10): 679-682.
31. Winick MS, Hicks ML. Effect of storage in the setting time of MTA. J Endod 2003; Apr 29 (4); abs#3: 285.
32. Fridland M, Rosado R. Mineral trioxide aggregate (MTA) solubility and porosity with different water-to-powder ratio. J Endod 2003, Dec 29(12):814-817.
33. Stowe TJ et al. Effects of Chorhexidine Gluconate (0.12%) on the antimicrobial properties of tooth-colored ProRoot mineral trioxide aggregate. J Endod, 2004, Jun, 30(6): 429-431.
34. Arch et al. Interaction effects of MTA with simulated biological environments. J Endod 2003, Apr 29(4), Abs#40: 308
35. Cotti E et al. Bacterial penetration of MTA in simulated apexification cases. IADR, 2002 Cardiff, Abs # 158.
36. Apaydin ES et al. Hard tissue healing after application of fresh or set MTA as root-end-filling material. J Endod 2004, Jan 30(1):21-24.
37. Bullock AM et al. Contamination of MTA as root-end-filling material: a bacterial leakage model. J Endod 2004, Apr, 30 (4), Abs#28: 261.
38. Bozeman TB et al. A model for studying core leakage of MTA. J Endod 2004, Apr 30(4), Abs#29:262.
39. Matt GD et al. Comparative study of white and gray MTA simulating a 1-or-2- step apical barrier technique. J Endod 2004, Dec 30(12): 876-879.
40. Lee YI et al. Effects of various pH environments on the hydration behavior of MTA. J Endod 2004, Apr 30 (4), Abs#48: 285.
41. Lawley et al. Evaluation of ultrasonically placed MTA and fracture resistance with intracanal composite resin in a model of apexification. J Endod 2004, Mar 30(3): 167-172.
42. Steinig TH et al. The use and predictable placement of mineral trioxide aggregate in one-visit apexification cases. Aust Endod J 2003, Apr 29(1):34-42.
43. Camp J. Personal communication. M/S Norwegian Sun, Alaska, July 2004.
44. Miñana M. Utilización del agregado trióxido mineral (MTA) como barrera apical en dientes con el ápice abierto. Endodoncia 2000, Jul-Sep 18(3):131-139.
45. Sarkar NK, Caicedo R et al. Physicochemical basis of the biologic properties of mineral trioxide aggregate. J Endod. 2005 Feb;31(2):97-100.
46. Beslot A, Lasfargues JJ. Mineral Trioxyde Aggregate MTA® Matériau d´apexification? Inf Dent 2004, 86 (35): 2263-2273.




