C. Cobo Vázquez. Alumno de tercer curso de Odontología. Universidad Complutense de Madrid / Dra. C. Gasco García. Profesora titular de Anestesiología y Reanimación. Facultad de Odontología Universidad Complutense de Madrid. / V. García Abbad-Jaime de Aragón. Alumna de tercer curso de Odontología. Universidad Complutense de Madrid / B. Gómez Aguilar. Alumna de tercer curso de Odontología
Universidad Complutense de Madrid / P. Pérez León. Alumna de tercer curso de Odontología. Universidad Complutense de Madrid. Madrid
Resumen
El objetivo de este trabajo es revisar la aparición de nuevas recomendaciones profilácticas de la endocarditis bacteriana incluidas en el actual protocolo (2007) a la vez que se recuerdan las características generales de la enfermedad en cuanto a patogenia, clínica y tratamiento. Esta variación supone un pequeño cambio respecto al antiguo protocolo: se mantienen los fármacos establecidos y se cambian las dosis en algunos casos.
Summary
The aim of this work is to check the update of new prophylactic recommendations of the infective bacterial endocarditis included in the current protocol (2007) simultaneously that remember the general characteristics of the disease as for pathogeny, clinic and treatment. This variation supposes a small change with regard to the former protocol: the established medicaments are kept and the doses change into some cases.
Palabras clave
Profilaxis-prevención, endocarditis infecciosa.
Key words
Prevention-prevention, infective endocarditis.
Introducción
Los cambios en el protocolo publicado en 1997 sobre la profilaxis de la endocarditis bacteriana, fueron iniciados por la American Dental Association (ADA), la Infectious Diseases Society of America (IDSA) y la American Academy of Pediatrics (AAP) en base a la sistemática revisión de estudios nacionales e internacionales realizados desde 1950 hasta 2006. El nuevo protocolo establece las siguientes conclusiones:
1. Sólo un mínimo porcentaje de casos de endocarditis bacteriana debe ser prevenido en tratamientos dentales incluso cuando la profilaxis tenga una efectividad del cien por cien.
2. La profilaxis de la endocarditis bacteriana en tratamientos dentales sólo está recomendada en aquellos pacientes que se clasifiquen en el grupo de mayor riesgo de patologías cardiacas susceptibles de padecer endocarditis.
3. En los pacientes anteriormente mencionados la profilaxis será aconsejable cuando se prevea manipulación de tejido gingival, periostio o mucosa yugal con riesgo de sangrado.
4. La profilaxis no está recomendada en los casos en los que se argumente exclusivamente un riesgo de infección sin cardiopatía ni manipulación de tejidos periodontales.
5. La administración de profilaxis está contraindicada en pacientes que padezcan problemas genitourinarios o gastrointestinales (19).
Uno de los estudios revisados para la justificación del anterior protocolo fue llevado a cabo en 1990 en los hospitales franceses de 6 regiones del país, obteniendo una muestra del 26% de la población y comparando estos datos con los obtenidos en investigaciones anteriores y en otros países.
La incidencia de endocarditis bacteriana en 1999 en Francia fue de 31 casos por millón, en el 47% de los casos no existían afecciones cardiacas previas conocidas. La incidencia de la enfermedad en pacientes que conocían su enfermedad cardiaca disminuyó de 21 por millón a 15 por millón, los estreptococos orales se vieron en el 17% de los casos, y sólo en el 8% de los casos se identificó una puerta de entrada dental. Hubo un aumento en los casos debido al grupo de estreptococos, estos microorganismos y los Stafilococcus aureus suponían cada uno un cuarto del total de casos. La cirugía valvular temprana se realizó en el 49% de los pacientes y la mortalidad intrahospitalaria se redujo del 22% al 16% (1, 15, 17, 19).
 |
En conclusión, el cambio de protocolo que realizó la AHA (American Heart Association) fue revisado por otros expertos y demostró un descenso de la incidencia de la enfermedad en los pacientes tratados según las nuevas indicaciones. Estas indicaciones, además, pretendían unificar y simplificar los criterios de aplicación de la profilaxis de la endocarditis bacteriana (19).
El paciente pediátrico con cardiopatía congénita es todo aquel cuya edad esté comprendida desde el alumbramiento hasta el inicio de la pubertad (en torno a los 12-14 años) y que padezca algún tipo de alteración cardiaca o del sistema circulatorio por un desarrollo anormal del mismo antes de su nacimiento.
La incidencia de cardiopatías congénitas es del 1% y su aparición está condicionada por una serie de factores exógenos (dependientes de la madre y/o del entorno) y que, aunque no en todos los casos, permiten pronosticar la existencia de defectos cardiacos en el neonato. Entre estos factores destacan:
• Existencia de cardiopatía en el padre, la madre o algún hermano biológico.
• Madre diabética.
• Madre con rubeola toxoplasmosis (por contacto con la materia fecal de los gatos) o virus de inmunodeficiencia humano (VIH).
• Consumo de cualquier tipo de droga (principalmente alcohol o cocaína) o de medicamentos durante el embarazo.
La endocarditis bacteriana es una patología inflamatoria del endocardio parietal y/o valvular secundaria a fenómenos infecciosos, aunque también existe una variedad de la endocarditis no secundaria a fenómenos infecciosos sino a reacciones antígeno-anticuerpo desencadenadas por la producción de estos últimos contra los Streptococcus B-hemolíticos de la amigdalitis crónica.
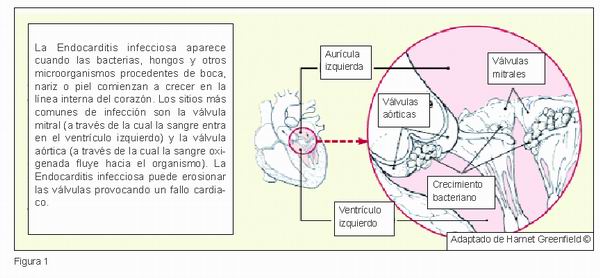
Los microorganismos que producen endocarditis se alojan en la piel, en la boca, en la nariz, y dentro del aparato digestivo (Figura 1) (9, 11, 15, 18).
La endocarditis infecciosa tiene especial incidencia en la patología valvular congénita, en los defectos septales y/o en el endocardio mural. Por ello la existencia de defectos cardiacos es un factor de riesgo importante de endocarditis bacteriana. Existen muchos tipos de cardiopatías congénitas, que además pueden presentarse de forma única o múltiple. De éstas las que más frecuentemente desarrollan la endocarditis bacteriana son:
— Comunicación interauricular (40% de los casos curan solas antes de los 2 años; 99% de los casos tratados quirúrgicamente tienen éxito).
— Comunicación interventricular (si la comunicación es de pequeñas dimensiones puede cerrar de forma espontánea en niños menores de 7 años aunque la mayoría de los casos requiere la intervención quirúrgica).
— Canal auriculoventricular (relacionado con el síndrome de Down y requiere tratamiento quirúrgico).
— Conducto arterial persistente (produce alta incidencia de endocarditis bacteriana y su tratamiento es quirúrgico urgente).
— Estenosis valvular aórtica y estenosis valvular pulmonar (debe dilatarse la vávula mediante intervención urgente o valvuloplastia con balón, también se emplean STENTS y válvulas cardiacas artificiales).
— Coartación de la aorta (estrechamiento anormal a la salida de la arteria aorta).
— Tetralogía de Fallot (combina comunicación interventricular, coartación de la arteria pulmonar, comunicación aortico-interventricular e hipertrofia ventricular derecha).
— Aorta bicúspide.
— Valvulopatías degenerativas como calcificaciones de velos valvulares. Prolapso mitral sobre todo cuando se acompaña de insuficiencia valvular.
— Prótesis cardiacas y marcapasos (2, 12, 13).
Fisiopatología
La endocarditis bacteriana presenta diferente patogenia según su presentación, que puede ser aguda o subaguda.
La endocarditis bacteriana subaguda tiene un desarrollo en un tiempo superior a un mes. Se localiza principalmente en el tejido cardiaco con lesión valvular previa o cardiopatía de base y permita el paso de sangre de compartimentos de mayor presión a menor presión (comunicaciones interauriculares e interventriculares).
Esta endocarditis se presenta tras el paso de Streptococcus (viridans o del grupo HACEK: Haemophilus, Actinobacillus, Cardiobacterium, Eikenella y Kingella) a la sangre o a la activación de éstos si ya estaban presentes. Dichos agentes infecciosos son responsables del 50-70% de todas las endocarditis infecciosas. Cada vez que el corazón bombea la sangre al contraer su musculatura, el volumen sanguíneo sigue dos trayectos:
En el trayecto fisiológico o normal la sangre parte desde la aurícula derecha al ventrículo derecho, desde ahí parte a través de la arteria pulmonar a los pulmones. La sangre que llega a los pulmones retorna al corazón a través de las venas pulmonares a la aurícula izquierda, desde donde es bombeada al ventrículo izquierdo. A continuación sale del ventrículo izquierdo a través de la arteria aorta para distribuirse por todo el organismo. Finalmente la sangre es recogida por las venas cavas, que la retornan a la aurícula derecha.
En el trayecto patológico se produce un efecto de presión negativa o efecto Venturi que lesiona al tabique dejando expuesto el colágeno al torrente sanguíneo. En este punto se forma un trombo estéril por agregación de plaquetas, éstas por su parte segregan sustancias quimiotácticas que atraen a los Streptococcus y se forma un coágulo infeccioso llamado vegetación.
La endocarditis bacteriana aguda tiene un inicio mucho menos insidioso, inferior a cuatro semanas, y está producida por Stafilococcus aureus (gérmenes mucho más patógenos) con alta afinidad por el endocardio. Los Stafilococcus aureus producen el 30-40% de las endocarditis infecciosas. Al unirse al tejido cardiaco desprenden sustancias quimiotácticas que atraen a las plaquetas y formando trombos bacterianos.
Las fuentes de infección son diversas. Entre ellas existen procedimientos que pueden llegar a producir bacteriemias, como son los catéteres, inyecciones intravenosas por parte de drogadictos, instrumental, mala higiene oral, procedimientos dentarios…
La endocarditis infecciosa de causa dental se debe al grupo de Streptococcus viridans fundamentalmente, pues aparece en un 85% de pacientes durante el tratamiento dental. Pelletier y Thompson describen que la producción de dextro extracelular por Streptococcus puede ser un factor importante en el aumento de la adherencia de S. viridans a válvulas cardiacas defectuosas. Este mismo dextrano celular causa la adherencia de Streptococcus al diente.
La bacteriemia dental puede darse también en ausencia de procedimientos dentales, tales como infecciones periodontales o periapicales, úlceras…; por ello, una buena higiene oral es esencial para los pacientes susceptibles de sufrir una bacteriemia. (2-4).
Clínica
Es importante conocer la clínica de las endocarditis y saber diferenciarlas ya que de este modo aumenta la probabilidad de éxito del tratamiento y puede justificar un adecuado procedimiento profiláctico.
I. Endocarditis aguda: la infección se produjo recientemente, aparece un cuadro general de tipo gripal, con fiebre, sudoración nocturna, dolor muscular generalizado (polimialgias) de las articulaciones (poliartralgias) y astenia, decaimiento general.
II. Endocarditis crónica: puede durar varios meses, se manifiesta por un cuadro general febril, que aparece después de tener escalofríos, se manifiesta por astenia, cansancio, pérdida de peso, dolor en las articulaciones, sudoración nocturna o los síntomas de una insuficiencia cardiaca. Se prolonga más tiempo, apareciendo de forma más lenta que la anterior.
Otros síntomas pueden incluir manchas rojizas en las palmas de las manos y las plantas de los pies (denominadas lesiones de Janeway) o lesiones rojizas dolorosas en las puntas de los dedos de las manos y de los pies (denominadas nódulos de Osler) (3-5).
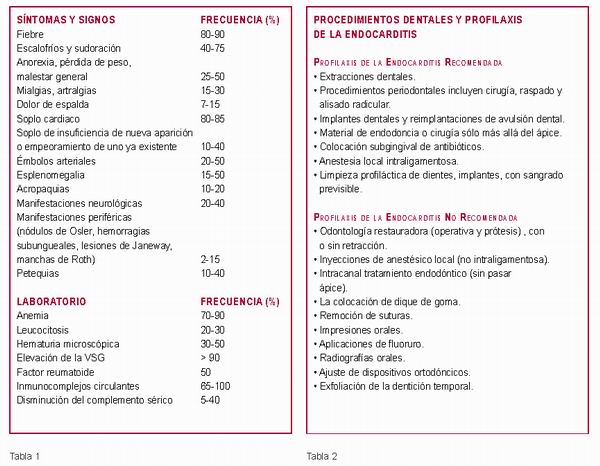
A continuación, la Tabla 1 muestra los porcentajes de frecuencia de los síntomas y signos de la enfermedad.
Profilaxis
La profilaxis de la endocarditis bacteriana va encaminada a reducir las posibilidades de bacteriemia producida a partir de una solución de continuidad del tejido epitelial o bien de la alteración de la estasis de una infección localizada a través de una manipulación quirúrgica o traumática sobre pacientes de riesgo. La bacteriemia normalmente viene seguida de la endocarditis. Tras conocer los gérmenes más frecuentes implicados en la bacteriemia, puesto que estas bacterias son sensibles a algunos antibióticos, estos deben administrarse a pacientes con lesiones predisponentes para endocarditis antes de que se produzcan los procedimientos que causan bacteriemia. Sin embargo, todavía no existen datos definidos de que la profilaxis con antimicrobianos sea efectiva en prevenir la endocarditis, o sólo lo sea en una pequeña proporción (5-10%) (6,11, 18).
La mayoría de los procedimientos quirúrgicos y dentales, así como instrumentaciones que involucra las mucosas o tejidos contaminados ocasionan bacteriemia transitoria, no superior a 15 minutos.
Desde 1955, la AHA recomienda que los pacientes con riesgo de endocarditis infecciosa tomen antibióticos antes de someterse a aquellos procedimientos en los que las bacterias puedan entrar al torrente sanguíneo. Esto puede suponer una medida preventiva justificada por:
• La endocarditis infecciosa es peligrosa.
• Es mejor prevenirla que tener que tratarla.
• Determinadas condiciones pueden aumentar su aparición (cardiopatías previas, existencia de bacterias en el medio bucal, materiales empleados en el tratamiento dental, posibles soluciones de continuidad del tejido epitelial…).
• Los procedimientos dentales aumentan la cantidad de bacterias y hongos en la sangre.
• Los antibióticos deberán prevenir su instalación en el corazón.
El quinto punto ha sido puesto en duda los últimos años. Estudios recientes muestran que el masticar chicle, el palillo de dientes o incluso lavárselos puede suponer también una causa de endocarditis. De hecho, la exposición de bacteriemia al lavarnos los dientes dos veces al día durante un año es 154.000 veces mayor que si nos sometemos a una extracción.
Este problema se plantea ya que además se sabe de los antibióticos que pueden ocasionar erupciones y diarreas, dañar el estómago, reacciones alérgicas y resistencias a antibióticos (7, 18, 19).
Así, la ADA recomienda no hacer profilaxis en todos los casos y en todo tipo de tratamientos (ver Tabla 2) (8, 16, 19).
De este modo, la tendencia es que sólo los pacientes que se han sometido a una sustitución valvular cardiaca, los que han tenido una endocarditis y aquellos con defectos cardiacos congénitos, enfermedad valvular documentada o cardiomiopatía hipertrófica son susceptibles de realizar profilaxis antibiótica antes de un procedimiento dental o quirúrgico (7, 8).
Indicaciones:
— Pacientes de riesgo en los que está indicada la profilaxis antibiótica:
Portadores de prótesis valvulares cardiaca
Transplante de corazón que desrrolla valvulopatía.
Antecedentes de endocarditis bacteriana.
Enfermedad cardiaca congénita (ECC):
• con cianosis no reparada (incluye conductos y shunts paliativos).
• ECC reparada con material protético que todavía tiene defecto residual.
• Los 6 primeros meses de ECC reparada totalmente (sin defectos residuales) para permitir la completa endotelización.
— Pacientes de moderado riesgo:
Profilaxis para procedimientos dentales, cavidad oral, tracto respiratorio o esofágico en niños (Tabla 3).
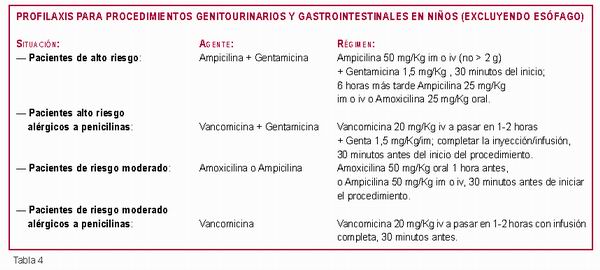
Profilaxis para procedimientos génitourinarios y
gastrointestinales en niños (excluyendo esófago)
(Tabla 4) (9, 10, 11, 14).
Tratamiento
El tratamiento está fundamentalmente dirigido a paliar el factor causal, es decir antibioterapia, que inicialmente puede ser empírica, utilizando antibióticos de amplio espectro. Y cuando se obtenga el resultado del cultivo y del antibiograma, deberá centrarse en la utilización del antibiótico, al cual resulte sensible el germen aislado. El éxito del tratamiento de la infección depende de conocer el agente causal y estudiar su sensibilidad frente a los diferentes antibióticos.
Debido a la naturaleza del agente causal y su frecuencia suele estar indicado como antibiótico de elección el grupo Cefalosporina. Si las válvulas cardiacas han sido dañadas por vegetaciones, posiblemente deba realizarse una intervención quirúrgica.
Llegados a estos casos el tratamiento de la endocarditis bacteriana es médico-quirúrgico y sus objetivos son curar el proceso infeccioso y corregir el daño producido por la enfermedad (4-6, 11, 17).
 |
 |
 |
Bibliografía
1.Dajani AS, Taubert KA, Wilson W, Bolger AF, Bayer A, Ferrieri P, Gewitz MH, Shulman ST, Nouri S, Newburger JW, Hutto C, Pallasch TJ, Gage TW, Levison ME, Peter G, Zuccaro G Jr. Prevention of bacterial endocarditis. Recommendations by the American Heart Association. Circulation. 1997; 96 (1): 358-66. JAMA 1997; 277 (22): 1794-801.
2.Karchmer AW. Endocarditis infecciosa. En: Braunwald E et al.
3.Harrison. Principios de Medicina Interna. 15ª ed. Madrid: McGrawHill; 2002. p. 958-968.
4.López Medrano F, Julián Olalla Sierra J, Izco Esteban S. Endocarditis infecciosa. En: Manual 12 de Octubre. 5ª ed. Manual de diagnóstico y terapéutica médica. Hospital Universitario 12 de Octubre. 5ª edición. Madrid: Hospital 12 de Octubre; 2003, pp. 443-453.
5.Mylonakis E, Calderwood SB. Infective Endocarditis in Adults. N Engl J Med 2001; 345: 1318-1330.
6.Vallés F, Anguita M, Escribano MP, Pérez Casar F, Pousibet H, Tornos P. et al. Guías de práctica clínica de la Sociedad Española de Cardiología en endocarditis. Rev Esp Cardiol 2000; 53: 1384-1396.
7.Merino Morras, Elizabeth. Profilaxis de la Endocarditis Infecciosa en la Consulta Odontológica. Normas Actuales de la Asociación Americana del Corazón. Acta Odontol. Venez, dic. 2002, vol.40, no.3, p.301-304. ISSN 0001-6365.
8.Sykes RB, Farrington E. Prophylaxis for bacterial Endocarditis Prior to dental prodecure in children, J Pediatric Health Care, 2007; 21(4):256-8.
9.O"Sullivan J, Anderson J, Bain H. Infective endocarditis in children following dental extraction and appropriate antibiotic prophylaxis, Br Dent J, 1995; 181 (2): 64-65.
10.Martin MV. An end to antimicrobial prophylaxis against infective endocarditis for dental procedures? Br Dent J, 2008; 204 (3): 107.
11.Walker MP. Infective endocarditis: dental implications, prevention, and prophylaxis failure. Clin Prev Dent 1984: 6(3): 17-19.
12.Deppe H, Auer-Bahrs J, Kolk A, Hall D, Wagenpfeil S. Need for dental treatment cardiac valve surgery: A clinical study, Journal of cranio-maxillofacial surgery (2007). J Craniomaxillofac Surg. 2007 Sep-Oct;35(6-7):293-301.
13.Siddiqui BK, Tariq M, Jadoon A, Murtaza G, Syed A, Bilal Abid M, Qamaruddin M, Atiq M, Smego RA. Infective endocarditis in patients with congenitally malformed hearts: characterization of the syndrome in a developing country. Cardiol Young. 2007 Dec;17(6):623-30.
14.Scaling Back on ATB, Harvard Medical School Vol18, Nº2, Oct 2007.
15.http://www.ncbi.nlm.nih.gov/pubmed/17446442?dopt=Abstract.
16.http://www.clevelandclinicmeded.com/medicalpubs/diseasemanagement/infectiousdisease/prophylaxis/ table2prophylaxis.htm.
17.http://www.webodontologica.com/odon_noti_endocard.asp.
18.http://europa.sim.ucm.es/compludoc http://www.guideline.gov/summary/summary.aspx?ss=15&doc_id= 11687&nbr=6034#s24.
19.http://circ.ahajournals.org/cgi/reprint/CIRCULATIONAHA.106.183095.
20.Wilson W, Taubert KA, Gewitz M. Prevention of infective endocarditis… J Am Dent Assoc. 2007 Jun;138(6):739-45, 747-60




