El objetivo final del uso de biomateriales en ingeniería de tejidos y en la medicina regenerativa es la reparación y la mejora funcional de tejidos y órganos. La calidad superficial (física, química y topográfica) de un biomaterial es determinante para conseguir respuestas específicas para la adecuada regeneración de cada uno de los tejidos biológicos.
Autores:
Dr. Pablo Sevilla / D.ª Marta Sevilla* / Dra. Marta Pegueroles / Dr. Emiliano Salvagni / Dr. Daniel Rodríguez / Dr. F. Javier Gil. Biomaterials, Biomechanics and Tissue Engineeering Reserach Group. Dept. Ciencia de Materiales e Ingeniería Metalúrgica. ETSEIB. Universidad Politécnica de Catalunya Diagonal 647. 08028-Barcelona. *Zarana. España
La comunidad científica está poniendo especial atención en estrategias de modificación superficial, tales como la modificación de la topografía superficial (formas y relieves que configuran una superficie) y, más recientemente, la biofuncionalización del material con biomoléculas que poseen una actividad biológica conocida.
La biofuncionalización se define como una modificación de las propiedades fisicoquímicas de la superficie de cualquier material, que permite incidir en el comportamiento de las células que entren en contacto con el biomaterial (como puede ser un implante o una prótesis) a fin de mejorar la respuesta biológica del organismo ante el material con el que se ha fabricado el implante. Este nuevo concepto permite la mejora de las propiedades superficiales de los implantes dentales para obtener efectos beneficiosos como una osteointegración más rápida, un mejor sellado biológico o superficies con propiedades antibacterianas, entre otros.
El grupo de Biomateriales, Biomecánica e Ingeniería de Tejidos (BIBITE) de la UPC trabaja para desarrollar nuevas superficies de titanio que promuevan ciertas respuestas biológicas como por ejemplo una mayor adhesión de las células óseas a la superficie del implante dental. Las estrategias empleadas por los investigadores para modificar la superficie del titanio se describen a continuación:
Tensión superficial óptima
Todos hemos visto cómo algunos insectos, como el zapatero, son capaces de desplazarse por la superficie del agua sin hundirse, o cómo una gota de agua encima de un pétalo de flor de loto tiene una forma prácticamente esférica. El agua, como cualquier líquido, tiene una resistencia inherente a aumentar de superficie. Aquellos sólidos que entren en contacto con el agua y que tengan una baja energía superficial no serán capaces de mojarse. Este es el caso de las patas del zapatero y los pétalos de la flor de loto.
Cuando un implante es insertado en el cuerpo humano se sucede una cascada de reacciones que comienza por la hidratación del implante al entrar en contacto con los fluidos corporales. A continuación las proteínas que se encuentran alrededor del implante que acaba de invadir el hueso se adhieren a su superficie. Más tarde se inicia la adhesión celular donde las células del hueso se adhieren, principalmente, a la capa de proteínas que ha impregnado, previamente, la superficie. Finalmente las células pueden generar comportamientos diversos, como la muerte celular (apoptosis), reproducirse, migrar o diferenciarse en numerosos tipos de células.
La energía superficial y la electronegatividad de una superficie tienen gran importancia en la adhesión celular y en la adsorción de proteínas una vez se ha insertado el implante en el cuerpo. Las superficies que obtengan una adsorción proteica óptima permitirán una mejor adhesión de las células y, por tanto, una mayor osteointegración a corto plazo, es decir, una mejor integración del implante al hueso donde ha sido fijado.
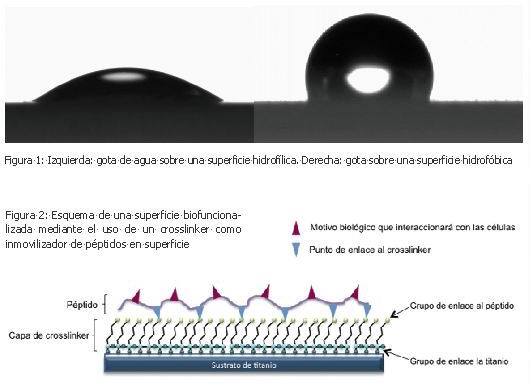
Todas las superficies tienen una determinada afinidad por el agua. Hay superficies que se mojan fácilmente cuando entran en contacto con el agua, como por ejemplo el papel de cocina, mientras que otras tienen más dificultad para empaparse como podría ser el caso de un impermeable. Esta propiedad es conocida comúnmente como energía superficial. Un valor que define cuán hidrofílica o hidrofóbica es una superficie. El valor de energía superficial viene definido, principalmente, por la composición química de la superficie de un material, aunque las propiedades físicas y la topografía de la superficie pueden variar significativamente este valor. Es bien conocido que, con algunas excepciones, las células tienden a adherirse a superficies medianamente hidrofóbicas antes que a superficies hidrofílicas. Por decirlo de otro modo, las células se adhieren con mayor facilidad a una superficie impermeable que en una que permita la humidificación. La técnica más utilizada para determinar la energía superficial de un material es la medición ángulo de contacto. En esta técnica, una pequeña gota de un líquido conocido, generalmente agua, se posa sobre la superficie a estudiar y se mide el ángulo que se forma entre la superficie y la gota (Figura 1). Si este ángulo es pequeño la energía superficial será alta y la superficie será hidrofílica. Si por el contrario el ángulo de contacto es elevado se dice que la superficie es hidrofóbica.
Otra técnica muy utilizada en este campo es el “análisis del potencial Z”, que permite medir la electronegatividad de una superficie en función del pH del medio en el que se encuentra esta superficie. Una superficie con un potencial positivo adsorberá, principalmente, proteínas que tengan carga negativa, mientras que una superficie con un potencial negativo tenderá a lo opuesto. Dependiendo de las proteínas que quedan adheridas en la superficie del implante las células en contacto pueden tener comportamientos diversos, como por ejemplo proliferar de manera más intensa o producir hueso con mayor rapidez.
El control de estos parámetros superficiales permite obtener mejoras significativas a corto plazo en la respuesta biológica del sistema donde se inserta el implante.
 |
Péptidos para conseguir implantes dentales más sanos
Como se ha comentado anteriormente, la adhesión y el comportamiento celular alrededor del implante viene dado, en parte, por la naturaleza y tipo de las proteínas que han quedado adsorbidas en la superficie del implante al ser insertado. Por tanto, ¿por qué no seleccionar las proteínas o péptidos óptimos para la superficie del implante y adherirlas al mismo antes de ser implantado?
Esta estrategia, aunque muy efectiva, es más difícil y costosa que la anterior. Requiere de tratamientos químicos de la superficie, fabricación u obtención de las moléculas que se deseen adherir al implante y asegurar que estas moléculas no se desprendan de la superficie al insertar el implante.
Las superficies de titanio no tienen una gran afinidad por las moléculas biológicas y por este motivo los enlaces que se producen entre las proteínas y la superficie de titanio no son fuertes, pudiendo desprenderse con facilidad al manipular el implante. Por ello es necesario desarrollar métodos para fijar o inmovilizar los péptidos deseados a la superficie del titanio. La técnica más utilizada es la de intercalar, entre la superficie y el péptido, una molécula orgánica, un “crosslinker”, que por un lado se pueda enlazar al titanio y por otro a la molécula biológica, o péptido, que deseemos inmovilizar en la superficie.
La Figura 2 muestra un esquema de la inmovilización de una biomolécula en superficie mediante la adición de un “crosslinker”.
Mediante esta técnica se pueden inmovilizar, en la superficie del titanio, una diversidad infinita de biomoléculas que pueden inducir diferentes comportamientos en el tejido que circunda al implante. Existe una gran cantidad de péptidos de los cuales se conoce su comportamiento biológico, como la secuencia RGD, presente en la mayoría de proteínas de unión celular.
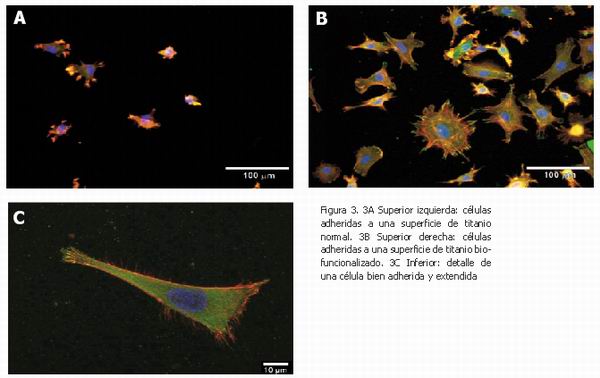
Los péptidos que los investigadores de la UPC inmovilizan en las superficies de titanio contienen secuencias de adhesión celular, como la RGD entre otras, para promover la adhesión de las células óseas a la superficie del implante. Estos péptidos presentes en la superficie del titanio provocan un mayor número de células adheridas a la superficie y, lo que es más importante, una mayor extensión de las células haciendo que éstas tengan una mayor superficie de contacto con el implante. La Figura 3 muestra imágenes de microscopía de fluorescencia donde se pueden ver las células adheridas y extendidas en la superficie de titanio.
 |
Superficies que sean capaces de liberar fármacos una vez implantadas
Esta línea de investigación difiere de la anterior, principalmente, en que el objetivo no es fijar los péptidos o biomoléculas a la superficie de manera irreversible sino la obtención de una superficie que admita la adhesión de una gran cantidad de péptidos y que éstos se vayan liberando progresivamente una vez se haya insertado el implante. Esta liberación se consigue fabricando superficies susceptibles de ser degradadas en el medio fisiológico. A medida que la superficie que contiene los péptidos se va disolviendo, los péptidos son liberados al entorno para interactuar con las células y proteínas que se encuentren en las inmediaciones del implante, permitiendo así, incidir no sólo en la interfaz implante-célula sino también en el entorno que envuelve al implante. Mediante esta estrategia se puede incluir, en la superficie, péptidos que inhiban la inflamación, moléculas antibacterianas o promotores de la producción de tejido óseo.
Todos estos avances tecnológicos se pueden combinar con las estrategias ya adoptadas por los fabricantes para optimizar la rugosidad de las superficies por granallado o ataque ácido. Esta combinación provocará un aumento sinérgico en la osteointegración de los implantes de la próxima generación.
 |
Pablo y Marta Sevilla.



