La desinfección y esterilización del instrumental dental – en general, los métodos de esterilización en odontología – son de suma importancia debido a la posibilidad de transmisión de enfermedades infecciosas.
Tanto la Asociación Dental Americana (ADA) como el Centro de Control y Prevención de Enfermedades Infecciosas (CDC), la Administración de Seguridad en Salud Ocupacional (OSHA) y la ley de Ordenación Sanitaria de la Comunidad de Madrid (LOSCAM) han establecido una serie de medidas para la prevención y control de infecciones en Odontología, las cuales tienen como objetivo disminuir los riesgos de transmisión cruzada que existen en la clínica dental (1-5) (Tablas 2 y 3).
En el próximo número de GACETA DENTAL abordaremos la limpieza, desinfección y esterilización del material de la clínica.
Características de los métodos de limpieza, desinfección y esterilización
Agentes desinfectantes más utilizados en la clínica dental (7, 13, 15, 17, 18)
Los desinfectantes deben cumplir las siguientes propiedades básicas: no deben ser tóxicos, compatibles con las superficies a tratar, fáciles de usar y no contaminar el medio ambiente. Los desinfectantes, por lo general, son agentes químicos (pueden ser físicos) que destruyen agentes patógenos u otros microorganismos dañinos, pero no pueden eliminar las esporas bacterianas. Su indicación depende de su mecanismo de acción como se especifica en la tabla 1.
Alcohol
En el ámbito sanitario los alcoholes más utilizados son el alcohol etílico y el alcohol isopropílico. Estos alcoholes son tuberculicidas, fungicidas y viricidas, pero no destruyen las esporas bacterianas.
Su actividad bactericida se afecta cuando se diluye por debajo del 50% de concentración, y su concentración óptima es de 60%-90% en soluciones de agua (volumen/volumen).
Mecanismo de acción
La acción antimicrobiana del alcohol se produce mediante la desnaturalización de las proteínas. El alcohol etílico absoluto es menos bactericida que la mezcla de alcohol y agua, porque las proteínas se desnaturalizan más rápidamente en presencia de agua.
Ventajas
• Son bactericidas, viricidas, tuberculicidas y fungicidas.
• Concentraciones óptimas entre 60%-90%.
• Para limpieza de superficies, el 70% es adecuado.
Desventajas
• No se recomiendan para la esterilización de material médico y quirúrgico.
• Falta de acción esporicida.
• No pueden penetrar dispositivos contaminados por materia rica en proteínas.
• Son inflamables.
• Se evaporan rápidamente.
• Si se diluye por debajo del 50% pierden su efecto bactericida.
Precauciones
• Deben ser almacenados en un lugar fresco y bien ventilado.
• Es necesario que el instrumental se encuentre inmerso, debido a que su tiempo de exposición no es prolongado.
Clorhexidina (CHX) (18)
El gluconato de clorhexidina es una bisguanida catiónica. La acción inmediata se produce más lentamente que la de los alcoholes. La clorhexidina actúa contra bacterias Gram + y Gram -. La clorhexidina no es esporicida.
Es recomendable tener en cuenta que se afecta por la presencia de material orgánico, incluida la sangre. Debido a que la clorhexidina es una molécula catiónica, su actividad puede ser reducida por los jabones naturales, inorgánicos, diversos aniones, surfactantes no iónicos y cremas para manos que contienen agentes emulsionantes.
Mecanismo de acción
Su actividad antimicrobiana es atribuible a la conexión y posterior interrupción de las membranas citoplasmáticas, lo que resulta en la precipitación de contenidos celulares.
Ventajas
• Buena actividad residual.
• Reacciones alérgicas escasas.
• Buena tolerancia.
• Pacientes portadores de prótesis que requieran mayor higiene deben realizar colutorios de CHX (0,12% 2-3 veces al día).
• Indicada para desinfección y cuidado de las prótesis dentales.
Desventajas
• Se inactiva por la presencia de restos orgánicos, incluida la sangre.
• No es esporicida
• Puede inactivarse frente a jabones naturales y cremas que contengan agentes emulsionantes aniónicos.
• Se debe evitar el contacto con los ojos cuando es en concentraciones > 1%, porque podría producir irritación.
Glutaraldehído
El glutaraldehído es un dialdehído saturado utilizado como desinfectante de alto nivel y esterilizante químico. Las soluciones acuosas de glutaraldehído son ácidas y, en general, en este estado no es esporicida. Sólo cuando la solución se alcaliniza (activación) por el uso de agentes alcalinizantes a un pH de 7,5-8,5, se convierte en solución esporicida. Una vez activadas, estas soluciones tienen una vida útil mínima de 14 días debido a la polimerización de las moléculas de glutaraldehído a niveles de pH alcalino.
Mecanismo de acción
Su actividad se basa en la alquilación (reacción química que tiene como fin transferir de una molécula a otra un grupo hidrocarbonado o sustituto del mismo) de grupos sulfidrilo, hidroxilo, carboxilo y amino de los microorganismos, lo que altera la síntesis de ARN y ADN y Proteínas.
Ventajas
• Desinfectante de alto nivel y esterilizante químico.
• Excelentes propiedades bactericidas.
• Actúa aun en presencia de materia orgánica.
• No corroe material plástico, ni de caucho
Desventajas
• Pierde rápidamente su actividad (14 días).
• Irritación de las mucosas (ojos, nariz).
• Puede producir irritación de la piel (dermatitis)
• No debe usarse para limpiar superficies no críticas por su coste y toxicidad.
 |
| Tabla 1. Cuadro esquemático sobre los desinfectantes más utilizados en la clínica odontológica (17, 18). |
Hipoclorito (18)
La actividad microbicida del cloro se atribuye principalmente al ácido no disociado hipocloroso (HOCl). La eficacia de la desinfección del cloro disminuye con el aumento de pH. Se debe tener cuidado en la clínica dental con las soluciones de hipoclorito cuando entran en contacto con el formaldehído, ya que son considerados un peligro potencial en la producción del carcinógeno bis (clorometil) éter.
La concentración de cloro en el hipoclorito de sodio de uso doméstico es de 5,25-6,15%.
Mecanismo de acción
La inactivación por cloro de las bacterias puede ser resultado de una serie de factores: la oxidación de las enzimas sulfhidrilo y aminoácidos, la cloración del anillo de los aminoácidos, la pérdida del contenido intracelular, disminución de la captación de nutrientes, la inhibición de la síntesis de proteínas, disminución de la captación de oxígeno, disminución de la producción de adenosina trifosfato y roturas de las cadenas de ADN.
El mecanismo microbicida del cloro puede implicar una combinación de estos factores o el efecto del cloro sobre sitios críticos.
Ventajas
• Amplio espectro de actividad antimicrobiana.
• No deja residuos tóxicos.
• Son de bajo coste y rápida acción.
• Tienen baja incidencia de efectos adversos severos.
• Son usados en la desinfección de suelos y superficies.
• Son usados para la desinfección de prótesis acrílicas (1-2%).
Desventajas
• Puede producir irritación ocular, de orofaringe y esófago a concentraciones de uso doméstico.
• Corrosión de metales en concentraciones elevadas (>500ppm).
• Se inactiva por materia orgánica (sangre).
• Liberación de gas cloro tóxico si se mezcla con ácidos o amoníaco.
• Decoloración de tejidos.
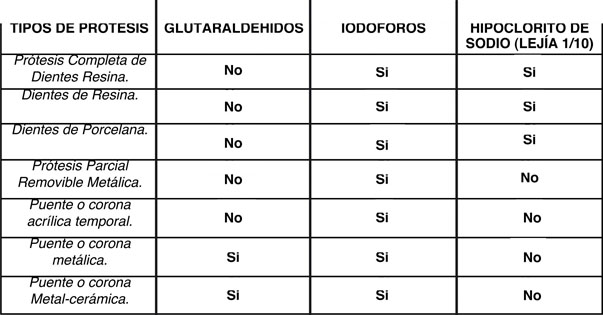 |
| Tabla 2. Guía para la desinfección de Prótesis. ADA (Asociación Dental Americana) (1). |
Formaldehído
El formaldehído se utiliza como desinfectante y esterilizante, tanto en su estado líquido como gaseoso. Se utiliza principalmente como una solución a base de agua llamada formalina, que es formaldehído al 37%. La solución acuosa es un bactericida, tuberculicida, fungicida, viricida y esporicida. La OSHA indicó que el formaldehído debe ser manejado en el lugar de trabajo como un carcinógeno potencial y establecer un estándar de exposición de los empleados para el mismo, los límites de tiempo son de 8 horas. La ingestión de formaldehído puede ser mortal y la exposición prolongada a bajos niveles en el aire o en la piel puede causar problemas respiratorios como asma, irritación de la piel como dermatitis y picores. Por estas razones, los empleados deben tener un contacto directo limitado.
Mecanismo de acción
El formaldehído inactiva los microorganismos por alquilación de los grupos amino y sulfidral de las proteínas y los átomos de nitrógeno.
Ventajas
• La solución acuosa es bactericida, viricida, tuberculicida, fungicida y esporicida, pero necesita mayor tiempo que el glutaraldehído.
• Entre otros usos en la atención sanitaria se ha utilizado como agente de embalsamamiento y preservación de especímenes anatómicos.
• Históricamente se utilizó para esterilizar instrumentos quirúrgicos, especialmente, al mezclarse con etanol.
Desventajas
• Sus usos en atención sanitaria están limitados por sus vapores irritantes y su olor a acre, incluso hasta en niveles muy bajos (< 1ppm).
• Se considera un carcinógeno potencial (OSHA): posible relación con el cáncer nasal y de pulmón.
• La ingestión puede ser mortal.
• La exposición en aire, aunque sea a bajos niveles, puede provocar asma y problemas respiratorios.
• Tiene un límite de exposición máxima permitida (2ppm).
Compuesto de amonio cuaternario
Los compuestos de amonio cuaternario son ampliamente utilizados como desinfectantes, son buenos agentes de limpieza, pero materiales como el algodón y gasas pueden hacerlos menos microbicidas debido a que éstos pueden absorber los principios activos.
El cloruro de benzalconio es el más usado como desinfectante. Los compuestos de amonio son los más usados como antiséptico: poseen un átomo de nitrógeno unido a 4 grupos alquilo. Presentan mayor actuación frente a Gram + que Gram .
Mecanismo de acción
La acción bactericida de los cuaternarios se ha atribuido a la inactivación de las enzimas productoras de energía, la desnaturalización de las proteínas celulares esenciales y la alteración de la membrana celular. Existe evidencia que apoya estas y otras posibilidades.
Ventajas
• Son bacteriostáticos, viricidas y fungicidas, pueden ser microbicidas para determinados microorganismos a altas dosis.
• Usualmente son bien tolerados.
• Se usan para la limpieza de superficies no críticas como suelos, muebles y paredes.
Desventajas
• Su actividad se ve afectada negativamente por la presencia de materia orgánica.
• No son esporicidas ni tuberculicidas.
• No son compatibles con los detergentes aniónicos.
Derivados fenólicos
Los derivados fenólicos se originan cuando un grupo funcional (como pueden ser alquilo, fenilo, bencilo, halógeno, etc.) sustituye a uno de los átomos de hidrógeno en el anillo aromático.
Dos derivados fenólicos comúnmente encontrados como desinfectantes son orto-fenilfenol y orto-bencil-para-clorofenol.
Mecanismo de acción
En altas concentraciones de fenol penetran y alteran la pared celular precipitando las proteínas celulares. En bajas concentraciones de fenol y mayor peso molecular los derivados fenólicos pueden causar la muerte bacteriana mediante la inactivación de los sistemas enzimáticos esenciales y fuga de metabolitos esenciales de la pared celular.
Ventajas
• Son bactericidas, viricidas, tuberculicidas y fungicidas.
• Uso para descontaminar superficies ambientales y dispositivos médicos no críticos.
• Pueden ser utilizados en prelavado o descontaminación de los dispositivos críticos y semicríticos antes de la esterilización o de la desinfección de alto nivel.
Desventajas
No son aprobados por la FDA como desinfectantes de alto nivel.
Para evitar el riesgo de transmisión de agentes patógenos y enfermedades en la clínica dental se deben realizar siempre los siguientes procedimientos explicados en la tabla 2 para garantizar el cuidado tanto del paciente, como del personal sanitario y el control de la infección.
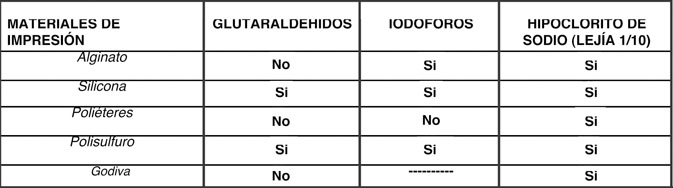 |
| Tabla 3. Guía para la desinfección de Materiales de Impresión. ADA (Asociación Dental Americana) (1). |
Iodóforos (povidona yodada) (7, 12)
Los iodóforos son una combinación de yodo y un agente solubilizante (están compuestos de yodo elemental, yoduro o triyoduro, y un polímero de alto peso molecular). La cantidad de yodo presente determina el nivel de la actividad antimicrobiana. El iodóforo más conocido y más ampliamente utilizado por el personal sanitario es la povidona-yodada, un compuesto de polivinil-pirrolidona con yodo. Este producto y otros iodóforos mantienen la eficacia germicida del yodo pero, a diferencia de éste, son relativamente libres de toxicidad e irritación.
Mecanismo de acción
Las moléculas de yodo penetran rápidamente la pared celular de los microorganismos e inactivan las células mediante la formación de complejos con aminoácidos y ácidos grasos insaturados, alterando la síntesis de proteína y las membranas celulares.
Ventajas
• El yodo y los iodóforos tienen actividad bactericida contra Gram +, Gram -, son activos contra las microbacterias, virus y hongos.
• Se utilizan como antisépticos y desinfectantes de:
1. Prótesis y materiales de impresión (ADA).
2. Lavado de manos (concentraciones de 7,5%-10% de povidona-yodada).
• Causan menos irritación de la piel y menos reacciones alérgicas que el yodo sin diluir.
Desventajas
• La actividad antimicrobiana de los iodóforos puede verse afectada por diferentes factores –el pH, la temperatura, la concentración de yodo disponible total, y la cantidad y tipo de compuestos orgánicos e inorgánicos presentes (alcoholes y detergentes)–.
• Pueden producir dermatitis de contacto e irritación en comparación con otros antisépticos comúnmente utilizados para la higiene de manos.
• La actividad antimicrobiana de iodóforos se reduce sustancialmente en presencia de sustancias orgánicas (por ejemplo, sangre o esputo).
• Requieren tiempos prolongados de contacto para eliminar hongos y esporas bacterianas.
• En concentraciones usadas como antisépticos, los iodóforos no son esporicidas.
Las soluciones de yodo han sido utilizadas por los profesionales de la salud, principalmente, como antisépticos en la piel o tejidos. Las concentraciones más bajas de povidona yodada también tienen buena actividad antimicrobiana, ya que a mayor dilución aumenta la cantidad de yodo libre, lo que aumentaría el riesgo de irritación de la piel. Por lo que se debe diluir de acuerdo a las instrucciones del fabricante para lograr la actividad antimicrobiana deseada.
Continúa leyendo la segunda parte del artículo
BIBLIOGRAFÍA:
1. Comunidad Autónoma de Madrid: Prevención y control de enfermedades transmisibles. Recomendaciones en Odontoestomatología.
2. ADA Council on Scientific Affairs and ADA Council on Dental Practice: (1996) Infection control recommendations for the dental office and the dental laboratory. JADA, vol. 127, May, 672-80.
3. Accepted Dental Therapeutics:(1982) Sterilization or Desinfection of Dental Instruments. 39th ed, 100-14.
4. Folleto Informativo del Grupo Técnico de Patología Bucal MSAS (1994): Normas para la Prevención y Control de Enfermedades Infecciosas en la práctica Odontológica.
5. Torres y Ehrlich: (1995) Disease Transmission and Infection Control in Modern Dental Assisting, 5th edition, Philadelphia, WB Saunders.
6. 2007 Guideline for Isolation Precautions: Preventing Transmission of Infectious Agents in Healthcare Settings.
7. William A. Rutala, Ph.D, David J. Weber, M.D., M.P.H, and the Healthcare Infection Control Practices Advisory Committee (HICPAC) Hospital Epidemiology. Guideline for Disinfection and Sterilization in Healthcare Facilities, 2008.
8. ADA Guidelines for infection control. Australian Dental Association Inc. 2008.
9. Jennifer A. Harte Standard and Transmission-Based Precautions: An Update for Dentistry JADA 2010; 141; 572-581.
10. American Dental Association JADA, Vol. 135, January 2004.
11. Palanca Sanchéz I, Ortiz Valdepeñas J, Elola Somoza J, Bernal Sobrino JL, Paniagua Caparrós JL. Unidad central de esterilización: estándares y recomendaciones. Madrid: Ministerio de Sanidad, Política Social e Igualdad; 2011.
12. Jennifer A. Harte, D.D.S., M.S.; M.S.D Characteristics of infection control programs in U.S. Air Force dental clinics. JADA, Vol. 136 July 2005.
13. Guideline for Hand Hygiene in Health-Care Settings Recommendations of the Healthcare Infection Control Practices Advisory Committee and the HICPAC/SHEA/APIC/IDSA. October 25, 2002 / Vol. 51 / No. RR-16.
14. C. J. Palenik, F. J. T. Burke, W. A. Coulter, S. W. Cheung. Improving and monitoring autoclave performance in dental practice British Dental journal, volume 187, no. 11, December 11 1999.
15. Dale N. Gerding, Carlene A. Muto, Robert C. Owens, Jr. Measures to Control and Prevent Clostridium difficile Infection. Measures to Control and Prevent CDI • CID 2008: 46.
16. John A. Molinari, Ph.D. Infection control its evolution to the current standard precautions JADA, Vol. 134, May 2003.
17. Centers for Disease Control and Prevention. Guidelines for Infection Control in Dental Health-Care Settings, 2003. MMWR 2003; 52 (No. RR-17): [inclusive page numbers].
18. Comunidad de Madrid. La Salud Bucodental en los mayores. Prevención y cuidados para una atención integral. Servicio de promoción de la salud. Instituto de Salud Pública. Consejería de Sanidad.